Стандартизованный метод измерения внутренней площади поверхности легких с помощью мышечной пневмоэнцетомии и имплантации протезов
Summary
Внутренняя площадь поверхности легких (ISA) является критическим критерием для оценки морфологии и физиологии легких при заболеваниях легких и вызванной травмой альвеолярной регенерации. Мы описываем здесь стандартизованный метод, который может минимизировать смещение измерения для ISA в моделях мышиной пневмоэктомии и имплантации протезов.
Abstract
Pulmonary morphology, physiology, and respiratory functions change in both physiological and pathological conditions. Internal lung surface area (ISA), representing the gas-exchange capacity of the lung, is a critical criterion to assess respiratory function. However, observer bias can significantly influence measured values for lung morphological parameters. The protocol that we describe here minimizes variations during measurements of two morphological parameters used for ISA calculation: internal lung volume (ILV) and mean linear intercept (MLI). Using ISA as a morphometric and functional parameter to determine the outcome of alveolar regeneration in both pneumonectomy (PNX) and prosthesis implantation mouse models, we found that the increased ISA following PNX treatment was significantly blocked by implantation of a prosthesis into the thoracic cavity1. The ability to accurately quantify ISA is not only expected to improve the reliability and reproducibility of lung function studies in injured-induced alveolar regeneration models, but also to promote mechanistic discoveries of multiple pulmonary diseases.
Introduction
Фундаментальной функцией легкого является обмен кислорода и углекислого газа между кровеносными сосудами и атмосферой. Болезни легких, такие как бронхолегочная дисплазия (БЛД), хроническая обструктивная болезнь легких (ХОБЛ) и острые респираторные инфекции, приводят к снижению ИСА 2 . Исследователи, изучающие болезнь легких, разработали несколько количественных методов для оценки морфологических изменений в легких, включая MLI, ILV, количество единиц газообмена, ISA и соответствие ткани легких 2 , 3 . Пионерские исследования Weibel et al. 4 и Duguid et al. 5 вместе установили, что ISA может использоваться как прямая мера способности газообмена легких в легких человека и может использоваться в качестве критерия для определения тяжести эмфиземы. В ряде исследований, опубликованных за последние пять лет, были использованы морфологические параметры легких ( например, </eM> ISA и MLI) для оценки морфологических и функциональных изменений в легких мышей во время развития 6 и во время восстановления после травмы PNX 1 , 7 . ISA рассчитывается с использованием уравнения 1 8 , 9 :
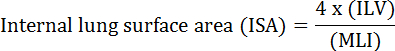
, Где ILV представляет собой внутренний объем легких, а MLI является промежуточным параметром, который представляет собой размер 10 периферического воздушного пространства легких.
Известно, что PNX, хирургическое удаление одной или нескольких легочных долей, индуцирует альвеолярную регенерацию у многих видов, включая людей 11 , мышей 1 , собак 12 , крыс 13 и кроликов 14 , 15 . Шпилькау мышей легких в течение четырнадцати дней после PNX показали , что как расширение уже существующих альвеол и формирование De Novo альвеол способствуют восстановлению ISA, РКН, а число альвеол в остальных тканях легкого 1. Мы и другие показали, что введение таких материалов, как губка, воск или протез произвольной формы в пустую грудную полость после PNX ( т. Е. Имплантацию протеза) ухудшает альвеолярную регенерацию. В настоящее время твердо установлено, что механическая сила функционирует как один из наиболее важных факторов для инициирования альвеолярной регенерации 1 , 16 , 17 . В таких исследованиях была подчеркнута эффективность использования значений ИСА из обработанных PNX и имплантированных протезами легких в качестве критерия количественной оценки альвеолярной регенерации.
Известно, что смещение наблюдателя оказывает значительное влияние на измеренные значения vaСифилиса для морфологических параметров легких ( например , MIL и ILV). Стандартизированные протоколы могут использоваться для устранения этого смещения при определении как ILV, так и MLI, которые являются двумя параметрами, используемыми при расчете ISA. Здесь мы предоставляем очень подробные, стандартизированные протоколы для измерения этих параметров легких. Важно отметить, что способность точно оценивать ISA обещает повысить надежность и воспроизводимость исследований функции легких в моделях альвеолярной регенерации, вызванных травмами, и должна способствовать механистическим открытиям при множественных легочных заболеваниях.
Protocol
Representative Results
Discussion
В этом протоколе мы приводим подробные описания измерения легочных параметров после введения легкого PNX и имплантации протеза. МСА теперь считается ключевым показателем для оценки функции дыхания при многих заболеваниях легких и вызванной травмой альвеолярной регенерации. Однако, х?…
Declarações
The authors have nothing to disclose.
Acknowledgements
Авторы хотели бы поблагодарить Национальный институт биологических наук, Пекин за помощь. Эта работа была поддержана Муниципальным научным фондом Пекина (№ Z17110200040000).
Materials
| Low cost cautery kit | Fine Science Tools | 18010-00 | |
| Noyes scissors | Fine Science Tools | 15012-12 | |
| Standard pattern forceps | Fine Science Tools | 11000-12 | |
| Castroviejo Micro Needle Holders | Fine Science Tools | 12060-01 | |
| Vessel clips | Fine Science Tools | 18374-44 | |
| I. V. Cannula-20 gauge | Jinhuan Medical Product Co., LTD. | 29P0601 | |
| Surgical suture | Jinhuan Medical Product Co., LTD. | F602 | |
| Mouse intubation platform | Penn-Century, Inc | Model MIP | |
| Small Animal Laryngoscope | Penn-Century, Inc | Model LS-2-M | |
| TOPO Small Animal Ventilator | Kent Scientific | RSP1006-05L | |
| Thermal pad | Stuart equipment | SBH130D | |
| Pentobarbital sodium salt | Sigma | P3761 | |
| Heparin sodium salt | Sigma | H3393 | |
| Hematoxylin Solution | Sigma | GHS132 | |
| Eosin Y solution, alcoholic | Sigma | HT110116 | |
| 10 ml Pipette | Thermo Scientific | 170356 | |
| Paraformaldehyde | Sigma | P6148 | |
| O.C.T Compound | Tissue-Tek | 4583 | |
| cryosection machine | Leica | CM1950 | |
| Disposable Base Molds | Fisher HealthCare | 22-363-553 | |
| 18 gauge needle | Becton Dickinson | 305199 | |
| Povidone iodine | Fisher Scientific | 19-027132 | |
| 70% ethanol | Fisher Scientific | BP82011 | |
| Infusion sets for single use | Weigao | SFDA 2012 3661704 | |
| Phosphate buffered saline | Gibco | 10010023 | |
| Tapes | 3M Scotch | 8915 | |
| Cotton pad | Vinda | Dr.P | |
| Silicone prosthesis | Custom made | ||
| Brightfield microscope | Olympus | VS120 | |
| Ruler tool | Adobe Photoshop |
Referências
- Liu, Z., et al. MAPK-Mediated YAP Activation Controls Mechanical-Tension-Induced Pulmonary Alveolar Regeneration. Cell Rep. 16 (7), 1810-1819 (2016).
- Thurlbeck, W. M. Internal surface area and other measurements in emphysema. Thorax. 22 (6), 483-496 (1967).
- Knudsen, L., Weibel, E. R., Gundersen, H. J. G., Weinstein, F. V., Ochs, M. Assessment of air space size characteristics by intercept (chord) measurement: an accurate and efficient stereological approach. J Appl Physiol. 108 (2), 412-421 (2010).
- Weibel, E. R. . Morphometry of the Human Lung. , (1963).
- Duguid, J. B., Young, A., Cauna, D., Lambert, M. W. The internal surface area of the lung in emphysema. J Pathol Bacteriol. 88, 405-421 (1964).
- Branchfield, K., et al. Pulmonary neuroendocrine cells function as airway sensors to control lung immune response. Science. 351 (6274), 707-710 (2016).
- Ding, B. -. S., et al. Endothelial-derived angiocrine signals induce and sustain regenerative lung alveolarization. Cell. 147 (3), 539-553 (2011).
- Dunnill, M. S. Quantitative methods in the study of pulmonary pathology. Thorax. 17 (4), 320-328 (1962).
- Weibel, E. R., Gomez, M. Architecture of the human lung. Use of quantitative methods establishes fundamental relations between size and number of lung structures. Science. 137 (3530), 577-585 (1962).
- Thurlbeck, W. M. The internal surface area of nonemphysematous lungs. Am Rev Respir Dis. 95 (5), 765-773 (1967).
- Butler, J. P., et al. Evidence for adult lung growth in humans. N Engl J Med. 367 (16), 244-247 (2012).
- Hsia, C. C. W., Herazo, L. F., Fryder-Doffey, F., Weibel, E. R. Compensatory lung growth occurs in adult dogs after right pneumonectomy. J Clin Invest. 94 (1), 405-412 (1994).
- Thurlbeck, S. W. M. Pneumonectomy in Rats at Various Ages. Am Rev Respir Dis. 120 (5), 1125-1136 (1979).
- Cagle, P. T., Langston, C., Thurlbeck, W. M. The Effect of Age on Postpneumonectomy Growth in Rabbits. Pediatr Pulmonol. 5 (2), 92-95 (1988).
- Langston, C., et al. Alveolar multiplication in the contralateral lung after unilateral pneumonectomy in the rabbit. Am Rev Respir Dis. 115 (1), 7-13 (1977).
- Cohn, R. Factors Affecting The Postnatal Growth of The Lung. Anatomical Record. 75 (2), 195-205 (1939).
- Hsia, C. C., Wu, E. Y., Wagner, E., Weibel, E. R. Preventing mediastinal shift after pneumonectomy impairs regenerative alveolar tissue growth. Am J Physiol Lung Cell Mol Physiol. 281 (5), L1279-L1287 (2001).
- Das, S., MacDonald, K., Chang, H. -. Y. S., Mitzner, W. A simple method of mouse lung intubation. J Vis Exp. (73), e50318 (2013).
- Liu, S., Cimprich, J., Varisco, B. M. Mouse pneumonectomy model of compensatory lung growth. J Vis Exp. (94), (2014).
- Silva, M. F. R., Zin, W. A., Saldiva, P. H. N. Airspace configuration at different transpulmonary pressures in normal and paraquat-induced lung injury in rats. Am J Respir Crit Care Med. 158 (4), 1230-1234 (1998).
- Yilmaz, C., et al. Noninvasive quantification of heterogeneous lung growth following extensive lung resection by high-resolution computed tomography. J Appl Physiol. 107 (5), 1569-1578 (2009).
- Voswinckel, R., et al. Characterisation of post-pneumonectomy lung growth in adult mice. Eur Respir J. 24 (4), 524-532 (2004).
- Ravikumar, P., et al. Regional Lung Growth and Repair Regional lung growth following pneumonectomy assessed by computed tomography. J Appl Physiol. 97, 1567-1574 (2004).
- Gibney, B. C., et al. Detection of murine post-pneumonectomy lung regeneration by 18FDG PET imaging. EJNMMI Res. 2 (1), (2012).
- Muñoz-Barrutia, A., Ceresa, M., Artaechevarria, X., Montuenga, L. M., Ortiz-De-Solorzano, C. Quantification of lung damage in an elastase-induced mouse model of emphysema. Int J Biomed Imaging. 2012, (2012).

