En standardiserad metod för att mäta inre lungytan via muspneumonektomi och protesimplantation
Summary
Intern lungyta (ISA) är ett kritiskt kriterium för bedömning av lungmorfologi och fysiologi vid lungsjukdomar och skada-inducerad alveolär regenerering. Vi beskriver här en standardiserad metod som kan minimera mätförskjutningen för ISA i både lungpneumonektomi och protesimplantationsmusmodeller.
Abstract
Pulmonary morphology, physiology, and respiratory functions change in both physiological and pathological conditions. Internal lung surface area (ISA), representing the gas-exchange capacity of the lung, is a critical criterion to assess respiratory function. However, observer bias can significantly influence measured values for lung morphological parameters. The protocol that we describe here minimizes variations during measurements of two morphological parameters used for ISA calculation: internal lung volume (ILV) and mean linear intercept (MLI). Using ISA as a morphometric and functional parameter to determine the outcome of alveolar regeneration in both pneumonectomy (PNX) and prosthesis implantation mouse models, we found that the increased ISA following PNX treatment was significantly blocked by implantation of a prosthesis into the thoracic cavity1. The ability to accurately quantify ISA is not only expected to improve the reliability and reproducibility of lung function studies in injured-induced alveolar regeneration models, but also to promote mechanistic discoveries of multiple pulmonary diseases.
Introduction
Lungens grundläggande funktion är utbyte av syre och koldioxid mellan blodkärl och atmosfären. Lungsjukdomar som bronkopulmonell dysplasi (BPD), kronisk obstruktiv lungsjukdom (COPD) och akut respiratoriska infektioner resulterar i minskad ISA 2 . Forskare som studerar lungsjukdomar har utvecklat flera kvantitativa metoder för att utvärdera morfologiska förändringar i lungorna, inklusive MLI, ILV, antal gasutbytesenheter, ISA och lungvävnadsöverensstämmelse 2 , 3 . Banbrytande studier av Weibel et al. 4 och Duguid et al. 5 fastställde tillsammans att ISA kan användas som en direkt åtgärd av lunggasutbytesförmåga i människa lungor och kan användas som kriterium för att bestämma emfysem svårighetsgrad. Ett antal studier som publicerats under de senaste fem åren har använt lungmorfologiska parametrar ( t.ex. </eM> ISA och MLI) för att bedöma morfologiska och funktionella förändringar i lungorna hos möss under utveckling 6 och under återhämtning från skada PNX 1 , 7 . ISA beräknas med användning av ekvation 1 8 , 9 :
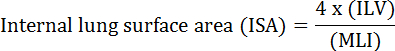
, Där ILV är den interna lungvolymen och MLI är en mellanliggande parameter som representerar lungens perifera luftrumsstorlek 10 .
PNX, det kirurgiska avlägsnandet av en eller flera lunglober, har rapporterats allmänt för att inducera alveolär regenerering hos många arter, inklusive människor 11 , möss 1 , hundar 12 , råttor 13 och kaniner 14 , 15 . En studY av mösslungor vid fjorton dagar efter PNX visade att både expansionen av existerande alveoler och de novo- bildningen av alveoler bidrar till återställandet av ISA, ILV och antalet alveoler i de återstående lungvävnaderna 1 . Vi och andra har visat att införandet av material som svamp, vax eller en anpassad protes i den tomma bröstkaviteten efter PNX ( dvs protesimplantation) försämrar alveolär regenerering. Det är nu bestämt att mekanisk kraft fungerar som en av de viktigaste faktorerna för initiering av alveolär regenerering 1 , 16 , 17 . Sådana studier har framhävt effektiviteten av att använda ISA-värden från PNX-behandlade och protes-implanterade lungor som ett kriterium för att kvantitativt utvärdera alveolär regenerering.
Observera bias är känt för att väsentligt påverka uppmätt vaLues för lungmorfologiska parametrar ( t.ex. MIL och ILV). Standardiserade protokoll kan användas för att eliminera denna bias vid bestämning av både ILV och MLI, vilka är de två parametrar som används vid beräkningen av ISA. Här tillhandahåller vi mycket detaljerade, standardiserade protokoll för mätning av dessa lungparametrar. Det är viktigt att förmågan att noggrant kvantifiera ISA lovar att förbättra tillförlitligheten och reproducerbarheten av studier av lungfunktion i skadade inducerade alveolära regenereringsmodeller och bör underlätta mekaniska upptäckter vid flera lungsjukdomar.
Protocol
Representative Results
Discussion
I detta protokoll tillhandahåller vi detaljerade beskrivningar om mätningen av lungparametrarna efter muskeln kvar lung PNX och protesimplantation. ISA anses nu vara en nyckelfaktor för bedömning av andningsfunktionen vid många lungsjukdomar och vid skada-inducerad alveolär regenerering. Även om lungforskningsgemenskapen är överens om användningen av ISA som en användbar mätning, har dock hittills inte beaktats standardiseringen av mätningen av ILV och MLI, de två parametrar som används för att beräkna …
Declarações
The authors have nothing to disclose.
Acknowledgements
Författarna skulle vilja erkänna National Institute of Biological Sciences, Beijing för hjälp. Detta arbete stöddes av Beijing Municipal Natural Science Foundation (nr. Z17110200040000).
Materials
| Low cost cautery kit | Fine Science Tools | 18010-00 | |
| Noyes scissors | Fine Science Tools | 15012-12 | |
| Standard pattern forceps | Fine Science Tools | 11000-12 | |
| Castroviejo Micro Needle Holders | Fine Science Tools | 12060-01 | |
| Vessel clips | Fine Science Tools | 18374-44 | |
| I. V. Cannula-20 gauge | Jinhuan Medical Product Co., LTD. | 29P0601 | |
| Surgical suture | Jinhuan Medical Product Co., LTD. | F602 | |
| Mouse intubation platform | Penn-Century, Inc | Model MIP | |
| Small Animal Laryngoscope | Penn-Century, Inc | Model LS-2-M | |
| TOPO Small Animal Ventilator | Kent Scientific | RSP1006-05L | |
| Thermal pad | Stuart equipment | SBH130D | |
| Pentobarbital sodium salt | Sigma | P3761 | |
| Heparin sodium salt | Sigma | H3393 | |
| Hematoxylin Solution | Sigma | GHS132 | |
| Eosin Y solution, alcoholic | Sigma | HT110116 | |
| 10 ml Pipette | Thermo Scientific | 170356 | |
| Paraformaldehyde | Sigma | P6148 | |
| O.C.T Compound | Tissue-Tek | 4583 | |
| cryosection machine | Leica | CM1950 | |
| Disposable Base Molds | Fisher HealthCare | 22-363-553 | |
| 18 gauge needle | Becton Dickinson | 305199 | |
| Povidone iodine | Fisher Scientific | 19-027132 | |
| 70% ethanol | Fisher Scientific | BP82011 | |
| Infusion sets for single use | Weigao | SFDA 2012 3661704 | |
| Phosphate buffered saline | Gibco | 10010023 | |
| Tapes | 3M Scotch | 8915 | |
| Cotton pad | Vinda | Dr.P | |
| Silicone prosthesis | Custom made | ||
| Brightfield microscope | Olympus | VS120 | |
| Ruler tool | Adobe Photoshop |
Referências
- Liu, Z., et al. MAPK-Mediated YAP Activation Controls Mechanical-Tension-Induced Pulmonary Alveolar Regeneration. Cell Rep. 16 (7), 1810-1819 (2016).
- Thurlbeck, W. M. Internal surface area and other measurements in emphysema. Thorax. 22 (6), 483-496 (1967).
- Knudsen, L., Weibel, E. R., Gundersen, H. J. G., Weinstein, F. V., Ochs, M. Assessment of air space size characteristics by intercept (chord) measurement: an accurate and efficient stereological approach. J Appl Physiol. 108 (2), 412-421 (2010).
- Weibel, E. R. . Morphometry of the Human Lung. , (1963).
- Duguid, J. B., Young, A., Cauna, D., Lambert, M. W. The internal surface area of the lung in emphysema. J Pathol Bacteriol. 88, 405-421 (1964).
- Branchfield, K., et al. Pulmonary neuroendocrine cells function as airway sensors to control lung immune response. Science. 351 (6274), 707-710 (2016).
- Ding, B. -. S., et al. Endothelial-derived angiocrine signals induce and sustain regenerative lung alveolarization. Cell. 147 (3), 539-553 (2011).
- Dunnill, M. S. Quantitative methods in the study of pulmonary pathology. Thorax. 17 (4), 320-328 (1962).
- Weibel, E. R., Gomez, M. Architecture of the human lung. Use of quantitative methods establishes fundamental relations between size and number of lung structures. Science. 137 (3530), 577-585 (1962).
- Thurlbeck, W. M. The internal surface area of nonemphysematous lungs. Am Rev Respir Dis. 95 (5), 765-773 (1967).
- Butler, J. P., et al. Evidence for adult lung growth in humans. N Engl J Med. 367 (16), 244-247 (2012).
- Hsia, C. C. W., Herazo, L. F., Fryder-Doffey, F., Weibel, E. R. Compensatory lung growth occurs in adult dogs after right pneumonectomy. J Clin Invest. 94 (1), 405-412 (1994).
- Thurlbeck, S. W. M. Pneumonectomy in Rats at Various Ages. Am Rev Respir Dis. 120 (5), 1125-1136 (1979).
- Cagle, P. T., Langston, C., Thurlbeck, W. M. The Effect of Age on Postpneumonectomy Growth in Rabbits. Pediatr Pulmonol. 5 (2), 92-95 (1988).
- Langston, C., et al. Alveolar multiplication in the contralateral lung after unilateral pneumonectomy in the rabbit. Am Rev Respir Dis. 115 (1), 7-13 (1977).
- Cohn, R. Factors Affecting The Postnatal Growth of The Lung. Anatomical Record. 75 (2), 195-205 (1939).
- Hsia, C. C., Wu, E. Y., Wagner, E., Weibel, E. R. Preventing mediastinal shift after pneumonectomy impairs regenerative alveolar tissue growth. Am J Physiol Lung Cell Mol Physiol. 281 (5), L1279-L1287 (2001).
- Das, S., MacDonald, K., Chang, H. -. Y. S., Mitzner, W. A simple method of mouse lung intubation. J Vis Exp. (73), e50318 (2013).
- Liu, S., Cimprich, J., Varisco, B. M. Mouse pneumonectomy model of compensatory lung growth. J Vis Exp. (94), (2014).
- Silva, M. F. R., Zin, W. A., Saldiva, P. H. N. Airspace configuration at different transpulmonary pressures in normal and paraquat-induced lung injury in rats. Am J Respir Crit Care Med. 158 (4), 1230-1234 (1998).
- Yilmaz, C., et al. Noninvasive quantification of heterogeneous lung growth following extensive lung resection by high-resolution computed tomography. J Appl Physiol. 107 (5), 1569-1578 (2009).
- Voswinckel, R., et al. Characterisation of post-pneumonectomy lung growth in adult mice. Eur Respir J. 24 (4), 524-532 (2004).
- Ravikumar, P., et al. Regional Lung Growth and Repair Regional lung growth following pneumonectomy assessed by computed tomography. J Appl Physiol. 97, 1567-1574 (2004).
- Gibney, B. C., et al. Detection of murine post-pneumonectomy lung regeneration by 18FDG PET imaging. EJNMMI Res. 2 (1), (2012).
- Muñoz-Barrutia, A., Ceresa, M., Artaechevarria, X., Montuenga, L. M., Ortiz-De-Solorzano, C. Quantification of lung damage in an elastase-induced mouse model of emphysema. Int J Biomed Imaging. 2012, (2012).

