Nanosensoren Protease-Aktivität In Vivo für die nicht-invasive Diagnostik zu erkennen
Summary
Proteasen sind streng regulierte Enzyme grundlegende biologische Prozesse und Dysregulated Protease-Aktivität Laufwerke Fortschreiten von komplexen Krankheiten wie Krebs beteiligt. Diese Methode soll Nanosensoren geschaffen, die Protease-Aktivität in Vivo durch die Herstellung einer Spaltung Signal, das vom Host Urin nachweisbar ist und Krankheit diskriminiert messen.
Abstract
Proteasen sind multifunktionelle Enzyme, die die Hydrolyse von Peptidbindungen spezialisiert und Breite biologische Prozesse einschließlich der Homöostase und Handlungspotentiale steuern. Darüber hinaus Dysregulated Proteaseaktivität treibt Pathogenese und ist eine funktionelle Biomarker von Krankheiten wie Krebs; Daher kann die Möglichkeit, Protease-Aktivität in Vivo zu erkennen klinisch relevante Informationen für die biomedizinische Diagnostik bieten. Dieses Protokoll soll Nanosensoren geschaffen, die für die Protease-Aktivität in Vivo Sonde durch die Herstellung einer quantifizierbaren Signals im Urin. Diese Protease Nanosensoren bestehen aus zwei Komponenten: einem Nanopartikel und Substrat. Die Nanopartikel Funktionen Zirkulation Half-Life und Substrat Lieferung an Ziel-Krankheit-Sites zu erhöhen. Das Substrat ist eine kurze Peptidsequenz (6-8 AA), die spezifisch für ein Ziel Protease oder eine Gruppe von Proteasen werden soll. Das Substrat wird an die Oberfläche der Nanopartikel konjugiert und wird von einem Reporter, wie z. B. einen fluoreszierenden Marker für die Erkennung beendet. Wie Dysregulated Proteasen das Peptid-Substrat Spalten, wird die Reporter in Urin für die Quantifizierung als Biomarker der Proteaseaktivität gefiltert. Hier beschreiben wir Bau des Nanosensor für Matrix-Metalloproteinase 9 (MMP9), der Tumorprogression und Metastasierung, zur Erkennung von Darmkrebs in einem Mausmodell zugeordnet ist.
Introduction
Proteasen sind multifunktionelle Enzyme, die die Hydrolyse von Peptidbindungen spezialisiert und haben wesentliche Kontrolle über viele biologische Prozesse, einschließlich der Homöostase, Handlungspotentiale und Krankheit1. Ein veränderter Bewusstseinszustand der Protease-Aktivität hat zu einer Vielzahl von Krankheiten, einschließlich Krebs und Herz-Kreislauf-Erkrankungen, machen Proteasen attraktive Kandidaten für die Entwicklung in klinischen Biomarker2,3korreliert. Darüber hinaus ist die Protease-Aktivität funktional verknüpften zu unterscheiden Pathogeneses, Behandlungsergebnisse und Prognose der Erkrankung4. Im großen und ganzen, Biosensoren wurde entwickelt, um verschiedene biologische Phänomene zu erkennen und Krankheiten wie Krebs, neurodegenerativen Erkrankungen und Elektronentransfer verarbeitet5,6,7,8 , 9. genauer gesagt, Protease Substrat-basierte Sensoren wurden entwickelt, um die Protease-Aktivität zu erkennen, und beinhalten Fluorogenic Sonden für die diagnostische Bildgebung10 und isotopischer beschriftet Peptid Substrate für in-vitro- Erkennung durch Massenspektrometrie11. Darüber hinaus wurden Activity based Sonden entwickelt, die Substrat-Regionen, die binden oder ändern das Ziel Protease12enthalten. Mit dieser Methode wird die Ziel-Protease irreversibel gehemmt, wenn aktiven Seite geändert wird, und Analyse des Gewebes, das in Vivo Anwendungen begrenzt Ernte benötigt. Jedoch ist es wichtig, die Protease-Aktivität in Vivo, Sinn, weil Regulierung der Protease-Aktivität stark abhängig vom Kontext des anderen biologischen Aktivitäten wie das Vorhandensein von endogene Inhibitoren ist.
Das Ziel dieser Arbeit ist es, die Formulierung des Activity based Nanosensoren zu beschreiben, die Protease-Aktivität in Vivo zu erkennen, indem Sie ein messbares Signal im Urin produzieren. Diese Plattform dient als eine nicht-invasive Diagnostik, um komplexe Krankheiten wie Krebs mithilfe Dysregulated Protease-Aktivität als funktionelle Biomarker zu unterscheiden. Unsere Nanosensor-Plattform besteht aus Eisenoxid-Nanopartikeln (IONP) konjugiert, Protease Substrate. Diese Substrate werden von einem fluoreszierenden Reporter beendet die Proteasen Spalten das Substrat freigesetzt wird. Diese IONPs in Vivozirkulieren, zu Krankheit Websites lokalisieren und setzen Substrate zu aktiven krankheitsassoziierten Proteasen. Nach der Spaltung fluoreszierende Reporter freigegeben sind und aufgrund ihrer geringen Größe sind in Urin, gefiltert, während uncleaved Substrate auf die IONP im Körper verbleiben. Daher führt eine Erhöhung der Protease Tätigkeiten in Vivo in höheren Konzentrationen der Reporter im Urin (Abbildung 1). Da unsere Plattform ein Urin-Test ist, keine imaging Plattform ist erforderlich und Diagnosesignale im Urin angereichert.
Diese Plattform kann entwickelt werden, um eine Vielzahl von Krankheiten einschließlich Krebs, Fibrose und Thrombose13,14zu erkennen. Hier beschreiben wir das Design der Nanosensoren Erhebungen in Matrix Metallopeptidase 9 (MMP9) erkennen Aktivität als Biomarker von Dickdarmkrebs. Darmkrebs ist die zweithäufigste Ursache für Krebstod in den Vereinigten Staaten, mit schätzungsweise 136.800 neue Fälle und 50.300 Todesfälle in 2014 allein15. Kolorektalen Tumorzellen produzieren MMP9, das gezeigt worden ist, zur malignen Progression, Matrix Schädigung sowie Metastasen16fahren. Darüber hinaus haben wir eine geeignete Peptid-Substrat (PLGVRGK) aus der Literatur17für MMP9 identifiziert. Diese Plattform kann für Früherkennung und kostengünstige Point-of-Care Diagnostik13,14,18,19,20,21verwendet werden.
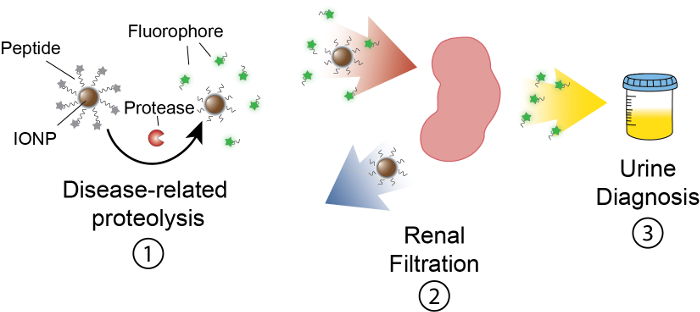
Abbildung 1: Schematische Nanosensor Aktivität In Vivo. Nanosensoren durch den Körper zirkulieren und auf Seiten der Krankheit zu lokalisieren. Krankheitsbezogenen Proteasen Spalten dann Peptid Substrate von IONPs präsentiert. Die Größe der Fragmente gespalten ermöglicht renale Clearance, wodurch sie im Urin zu lokalisieren. Nachdem das Tier uriniert, können diese Peptid-Fragmente durch ihre Reporter Molekül analysiert werden. Bitte klicken Sie hier für eine größere Version dieser Figur.
Protocol
Representative Results
Discussion
Diese Methode beschreibt die Entwicklung der Activity based Nanosensoren bestehend aus Protease Substrate zu einem Nanoparticle Kern konjugiert. Das Ereignis der proteolytischen Spaltung ist die “pharmakokinetischen Switch”, genannt, weil gespalten Peptid-Produkte kleiner als die renale Filtration Größenbeschränkung von 5 nm23 und Filter in Urin sind, eine nicht-invasive Signal zu produzieren. Daher ist es wichtig, Nanopartikel oder Träger mit einem hydrodynamischen Radius, die größer ist al…
Declarações
The authors have nothing to disclose.
Acknowledgements
Diese Arbeit wurde durch eine NIH Direktor neue Innovator Award (Auszeichnung Nr. finanziert. DP2HD091793). Q.D.M. wird unterstützt durch die NSF Graduate Research Fellowships Program (Grant Nr. DGE-1650044). B.A.H wird von den nationalen Instituten der Gesundheit GT BioMAT Training Zuschuss im Rahmen Prämiennummer 5T32EB006343 sowie der Georgia Tech President Fellowship unterstützt. G.A.K. hält den Career Award an der wissenschaftlichen Schnittstelle aus dem Burroughs-Willkommen-Fonds. Der Inhalt ist ausschließlich in der Verantwortung der Autoren und nicht unbedingt die offizielle Meinung der National Institutes of Health.
Materials
| 0.2 µm syringe filters | VWR | 4652 | |
| 18G needle | VWR | 89134-024 | |
| 15 mL conicals | VWR | 89039-670 | |
| 250 mL Erlenmeyer flask | VWR | 89000-362 | |
| Stir bar | VWR | 58949-006 | |
| Hot Plate/Magnetic Stirrer | VWR | 97042-634 | |
| Glacial acetic acid | VWR | 97064-482 | |
| Albumin from Bovine Serum (BSA) | Thermo Fisher | A13100 | |
| Iron (III) chloride hexahydrate | Sigma | 236489 | |
| Iron (II) chloride tetrahydrate | Sigma | 44939 | |
| Epichlorohydrin | Sigma | 45340-500ML-F | |
| DMF | Sigma | D4551 | |
| Ammonium Hydroxide | Sigma | 320145-500ML | |
| Sodium Hydroxide pellets | Sigma | 221465-500G | |
| EDTA | Sigma | E9884 | |
| Sodium Borate | Sigma | B9876 | |
| L-Cysteine | Sigma | 168149-100G | |
| Tris-HCl | Sigma | T5941 | |
| Tris base | Sigma | T6066 | |
| PBS tablets | Sigma | P4417 | |
| Dextran | Pharmacosmos | 5510 0020 9006 | |
| Amicon 15 mL 10k filters, 24 pk | Millipore | UFC901024 | |
| Amicon 15 mL 30k filters, 24 pk | Millipore | UFC903024 | |
| Amicon 15 mL 100k filters, 24 pk | Millipore | UFC910024 | |
| Zetasizer Nano ZS | Malvern Panalytical | NanoZS | |
| Slide-A-Lyzer Dialysis Cassette | LifeTech | 66130 | |
| Dynabeads MyOne Tosylactivated | LifeTech | 65501 | |
| SIA | Life Tech | 22349 | |
| PEG 20k | Laysan Bio | MPEG-SH-20K-1g | |
| Fluorescein Antibody [2A3] | GeneTex | GTX10257 | |
| Hiload 16/600 superdex 200 | GE Healthcare | 45-002-490 | |
| Plate Reader | Fisher | BTCYT5M | |
| BD Insulin Syringes | Fisher | NC0872854 |
Referências
- Lopez-Otin, C., Bond, J. S. Proteases: Multifunctional enzymes in life and disease. Journal of Biological Chemistry. 283 (45), 30433-30437 (2008).
- Hua, Y., Nair, S. Proteases in cardiometabolic diseases: Pathophysiology, molecular mechanisms and clinical applications. Biochimica et Biophysica Acta. 1852 (2), 195-208 (2015).
- Koblinski, J. E., Ahram, M., Sloane, B. F. Unraveling the role of proteases in cancer. Clinica Chimica Acta. 291 (2), 113-135 (2000).
- Lilja, H., Vickers, A., Scardino, P. Measurements of proteases or protease system components in blood to enhance prediction of disease risk or outcome in possible cancer. Journal of Clinical Oncology. 25 (4), 347-348 (2007).
- Jin, H., et al. Flexible surface acoustic wave resonators built on disposable plastic film for electronics and lab-on-a-chip applications. Scientific Reports. 3, 2140 (2013).
- Ma, W., Liu, H. -. T., Long, Y. -. T. Monitoring dopamine quinone-induced dopaminergic neurotoxicity using dopamine functionalized quantum dots. ACS Applied Materials & Interfaces. 7 (26), 14352-14358 (2015).
- Zhang, W. -. H., Ma, W., Long, Y. -. T. Redox-mediated indirect fluorescence immunoassay for the detection of disease biomarkers using dopamine-functionalized quantum dots. Analytical Chemistry. 88 (10), 5131-5136 (2016).
- Ma, W., et al. Investigating electron-transfer processes using a biomimetic hybrid bilayer membrane system. Nature Protocols. 8 (3), 439-450 (2013).
- Holt, B. A., et al. Fc microparticles can modulate the physical extent and magnitude of complement activity. Biomaterials science . 5, 463-474 (2017).
- Edgington, L. E., Verdoes, M., Bogyo, M. Functional imaging of proteases: Recent advances in the design and application of substrate-based and activity-based probes. Current Opinion in Chemical Biology. 15 (6), 798-805 (2011).
- Kleifeld, O., et al. Identifying and quantifying proteolytic events and the natural N terminome by terminal amine isotopic labeling of substrates. Nature Protocols. 6 (10), 1578-1611 (2011).
- Sanman, L. E., Bogyo, M. Activity-based profiling of proteases. Annual Review of Biochemistry. 83 (1), 249-273 (2014).
- Kwong, G. A., et al. Mass-encoded synthetic biomarkers for multiplexed urinary monitoring of disease. Nature Biotechnology. 31 (1), 63-70 (2013).
- Dudani, J. S., Buss, C. G., Akana, R. T. K., Kwong, G. A., Bhatia, S. N. Sustained-release synthetic biomarkers for monitoring thrombosis and inflammation using point-of-care compatible readouts. Advanced Functional Materials. 26 (17), 2919-2928 (2016).
- Meester, R. G. S., et al. Public health impact of achieving 80% colorectal cancer screening rates in the United States by 2018. Cancer. 121 (13), 2281-2285 (2015).
- Mehner, C., et al. Tumor cell-produced matrix metalloproteinase 9 (MMP-9) drives malignant progression and metastasis of basal-like triple negative breast cancer. Oncotarget. 5 (9), 2736-2749 (2014).
- Bremer, C., Tung, C. H., Weissleder, R. In vivo molecular target assessment of matrix metalloproteinase inhibition. Nature Medicine. 7 (6), 743-748 (2001).
- Warren, A. D., et al. Disease detection by ultrasensitive quantification of microdosed synthetic urinary biomarkers. Journal of the American Chemical Society. 136 (39), 13709-13714 (2014).
- Warren, A. D., Kwong, G. A., Wood, D. K., Lin, K. Y., Bhatia, S. N. Point-of-care diagnostics for noncommunicable diseases using synthetic urinary biomarkers and paper microfluidics. Proceedings of the National Academy of Sciences of the United States of America. 111 (10), 3671-3676 (2014).
- Kwong, G. A., et al. Mathematical framework for activity-based cancer biomarkers. Proceedings of the National Academy of Sciences of the United States of America. 112 (41), 12627-12632 (2015).
- Dudani, J. S., Jain, P. K., Kwong, G. A., Stevens, K. R., Bhatia, S. N. Photoactivated spatiotemporally-responsive nanosensors of in vivo protease activity. ACS Nano. 9 (12), 11708-11717 (2015).
- Palmacci, S., Josephson, L. Synthesis of polysaccharide covered superparamagnetic oxide colloids. US patent. , (1991).
- Choi, H. S., et al. Renal clearance of nanoparticles. Nature Biotechnology. 25 (10), 1165-1170 (2007).
- Harris, T. J., von Maltzahn, G., Derfus, A. M., Ruoslahti, E., Bhatia, S. N. Proteolytic actuation of nanoparticle self-assembly. Angewandte Chemie (International edition in English). 45 (19), 3161-3165 (2006).
- Kwon, E. J., Dudani, J. S., Bhatia, S. N. Ultrasensitive tumour-penetrating nanosensors of protease activity. Nature Biomedical Engineering. 1, (2017).
- Villanueva, J., Nazarian, A., Lawlor, K., Tempst, P. Monitoring Peptidase activities in complex proteomes by MALDI-TOF mass spectrometry. Nature Protocols. 4 (8), 1167-1183 (2009).
- Villanueva, J., et al. Differential exoprotease activities confer tumor-specific serum peptidome patterns. The Journal of Clinical Investigation. 116 (1), 271-284 (2006).

