Nanosensori per rilevare attività della proteasi In Vivo per la diagnostica non invasiva
Summary
Proteasi sono strettamente regolamentati enzimi coinvolti in processi biologici fondamentali e dysregulated proteasi attività unità progressione di malattie complesse come il cancro. Obiettivo di questo metodo consiste nel creare nanosensori che misurano proteasi attività in vivo producendo un segnale di fenditura che è rilevabile dall’urina di host e discrimina la malattia.
Abstract
Proteasi sono enzimi multifunzionali che si specializzano nell’idrolisi di legami peptidici e controllano ampi processi biologici, compreso l’omeostasi e Allostasi. Inoltre, l’attività della proteasi dysregulated unità patogenesi ed è un biomarcatore funzionale di malattie come il cancro; Pertanto, la capacità di rilevare attività della proteasi in vivo può fornire informazioni clinicamente rilevanti per la diagnostica biomedica. L’obiettivo del presente protocollo è quello di creare nanosensori sonda per attività della proteasi in vivo producendo un segnale quantificabile nelle urine. Queste proteasi nanosensori costituiti da due componenti: una nanoparticella e substrato. Le funzioni di nanoparticelle per aumentare la consegna di Half-Life e substrato di circolazione malattia nei siti di destinazione. Il substrato è una sequenza di brevi peptidi (6-8 AA), che è progettata per essere specifici di una proteasi di destinazione o un gruppo di proteasi. Il substrato è coniugato alla superficie della nanoparticella e viene terminato da un giornalista, ad esempio un marker fluorescente, per il rilevamento. Come proteasi dysregulated fendono il substrato peptide, il reporter viene filtrato in urina per quantificazione come biomarcatore di attività della proteasi. Qui descriviamo la costruzione di un nanosensore per proteinasi metallica della tabella 9 (MMP9), che è associato con la progressione del tumore e metastasi, per la rilevazione di cancro colorettale in un modello murino.
Introduction
Proteasi sono enzimi multifunzionali che si specializzano nell’idrolisi di legami peptidici e hanno il controllo significativo rispetto a molti processi biologici, compreso l’omeostasi, Allostasi e malattia1. Uno stato alterato di attività della proteasi è stato correlato ad una varietà di malattie, compreso cancro e la malattia cardiovascolare, rendendo i candidati attraenti di proteasi per sviluppo in biomarker clinici2,3. Inoltre, l’attività della proteasi è funzionalmente collegati a distinte pathogeneses, gli esiti dei pazienti e la prognosi di malattia4. In generale, biosensori sono state sviluppate per rilevare vari fenomeni biologici e malattie, quali cancro, malattie neurodegenerative e trasferimento di elettroni elabora5,6,7,8 , 9. più specificamente, sensori basati su substrato della proteasi sono stati sviluppati per rilevare l’attività della proteasi e includono sonde fluorogenic per diagnostica per immagini10 e isotopicamente etichettati substrati del peptide per in vitro rilevamento di spettrometria di massa11. Inoltre, sonde basate su attività sono state sviluppate, che contengono regioni di substrato-come che legano o modificare la destinazione della proteasi12. Con questo metodo, la proteasi di destinazione è irreversibilmente inibita quando viene modificato il sito attivo e analisi richiedono la raccolta di tessuto, che limita le applicazioni in vivo . Tuttavia, è importante rilevare proteasi attività in vivo, perché il regolamento di attività della proteasi è fortemente dipendente dal contesto di altre attività biologiche quali la presenza di inibitori endogeni.
L’obiettivo di questo lavoro è di descrivere la formulazione dei nanosensori basati su attività che rilevano attività della proteasi in vivo producendo un segnale misurabile nelle urine. Questa piattaforma è utilizzata come una diagnostica non invasiva per discriminare complesse malattie come il cancro utilizzando l’attività della proteasi dysregulated come biomarcatore funzionale. La nostra piattaforma nanosensore è costituito da nanoparticelle di ossido di ferro (IONP) coniugate a substrati di proteasi. Questi substrati vengono terminati da un reporter fluorescente che viene rilasciato quando proteasi fendono il substrato. Questi IONPs circolare in vivo, siti di malattia si localizzano ed esporre substrati alle proteasi attive di malattia-collegati. Dopo la scissione, reporter fluorescenti vengono rilasciati e, grazie alle loro piccole dimensioni, vengono filtrati in urina, mentre substrati ApoAlert sulla IONP rimangono nel corpo. Pertanto, un aumento di attività della proteasi in vivo si tradurrà in concentrazioni più elevate di reporter nelle urine (Figura 1). Poiché la nostra piattaforma è un test delle urine, nessuna piattaforma di imaging è obbligatorio e segnali diagnostici sono arricchiti in urina.
Questa piattaforma può essere progettata per rilevare una varietà di malattie compreso il cancro, fibrosi e trombosi13,14. Qui descriviamo il design dei nanosensori per rilevare le elevazioni in Matrix metallopeptidase 9 (MMP9) attività come biomarcatore di cancro colorettale. Il cancro colorettale è la seconda causa principale di morte per cancro negli Stati Uniti, con circa 136.800 nuovi casi e 50.300 morti nel 2014 solo15. Le cellule del tumore del colon-retto producono MMP9, che ha dimostrato di guidare la progressione maligna, la degradazione della matrice, così come metastasi16. Inoltre, abbiamo identificato un substrato adatto peptide (PLGVRGK) per MMP9 dalla letteratura17. Questa piattaforma può essere utilizzata per la diagnosi precoce del cancro e diagnostica point-of-care basso costo13,14,18,19,20,21.
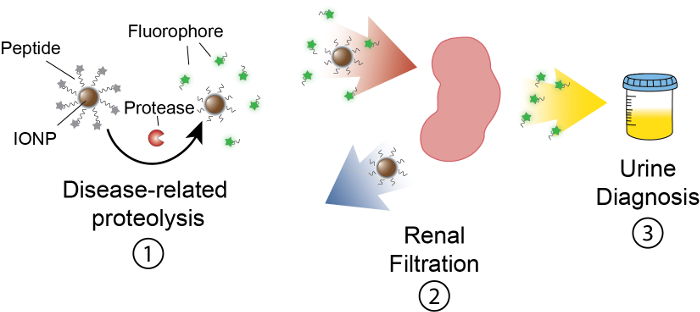
Figura 1: schematico di nanosensori attività In vivo. Nanosensori circolano attraverso il corpo e si localizzano siti di malattia. Quindi, correlati alla malattia proteasi fendono substrati del peptide presentati da IONPs. Le dimensioni dei frammenti fenduti consente la clearance renale, causando loro di localizzare nelle urine. Dopo che l’animale urina, questi frammenti peptidici possono essere analizzati dalla loro molecola reporter. Clicca qui per visualizzare una versione più grande di questa figura.
Protocol
Representative Results
Discussion
Questo metodo viene descritto lo sviluppo di Nanosensori basati su attività costituito da proteasi substrati coniugati ad un nucleo di nanoparticelle. L’evento di clivaggio proteolitico è soprannominato “switch farmacocinetiche,” perché prodotti fenduti peptidici sono più piccoli rispetto al limite di filtrazione renale dimensione di 5 nm23 e filtro in urina per produrre un segnale non invadente. Pertanto, è importante utilizzare le nanoparticelle o vettori con un raggio idrodinamico è maggi…
Declarações
The authors have nothing to disclose.
Acknowledgements
Questo lavoro è stato finanziato da un direttore di NIH nuovo Innovator Award (premio No. DP2HD091793). Q.D.M. è supportato dal programma di borse di ricerca laureato NSF (Grant No. DGE-1650044). B.A.H è supportato dalla nazionale istituti di salute GT BioMAT formazione sovvenzione premio numero 5T32EB006343 così come il Presidente di Georgia Tech Fellowship. G.A.K. tiene un premio alla carriera all’interfaccia scientifica del fondo benvenuto di Burroughs. Il contenuto è di esclusiva responsabilità degli autori e non rappresentano necessariamente il punto di vista ufficiale del National Institutes of Health.
Materials
| 0.2 µm syringe filters | VWR | 4652 | |
| 18G needle | VWR | 89134-024 | |
| 15 mL conicals | VWR | 89039-670 | |
| 250 mL Erlenmeyer flask | VWR | 89000-362 | |
| Stir bar | VWR | 58949-006 | |
| Hot Plate/Magnetic Stirrer | VWR | 97042-634 | |
| Glacial acetic acid | VWR | 97064-482 | |
| Albumin from Bovine Serum (BSA) | Thermo Fisher | A13100 | |
| Iron (III) chloride hexahydrate | Sigma | 236489 | |
| Iron (II) chloride tetrahydrate | Sigma | 44939 | |
| Epichlorohydrin | Sigma | 45340-500ML-F | |
| DMF | Sigma | D4551 | |
| Ammonium Hydroxide | Sigma | 320145-500ML | |
| Sodium Hydroxide pellets | Sigma | 221465-500G | |
| EDTA | Sigma | E9884 | |
| Sodium Borate | Sigma | B9876 | |
| L-Cysteine | Sigma | 168149-100G | |
| Tris-HCl | Sigma | T5941 | |
| Tris base | Sigma | T6066 | |
| PBS tablets | Sigma | P4417 | |
| Dextran | Pharmacosmos | 5510 0020 9006 | |
| Amicon 15 mL 10k filters, 24 pk | Millipore | UFC901024 | |
| Amicon 15 mL 30k filters, 24 pk | Millipore | UFC903024 | |
| Amicon 15 mL 100k filters, 24 pk | Millipore | UFC910024 | |
| Zetasizer Nano ZS | Malvern Panalytical | NanoZS | |
| Slide-A-Lyzer Dialysis Cassette | LifeTech | 66130 | |
| Dynabeads MyOne Tosylactivated | LifeTech | 65501 | |
| SIA | Life Tech | 22349 | |
| PEG 20k | Laysan Bio | MPEG-SH-20K-1g | |
| Fluorescein Antibody [2A3] | GeneTex | GTX10257 | |
| Hiload 16/600 superdex 200 | GE Healthcare | 45-002-490 | |
| Plate Reader | Fisher | BTCYT5M | |
| BD Insulin Syringes | Fisher | NC0872854 |
Referências
- Lopez-Otin, C., Bond, J. S. Proteases: Multifunctional enzymes in life and disease. Journal of Biological Chemistry. 283 (45), 30433-30437 (2008).
- Hua, Y., Nair, S. Proteases in cardiometabolic diseases: Pathophysiology, molecular mechanisms and clinical applications. Biochimica et Biophysica Acta. 1852 (2), 195-208 (2015).
- Koblinski, J. E., Ahram, M., Sloane, B. F. Unraveling the role of proteases in cancer. Clinica Chimica Acta. 291 (2), 113-135 (2000).
- Lilja, H., Vickers, A., Scardino, P. Measurements of proteases or protease system components in blood to enhance prediction of disease risk or outcome in possible cancer. Journal of Clinical Oncology. 25 (4), 347-348 (2007).
- Jin, H., et al. Flexible surface acoustic wave resonators built on disposable plastic film for electronics and lab-on-a-chip applications. Scientific Reports. 3, 2140 (2013).
- Ma, W., Liu, H. -. T., Long, Y. -. T. Monitoring dopamine quinone-induced dopaminergic neurotoxicity using dopamine functionalized quantum dots. ACS Applied Materials & Interfaces. 7 (26), 14352-14358 (2015).
- Zhang, W. -. H., Ma, W., Long, Y. -. T. Redox-mediated indirect fluorescence immunoassay for the detection of disease biomarkers using dopamine-functionalized quantum dots. Analytical Chemistry. 88 (10), 5131-5136 (2016).
- Ma, W., et al. Investigating electron-transfer processes using a biomimetic hybrid bilayer membrane system. Nature Protocols. 8 (3), 439-450 (2013).
- Holt, B. A., et al. Fc microparticles can modulate the physical extent and magnitude of complement activity. Biomaterials science . 5, 463-474 (2017).
- Edgington, L. E., Verdoes, M., Bogyo, M. Functional imaging of proteases: Recent advances in the design and application of substrate-based and activity-based probes. Current Opinion in Chemical Biology. 15 (6), 798-805 (2011).
- Kleifeld, O., et al. Identifying and quantifying proteolytic events and the natural N terminome by terminal amine isotopic labeling of substrates. Nature Protocols. 6 (10), 1578-1611 (2011).
- Sanman, L. E., Bogyo, M. Activity-based profiling of proteases. Annual Review of Biochemistry. 83 (1), 249-273 (2014).
- Kwong, G. A., et al. Mass-encoded synthetic biomarkers for multiplexed urinary monitoring of disease. Nature Biotechnology. 31 (1), 63-70 (2013).
- Dudani, J. S., Buss, C. G., Akana, R. T. K., Kwong, G. A., Bhatia, S. N. Sustained-release synthetic biomarkers for monitoring thrombosis and inflammation using point-of-care compatible readouts. Advanced Functional Materials. 26 (17), 2919-2928 (2016).
- Meester, R. G. S., et al. Public health impact of achieving 80% colorectal cancer screening rates in the United States by 2018. Cancer. 121 (13), 2281-2285 (2015).
- Mehner, C., et al. Tumor cell-produced matrix metalloproteinase 9 (MMP-9) drives malignant progression and metastasis of basal-like triple negative breast cancer. Oncotarget. 5 (9), 2736-2749 (2014).
- Bremer, C., Tung, C. H., Weissleder, R. In vivo molecular target assessment of matrix metalloproteinase inhibition. Nature Medicine. 7 (6), 743-748 (2001).
- Warren, A. D., et al. Disease detection by ultrasensitive quantification of microdosed synthetic urinary biomarkers. Journal of the American Chemical Society. 136 (39), 13709-13714 (2014).
- Warren, A. D., Kwong, G. A., Wood, D. K., Lin, K. Y., Bhatia, S. N. Point-of-care diagnostics for noncommunicable diseases using synthetic urinary biomarkers and paper microfluidics. Proceedings of the National Academy of Sciences of the United States of America. 111 (10), 3671-3676 (2014).
- Kwong, G. A., et al. Mathematical framework for activity-based cancer biomarkers. Proceedings of the National Academy of Sciences of the United States of America. 112 (41), 12627-12632 (2015).
- Dudani, J. S., Jain, P. K., Kwong, G. A., Stevens, K. R., Bhatia, S. N. Photoactivated spatiotemporally-responsive nanosensors of in vivo protease activity. ACS Nano. 9 (12), 11708-11717 (2015).
- Palmacci, S., Josephson, L. Synthesis of polysaccharide covered superparamagnetic oxide colloids. US patent. , (1991).
- Choi, H. S., et al. Renal clearance of nanoparticles. Nature Biotechnology. 25 (10), 1165-1170 (2007).
- Harris, T. J., von Maltzahn, G., Derfus, A. M., Ruoslahti, E., Bhatia, S. N. Proteolytic actuation of nanoparticle self-assembly. Angewandte Chemie (International edition in English). 45 (19), 3161-3165 (2006).
- Kwon, E. J., Dudani, J. S., Bhatia, S. N. Ultrasensitive tumour-penetrating nanosensors of protease activity. Nature Biomedical Engineering. 1, (2017).
- Villanueva, J., Nazarian, A., Lawlor, K., Tempst, P. Monitoring Peptidase activities in complex proteomes by MALDI-TOF mass spectrometry. Nature Protocols. 4 (8), 1167-1183 (2009).
- Villanueva, J., et al. Differential exoprotease activities confer tumor-specific serum peptidome patterns. The Journal of Clinical Investigation. 116 (1), 271-284 (2006).

