Nanosensors para detectar Protease atividade In Vivo para diagnóstico não-invasivo
Summary
Proteases são rigidamente regulamentadas enzimas envolvidas em processos biológicos fundamentais e desregulação protease atividade unidades de progressão de doenças complexas como câncer. O objetivo do método é criar nanosensors que medem protease atividade na vivo , produzindo um sinal de clivagem que é detectável de urina de anfitrião e discrimina a doença.
Abstract
Proteases são enzimas multi-funcional que especializa-se na hidrólise das ligações peptídicas e controlam grandes processos biológicos incluindo a homeostase e allostasis. Além disso, a atividade de protease de desregulação drives patogênese e é um biomarcador funcional de doenças como o câncer; Portanto, a capacidade de detectar protease atividade na vivo pode fornecer informações clinicamente relevantes para diagnósticos biomédicos. O objetivo do presente protocolo é criar nanosensors que sondam protease atividade na vivo , produzindo um sinal quantificável na urina. Estes nanosensors da protease consistem em dois componentes: uma de nanopartículas e substrato. As funções de nanopartículas para aumentar a circulação Half-Life e substrato entrega doença nos sites de destino. O substrato é uma sequência do peptídeo curto (6-8 AA), que é projetada para ser específico para uma protease alvo ou grupo de proteases. O substrato é conjugado com a superfície da nanopartículas e é terminado por um repórter, como um marcador fluorescente, para a deteção. Como desregulação proteases fendem o substrato de peptídeo, o repórter é filtrado na urina para quantificação como um biomarcador de atividade de protease. Neste documento descrevemos a construção de um nanosensor para matriz metaloproteinase 9 (MMP9), que está associado a progressão do tumor e metástases, para detecção do câncer colorretal em um modelo do rato.
Introduction
Proteases são enzimas multi-funcional que especializa-se na hidrólise das ligações peptídicas e tem um controlo significativo sobre muitos processos biológicos, incluindo a homeostase, allostasis e doença1. Um estado alterado de atividade de protease tem sido correlacionado a uma variedade de doenças, incluindo câncer e doenças cardiovasculares, tornando atraente candidatos de proteases para desenvolvimento em biomarcadores clínicos2,3. Além disso, a atividade de protease é pathogeneses funcionalmente vinculados a distintos, os resultados dos pacientes e prognóstico da doença4. Amplamente, biosensores foram desenvolvidos para detectar vários fenômenos biológicos e doenças, como câncer, doenças neurodegenerativas e transferência de elétrons processa5,6,7,8 , 9. mais especificamente, sensores de protease baseada no substrato foram desenvolvidos para detectar atividade de protease e incluem fluorogenic sondas para diagnóstico por imagem10 e desvendar rotulados substratos de peptídeo para in vitro deteção por espectrometria de massa11. Além disso, baseado na atividade sondas têm sido desenvolvidas, que contêm o substrato, como regiões que ligam ou modificar o destino protease12. Com este método, a protease alvo é irreversivelmente inibida quando o sítio ativo é modificado, e análise requer a colheita de tecidos, que limita em vivo aplicações. No entanto, é importante sentir protease atividade na vivo, porque a regulação da atividade de protease é fortemente dependente do contexto de outras atividades biológicas, tais como a presença de inibidores endógenos.
O objetivo deste trabalho é descrever a formulação de nanosensors actividades que detectam protease atividade na vivo , produzindo um sinal mensurável na urina. Esta plataforma é usada como um diagnóstico não-invasivo para discriminar doenças complexas como câncer, usando a atividade de protease de desregulação como biomarcador funcional. Nossa plataforma de nanosensor consiste em nanopartículas de óxido de ferro (IONP) conjugadas com substratos da protease. Estes substratos são terminados por um repórter fluorescente que é liberado quando proteases fendem o substrato. Estes IONPs circulam na vivo, localizar sites de doença e expõem os substratos de proteases associada a doença ativas. Após a clivagem, repórteres fluorescentes são liberados e, devido ao seu pequeno tamanho, são filtrados na urina, enquanto os substratos uncleaved sobre a IONP permanecem no corpo. Portanto, um aumento em protease atividades na vivo resultará em concentrações mais altas de repórter na urina (Figura 1). Desde que nossa plataforma é um teste de urina, sem plataforma de imagem é necessária e sinais de diagnóstico são enriquecidos na urina.
Esta plataforma pode ser projetada para detectar uma variedade de doenças, incluindo câncer, fibrose e trombose13,14. Aqui descrevemos o projeto de nanosensors para detectar elevações em Matrix metallopeptidase 9 (MMP9) atividade como um biomarcador de câncer colorretal. O câncer colorretal é a segunda causa principal de morte por cancro nos Estados Unidos, com uma estimativa 136.800 novos casos e 50.300 mortes em 2014 só15. Células de tumor colorretal produzem MMP9, que foi mostrado para conduzir a progressão maligna, degradação de matriz, bem como metástase16. Além disso, nós identificamos um substrato adequado do peptide (PLGVRGK) para MMP9 da literatura17. Esta plataforma pode ser utilizada para detecção precoce de câncer e de baixo custo point-of-care diagnósticos13,14,18,19,20,21.
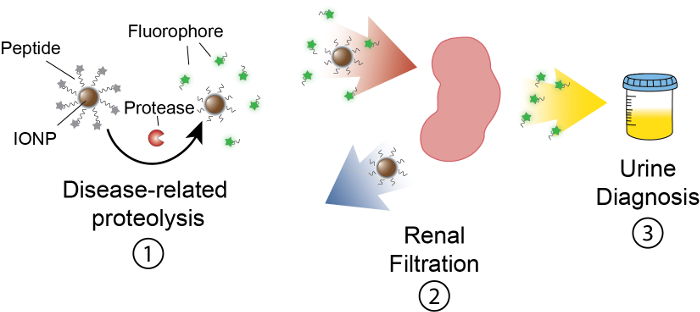
Figura 1: esquemático da Nanosensor atividade In vivo. Nanosensors circular através do corpo e localizar a locais de doença. Em seguida, doença relacionada com proteases cleave substratos de peptídeo apresentados pela IONPs. O tamanho dos fragmentos clivados permite a compensação renal, levando-os a localizar na urina. Depois que o animal urina, esses fragmentos de peptídeo podem ser analisados por sua molécula repórter. Clique aqui para ver uma versão maior desta figura.
Protocol
Representative Results
Discussion
Este método descreve o desenvolvimento de actividades nanosensors consistindo de substratos de protease, conjugados com um núcleo de nanopartículas. O evento de clivagem proteolítica é apelidado do “interruptor farmacocinético”, porque produtos clivados peptídeo são menores do que o limite de tamanho renal de filtragem de 5 nm23 e filtro na urina para produzir um sinal não-invasivo. Portanto, é importante usar nanopartículas ou transportadoras com um raio hidrodinâmico maior que 5 nm, …
Declarações
The authors have nothing to disclose.
Acknowledgements
Este trabalho foi financiado por um diretor do NIH New Innovator Award (prêmio n. º DP2HD091793). Q.D.M. é suportado pelo NSF Research Bolsas de graduação (Grant no. DGE-1650044). B.A.H é suportado pelo nacional institutos de saúde GT BioMAT formação concessão sob número do prêmio 5T32EB006343, bem como do Presidente da Geórgia Tech Fellowship. G.A.K. detém um prêmio de carreira na Interface científica do fundo de boas-vindas de Burroughs. O conteúdo é exclusivamente da responsabilidade dos autores e não representa necessariamente a opinião oficial do institutos nacionais da saúde.
Materials
| 0.2 µm syringe filters | VWR | 4652 | |
| 18G needle | VWR | 89134-024 | |
| 15 mL conicals | VWR | 89039-670 | |
| 250 mL Erlenmeyer flask | VWR | 89000-362 | |
| Stir bar | VWR | 58949-006 | |
| Hot Plate/Magnetic Stirrer | VWR | 97042-634 | |
| Glacial acetic acid | VWR | 97064-482 | |
| Albumin from Bovine Serum (BSA) | Thermo Fisher | A13100 | |
| Iron (III) chloride hexahydrate | Sigma | 236489 | |
| Iron (II) chloride tetrahydrate | Sigma | 44939 | |
| Epichlorohydrin | Sigma | 45340-500ML-F | |
| DMF | Sigma | D4551 | |
| Ammonium Hydroxide | Sigma | 320145-500ML | |
| Sodium Hydroxide pellets | Sigma | 221465-500G | |
| EDTA | Sigma | E9884 | |
| Sodium Borate | Sigma | B9876 | |
| L-Cysteine | Sigma | 168149-100G | |
| Tris-HCl | Sigma | T5941 | |
| Tris base | Sigma | T6066 | |
| PBS tablets | Sigma | P4417 | |
| Dextran | Pharmacosmos | 5510 0020 9006 | |
| Amicon 15 mL 10k filters, 24 pk | Millipore | UFC901024 | |
| Amicon 15 mL 30k filters, 24 pk | Millipore | UFC903024 | |
| Amicon 15 mL 100k filters, 24 pk | Millipore | UFC910024 | |
| Zetasizer Nano ZS | Malvern Panalytical | NanoZS | |
| Slide-A-Lyzer Dialysis Cassette | LifeTech | 66130 | |
| Dynabeads MyOne Tosylactivated | LifeTech | 65501 | |
| SIA | Life Tech | 22349 | |
| PEG 20k | Laysan Bio | MPEG-SH-20K-1g | |
| Fluorescein Antibody [2A3] | GeneTex | GTX10257 | |
| Hiload 16/600 superdex 200 | GE Healthcare | 45-002-490 | |
| Plate Reader | Fisher | BTCYT5M | |
| BD Insulin Syringes | Fisher | NC0872854 |
Referências
- Lopez-Otin, C., Bond, J. S. Proteases: Multifunctional enzymes in life and disease. Journal of Biological Chemistry. 283 (45), 30433-30437 (2008).
- Hua, Y., Nair, S. Proteases in cardiometabolic diseases: Pathophysiology, molecular mechanisms and clinical applications. Biochimica et Biophysica Acta. 1852 (2), 195-208 (2015).
- Koblinski, J. E., Ahram, M., Sloane, B. F. Unraveling the role of proteases in cancer. Clinica Chimica Acta. 291 (2), 113-135 (2000).
- Lilja, H., Vickers, A., Scardino, P. Measurements of proteases or protease system components in blood to enhance prediction of disease risk or outcome in possible cancer. Journal of Clinical Oncology. 25 (4), 347-348 (2007).
- Jin, H., et al. Flexible surface acoustic wave resonators built on disposable plastic film for electronics and lab-on-a-chip applications. Scientific Reports. 3, 2140 (2013).
- Ma, W., Liu, H. -. T., Long, Y. -. T. Monitoring dopamine quinone-induced dopaminergic neurotoxicity using dopamine functionalized quantum dots. ACS Applied Materials & Interfaces. 7 (26), 14352-14358 (2015).
- Zhang, W. -. H., Ma, W., Long, Y. -. T. Redox-mediated indirect fluorescence immunoassay for the detection of disease biomarkers using dopamine-functionalized quantum dots. Analytical Chemistry. 88 (10), 5131-5136 (2016).
- Ma, W., et al. Investigating electron-transfer processes using a biomimetic hybrid bilayer membrane system. Nature Protocols. 8 (3), 439-450 (2013).
- Holt, B. A., et al. Fc microparticles can modulate the physical extent and magnitude of complement activity. Biomaterials science . 5, 463-474 (2017).
- Edgington, L. E., Verdoes, M., Bogyo, M. Functional imaging of proteases: Recent advances in the design and application of substrate-based and activity-based probes. Current Opinion in Chemical Biology. 15 (6), 798-805 (2011).
- Kleifeld, O., et al. Identifying and quantifying proteolytic events and the natural N terminome by terminal amine isotopic labeling of substrates. Nature Protocols. 6 (10), 1578-1611 (2011).
- Sanman, L. E., Bogyo, M. Activity-based profiling of proteases. Annual Review of Biochemistry. 83 (1), 249-273 (2014).
- Kwong, G. A., et al. Mass-encoded synthetic biomarkers for multiplexed urinary monitoring of disease. Nature Biotechnology. 31 (1), 63-70 (2013).
- Dudani, J. S., Buss, C. G., Akana, R. T. K., Kwong, G. A., Bhatia, S. N. Sustained-release synthetic biomarkers for monitoring thrombosis and inflammation using point-of-care compatible readouts. Advanced Functional Materials. 26 (17), 2919-2928 (2016).
- Meester, R. G. S., et al. Public health impact of achieving 80% colorectal cancer screening rates in the United States by 2018. Cancer. 121 (13), 2281-2285 (2015).
- Mehner, C., et al. Tumor cell-produced matrix metalloproteinase 9 (MMP-9) drives malignant progression and metastasis of basal-like triple negative breast cancer. Oncotarget. 5 (9), 2736-2749 (2014).
- Bremer, C., Tung, C. H., Weissleder, R. In vivo molecular target assessment of matrix metalloproteinase inhibition. Nature Medicine. 7 (6), 743-748 (2001).
- Warren, A. D., et al. Disease detection by ultrasensitive quantification of microdosed synthetic urinary biomarkers. Journal of the American Chemical Society. 136 (39), 13709-13714 (2014).
- Warren, A. D., Kwong, G. A., Wood, D. K., Lin, K. Y., Bhatia, S. N. Point-of-care diagnostics for noncommunicable diseases using synthetic urinary biomarkers and paper microfluidics. Proceedings of the National Academy of Sciences of the United States of America. 111 (10), 3671-3676 (2014).
- Kwong, G. A., et al. Mathematical framework for activity-based cancer biomarkers. Proceedings of the National Academy of Sciences of the United States of America. 112 (41), 12627-12632 (2015).
- Dudani, J. S., Jain, P. K., Kwong, G. A., Stevens, K. R., Bhatia, S. N. Photoactivated spatiotemporally-responsive nanosensors of in vivo protease activity. ACS Nano. 9 (12), 11708-11717 (2015).
- Palmacci, S., Josephson, L. Synthesis of polysaccharide covered superparamagnetic oxide colloids. US patent. , (1991).
- Choi, H. S., et al. Renal clearance of nanoparticles. Nature Biotechnology. 25 (10), 1165-1170 (2007).
- Harris, T. J., von Maltzahn, G., Derfus, A. M., Ruoslahti, E., Bhatia, S. N. Proteolytic actuation of nanoparticle self-assembly. Angewandte Chemie (International edition in English). 45 (19), 3161-3165 (2006).
- Kwon, E. J., Dudani, J. S., Bhatia, S. N. Ultrasensitive tumour-penetrating nanosensors of protease activity. Nature Biomedical Engineering. 1, (2017).
- Villanueva, J., Nazarian, A., Lawlor, K., Tempst, P. Monitoring Peptidase activities in complex proteomes by MALDI-TOF mass spectrometry. Nature Protocols. 4 (8), 1167-1183 (2009).
- Villanueva, J., et al. Differential exoprotease activities confer tumor-specific serum peptidome patterns. The Journal of Clinical Investigation. 116 (1), 271-284 (2006).

