Schnelle Bestimmung der Antikörper-Antigen-Affinität durch Massenphotometrie
Summary
Wir beschreiben einen einmolekularen Ansatz für Antigen-Antikörper-Affinitätsmessungen mit Massenphotometrie (MP). Das MP-basierte Protokoll ist schnell, genau, verwendet eine sehr geringe Menge an Material und erfordert keine Proteinmodifikation.
Abstract
Messungen der Spezifität und Affinität von Antigen-Antikörper-Wechselwirkungen sind für medizinische und forschungsmedizinische Anwendungen von entscheidender Bedeutung. In diesem Protokoll beschreiben wir die Implementierung einer neuen Einzelmolekültechnik, der Massenphotometrie (MP), zu diesem Zweck. MP ist eine etiketten- und immobilisierungsfreie Technik, die molekulare Massen und Populationen von Antikörpern und Antigen-Antikörper-Komplexen auf einer Einmolekülebene erkennt und quantifiziert. MP analysiert die Antigen-Antikörper-Probe innerhalb von Minuten, um die Bindungsaffinität präzise zu bestimmen und gleichzeitig Informationen über die Stoichiometrie und den oligomeren Zustand der Proteine bereitzustellen. Dies ist eine einfache und einfache Technik, die nur Picomol-Mengen an Protein und keine teuren Verbrauchsmaterialien erfordert. Das gleiche Verfahren kann verwendet werden, um die Protein-Protein-Bindung für Proteine mit einer Molekularmasse von mehr als 50 kDa zu untersuchen. Bei multivalenten Proteinwechselwirkungen können die Affinitäten mehrerer Bindungsstellen in einer einzigen Messung ermittelt werden. Die einmolekulare Messart und die fehlende Etikettierung setzen jedoch einige experimentelle Einschränkungen mit sich. Diese Methode liefert die besten Ergebnisse, wenn sie auf Messungen von submikromolaren Wechselwirkungsaffinitäten, Antigenen mit einer Molekularmasse von 20 kDa oder größer und relativ reinen Proteinproben angewendet wird. Wir beschreiben auch das Verfahren zur Durchführung der erforderlichen Anpassungs- und Berechnungsschritte mit einer Basisdatenanalysesoftware.
Introduction
Antikörper sind zu allgegenwärtigen Werkzeugen der Molekularbiologie geworden und werden sowohl in medizinischen als auch in Forschungsanwendungen ausgiebig eingesetzt. In der Medizin sind sie in der Diagnostik von entscheidender Bedeutung, aber auch ihre therapeutischen Anwendungen werden erweitert und neue Antikörper-basierte Therapien werden ständig entwickelt1,2,3,4. Die wissenschaftlichen Anwendungen von Antikörpern umfassen viele unverzichtbare Labortechniken wie Immunfluoreszenz5, Immunpräzipitation6, Durchflusszytometrie7, ELISA und Western Blotting. Für jede dieser Anwendungen ist es von entscheidender Bedeutung, genaue Messungen der Bindungseigenschaften des Antikörpers, einschließlich Bindungsaffinität und Spezifität, zu erhalten.
Seit der Einführung des ersten kommerziellen Oberflächen-Plasmonresonanz-Instruments (SPR) im Jahr 1990 sind optische Biosensoren zum “Goldstandard” der Antikörpercharakterisierung geworden, aber auch andere Techniken, einschließlich ELISA, werden routinemäßig zur Messung von Antikörperaffinitäten8,9verwendet. Diese Methoden erfordern in der Regel eine Immobilisierung oder Kennzeichnung der analysierten Moleküle, was die Interaktion von Interesse potenziell beeinflussen kann. Sie sind auch relativ langsam und beinhalten mehrere Assay-Schritte, bevor die Ergebnisse für die Datenanalyse gesammelt werden können. Eine kürzlich entwickelte Einzelmolekülmethode, die Massenphotometrie (MP), erkennt Moleküle direkt in Lösung, wenn sie auf der Oberfläche des Mikroskopdeckelslanden 10,11. Die lichtstreuende optische Detektion, die MP verwendet, erfordert keine Proteinkennzeichnung oder -modifikation. Einzelne Proteinmoleküle werden vom interferometrischen Streumikroskop als dunkle Flecken im Bild aufgezeichnet (Abbildung 1D), und mehrere tausend Moleküle können während der einminütigen Datenerfassung12nachgewiesen werden. Das von jedem einzelnen Teilchen erzeugte Signal wird quantifiziert, und sein Kontrastwert (relative Dunkelheit) wird berechnet. Die interferometrischen Kontrastwerte sind proportional zu den Molekularmassen der Proteine, was die Identifizierung gebundener und freier Arten in der Antigen-Antikörper-Mischung ermöglicht. Gleichzeitig misst MP durch zählende molekulare Landeereignisse direkt die Artenpopulationen. Dies gibt MP-basierten Methoden eine einzigartige Fähigkeit, Affinitäten mehrerer Bindungssites unabhängig zu quantifizieren.
Die Bindung der Antigenmoleküle (Ag) an die beiden Bindungsstellen des intakten Antikörpers (Ab) kann wie folgt beschrieben werden: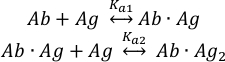
mit den Gleichgewichtsassoziationskonstanten Ka1 und Ka2 definiert als: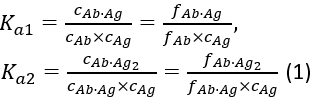
wobei ci und fi die Konzentration und den Anteil der Komponente idarstellen. Die Gesamtantigenkonzentration (cAg)tot kann wie: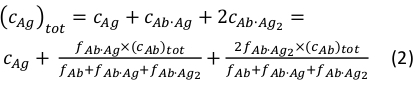
Da die Gesamtkonzentrationen des Antikörpers (cAb)tot und antigen (cAg)tot bekannt sind, kann diese Gleichung verwendet werden, um die experimentellen Bauteilfraktionen, die aus den MP-Messungen gewonnen wurden, direkt anzupassen und die Gleichgewichtsassoziationskonstanten Ka1 und Ka2 zu berechnen (siehe Ergänzende Informationen).
Die MP-Daten können auch verwendet werden, um die Kooperative zwischen den beiden Antikörperbindungsstellen11zu schätzen. Bei zwei Antikörperparatopen mit identischen mikroskopischen Bindungskonstanten sind die statistischen Faktoren, die den Prozess der Population des Ab– Ag und Ab Ag2-Komplexe diktieren, dass die scheinbaren makroskopischen Gleichgewichtskonstanten Ka1 und Ka2 nicht numerisch gleich sind und Ka1 = 4Ka2. Daher weisen die experimentellen Werte von Ka1 < 4Ka2 auf eine positive Kooperatoaktivität zwischen den beiden Antikörperbindungsstellen hin. Ebenso weist Ka1 > 4Ka2 auf negative Kooperatonität hin.
MP-Messungen der Antigen-Antikörper-Bindungsaffinität sind schnell und erfordern eine geringe Menge an Material. Die MP-Massenverteilungen, die für Gleichgewichtskonstantenberechnungen verwendet werden, liefern zusätzliche Informationen über die Probeneigenschaften und ermöglichen die Bewertung der Probenreinheit, Oligomerisierung und Aggregation in einem einzigen Experiment. Die gleiche Methode kann verwendet werden, um eine proteinreiche Protein-Protein-Bindung mit hoher Affinität zu messen, und MP ist besonders nützlich für Studien mit multivalenten Proteinwechselwirkungen. Multiproteinkomplexe haben in der Regel große molekulare Massen, optimal für die MP-Erkennung, und Einzelmoleküldaten können verwendet werden, um stoichiometrie zu messen und Affinitäten mehrerer Bindungsstellen gleichzeitig zu berechnen. Diese Informationen sind in der Regel schwierig, mit massenbasierten Methoden zu erhalten.
Ohne Modifikationen eignet sich das aktuelle Protokoll für Messungen von relativ hochaffinen submikromolaren Wechselwirkungen mit Antigenen einer Molekülmasse von 20 kDa oder größer. Für optimale Ergebnisse sollten Proteinvorräte von hoher Reinheit sein, aber es gibt keine spezifischen Pufferanforderungen. Durch die Verwendung von MP kann die Antigen-Antikörper-Bindung in weniger als fünf Minuten beurteilt werden. Die datenerfassung und -analyse, die für genaue Kd-Berechnungen erforderlich sind, kann innerhalb von 30 Minuten durchgeführt werden.
Protocol
Representative Results
Discussion
Das hier beschriebene Mass Photometry-basierte Protokoll bietet eine schnelle und genaue Methode zur Messung von Antigen-Antikörper-Bindungsaffinitäten. Die MP-Analyse verwendet eine sehr geringe Menge an Material, und zusätzliche Informationen – einschließlich Stoichiometrie, Oligomerisierung und Reinheit – können anhand derselben Daten ausgewertet werden (Abbildung 5). Ohne Modifikationen ist diese Methode auf die Messungen von Dissoziationskonstanten im Bereich von ca. 5 nM bis 5…
Declarações
The authors have nothing to disclose.
Acknowledgements
Wir danken Keir Neuman für seine kritische Lektüre des Manuskripts. Diese Arbeit wurde durch das intramurale Programm des NHLBI, NIH unterstützt.
Materials
| AcquireMP | Refeyn | MP data collection software | |
| Anti-human thrombin | Haematologic Technologies | AHT-5020 | RRID: AB_2864302 |
| Cotton-tipped applicators | Thorlabs | CTA10 | cotton optical swabs for lens cleaning |
| Coverslips 24×24 mm | Globe Scientific | 1405-10 | |
| Coverslips 24×50 mm | Fisher Scientific | 12-544-EP | |
| DiscoverMP | Refeyn | MP data processing software | |
| Forceps | Electron Microscopy Sciences | 78080-CF | soft-tipped forceps for coverslips handling |
| Human α-thrombin | Haematologic Technologies | HCT-0020 | |
| Immersion oil | Thorlabs | MOIL-30 | |
| Isopropanol | Alfa Aesar | 36644 | |
| Microsoft Excel | Microsoft | spreadsheet | |
| OneMP | Refeyn | Mass Photometry instrument | |
| Origin | OriginLab | scientific graphing software | |
| PBS | Corning | 46-013-CM | 10x stock |
| Syringe filter | Millipore | SLGSR33SS | buffer and sample filtering |
Referências
- Francis, R. J., et al. A phase I trial of antibody directed enzyme prodrug therapy (ADEPT) in patients with advanced colorectal carcinoma or other CEA producing tumours. British Journal of Cancer. 87 (6), 600-607 (2002).
- van Dyck, C. H. Anti-Amyloid-beta Monoclonal Antibodies for Alzheimer’s Disease: Pitfalls and Promise. Biological Psychiatry. 83 (4), 311-319 (2018).
- Vennepureddy, A., Singh, P., Rastogi, R., Atallah, J. P., Terjanian, T. Evolution of ramucirumab in the treatment of cancer – A review of literature. Journal of Oncology Pharmacy Practice. 23 (7), 525-539 (2017).
- Waldmann, T. A. Immunotherapy: past, present and future. Nature Medicine. 9 (3), 269-277 (2003).
- Huang, B., Bates, M., Zhuang, X. Super-resolution fluorescence microscopy. Annual Review of Biochemistry. 78, 993-1016 (2009).
- Rosenberg, M. I. . Protein Analysis and Purification. , (2005).
- Picot, J., Guerin, C. L., Le Van Kim, C., Boulanger, C. M. Flow cytometry: Retrospective, fundamentals and recent instrumentation. Cytotechnology. 64 (2), 109-130 (2012).
- Khan, S. H., Farkas, K., Kumar, R., Ling, J. A versatile method to measure the binding to basic proteins by surface plasmon resonance. Analytical Biochemistry. 421 (2), 385-390 (2012).
- Lofgren, J. A., et al. Comparing ELISA and surface plasmon resonance for assessing clinical immunogenicity of panitumumab. The Journal of Immunology. 178 (11), 7467-7472 (2007).
- Young, G., et al. Quantitative mass imaging of single biological macromolecules. Science. 360 (6387), 423-427 (2018).
- Wu, D., Piszczek, G. Measuring the affinity of protein-protein interactions on a single-molecule level by mass photometry. Analytical Biochemistry. 592, 113575 (2020).
- Cole, D., Young, G., Weigel, A., Sebesta, A., Kukura, P. Label-free single-molecule imaging with numerical-aperture-shaped interferometric scattering microscopy. ACS Photonics. 4 (2), 211-216 (2017).
- Soltermann, F., et al. Quantifying protein-protein interactions by molecular counting with mass photometry. Angewandte Chemie International Edition in English. 59 (27), 10774-10779 (2020).
- Kemmer, G., Keller, S. Nonlinear least-squares data fitting in Excel spreadsheets. Nature Protocols. 5 (2), 267-281 (2010).

