Determinação rápida da afinidade anticorpo-antígeno por fotometria em massa
Summary
Descrevemos uma abordagem de molécula única para medições de afinidade antígeno-anticorpos usando fotometria em massa (MP). O protocolo baseado em MP é rápido, preciso, usa uma quantidade muito pequena de material, e não requer modificação de proteína.
Abstract
As medidas da especificidade e afinidade das interações antígeno-anticorpos são criticamente importantes para aplicações médicas e de pesquisa. Neste protocolo, descrevemos a implementação de uma nova técnica de molécula única, fotometria em massa (MP), para este fim. MP é uma técnica livre de rótulos e imobilização que detecta e quantifica massas moleculares e populações de anticorpos e complexos de anticorpos de antígeno em um nível de molécula única. Mp analisa a amostra de anticorpos de antígeno em poucos minutos, permitindo a determinação precisa da afinidade vinculante e simultaneamente fornecendo informações sobre a estequiometria e o estado oligomérico das proteínas. Trata-se de uma técnica simples e simples que requer apenas quantidades de picomole de proteína e sem consumíveis caros. O mesmo procedimento pode ser usado para estudar a ligação proteína-proteína para proteínas com uma massa molecular maior que 50 kDa. Para interações proteicas multivalentes, as afinidades de múltiplos locais de ligação podem ser obtidas em uma única medição. No entanto, o modo de medição de molécula única e a falta de rotulagem impõem algumas limitações experimentais. Este método dá os melhores resultados quando aplicado às medições de afinidades de interação submicílar, antígenos com uma massa molecular de 20 kDa ou maiores, e amostras relativamente puras de proteína. Descrevemos também o procedimento para a realização das etapas necessárias de montagem e cálculo usando o software básico de análise de dados.
Introduction
Os anticorpos tornaram-se ferramentas onipresentes da biologia molecular e são usados extensivamente em aplicações médicas e de pesquisa. Na medicina, eles são criticamente importantes em diagnósticos, mas suas aplicações terapêuticas também estão se expandindo e novas terapias baseadas em anticorpos estão sendo constantemente desenvolvidas1,2,3,4. As aplicações científicas dos anticorpos incluem muitas técnicas laboratoriais indispensáveis, como a imunofluorescência5,a imunoprecipitação6,a citometria de fluxo7,a ELISA e a mancha ocidental. Para cada uma dessas aplicações, obter medidas precisas das propriedades vinculantes do anticorpo, incluindo afinidade e especificidade vinculantes, é de importância crucial.
Desde que o primeiro instrumento de ressonância de plasmon de superfície comercial (SPR) foi introduzido em 1990, os biosensores ópticos tornaram-se o “padrão ouro” da caracterização de anticorpos, mas outras técnicas, incluindo a ELISA, também são rotineiramente utilizadas para medir afinidades de anticorpos8,9. Esses métodos geralmente requerem imobilização ou rotulagem das moléculas analisadas, o que pode afetar potencialmente a interação de interesse. Eles também são relativamente lentos, envolvendo múltiplas etapas de ensaio antes que os resultados possam ser coletados para análise de dados. Um método de molécula única recentemente desenvolvido, a fotometria em massa (MP), detecta moléculas diretamente na solução quando pousam na superfície do microscópio, o deslizamento10,11. A detecção óptica baseada em dispersão de luz que a MP emprega não requer rotulagem ou modificação de proteínas. Moléculas proteicas individuais são registradas pelo microscópio de dispersão interferométrica à medida que manchas escuras aparecem na imagem (Figura 1D), e várias milhares de moléculas podem ser detectadas durante a aquisição de dados de um minuto12. O sinal gerado por cada partícula individual é quantificado, e seu valor de contraste (escuridão relativa) é calculado. Os valores de contraste interferométrico são proporcionais às massas moleculares das proteínas, o que permite a identificação de espécies ligadas e livres na mistura antígeno-anticorpo. Ao mesmo tempo, contando eventos de pouso molecular, a MP mede diretamente as populações de espécies. Isso dá aos métodos baseados em MP uma capacidade única de quantificar independentemente as afinidades de vários sites de vinculação.
A ligação das moléculas de antígeno(Ag)aos dois locais de ligação do anticorpo intacto(Ab)pode ser descrita como: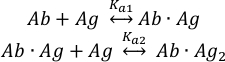
com as constantes de associação de equilíbrio Ka1 e Ka2 definidas como: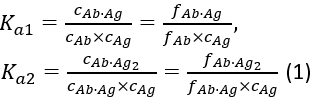
onde ci e f i representam concentração e fração do componente i,respectivamente. A concentração total de antígeno(cAg)pode ser expressa como: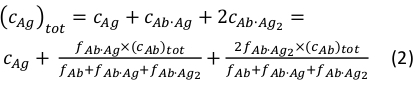
Uma vez que são conhecidas as concentrações totais do anticorpo (cAb)tot e antígeno(cAg),esta equação pode ser usada para se encaixar diretamente nas frações de componentes experimentais obtidas das medições de MP e calcular as constantes de associação de equilíbrio Ka1 e Ka2 (ver Informações Complementares).
Os dados da MP também podem ser usados para estimar a cooperatividade entre os dois locais de ligação de anticorpos11. Para dois paratopos de anticorpos com constantes microscópicas idênticas, os fatores estatísticos que descrevem o processo populacional do Ab· Ag e Ab· Oscomplexos Ag2 ditam que as aparentes constantes de equilíbrio macroscópico Ka1 e Ka2 não serão numericamente iguais, e Ka1 = 4Ka2. Portanto, os valores experimentais de Ka1 < 4Ka2 indicam cooperatividade positiva entre os dois locais de ligação de anticorpos. Da mesma forma, Ka1 > 4Ka2 indica cooperatividade negativa.
As medidas mp da afinidade de ligação antígeno-anticorpo são rápidas e requerem uma pequena quantidade de material. As distribuições de massa mp utilizadas para cálculos constantes de equilíbrio fornecem informações adicionais sobre as propriedades da amostra e permitem a avaliação da pureza da amostra, oligomerização e agregação em um único experimento. O mesmo método pode ser usado para medir a ligação proteína-proteína de alta afinidade, e a MP é particularmente útil para estudos de interações proteicas multi-valentes. Complexos multi-proteínas geralmente têm grandes massas moleculares, ótimas para detecção de MP, e dados de molécula única podem ser usados para medir a estequiometria e calcular afinidades de múltiplos locais de ligação simultaneamente. Essas informações geralmente são difíceis de obter usando métodos baseados em massa.
Sem modificações, o protocolo atual é adequado para medições de interações submicrlares relativamente altas e submicrílares com antígenos de uma massa molecular de 20 kDa ou maior. Para obter resultados ótimos, os estoques de proteínas devem ser de alta pureza, mas não há requisitos específicos de buffer. Usando MP, a ligação antígeno-anticorpo pode ser avaliada em menos de cinco minutos. A coleta e análise de dados necessárias para cálculos Kd precisos podem ser realizadas dentro de 30 minutos.
Protocol
Representative Results
Discussion
O protocolo baseado em Fotometria em Massa descrito aqui fornece um método rápido e preciso de medir afinidades de ligação de anticorpos de antígeno. A análise de MP usa uma quantidade muito pequena de material e informações adicionais — incluindo estequiometria, oligomerização e pureza — podem ser avaliadas a partir dos mesmos dados(Figura 5). Sem modificações, este método é aplicável às medições de constantes de dissociação na faixa de aproximadamente 5 nM a 500 nM,…
Declarações
The authors have nothing to disclose.
Acknowledgements
Agradecemos a Keir Neuman por sua leitura crítica do manuscrito. Este trabalho foi apoiado pelo programa intramuros da NHLBI, NIH.
Materials
| AcquireMP | Refeyn | MP data collection software | |
| Anti-human thrombin | Haematologic Technologies | AHT-5020 | RRID: AB_2864302 |
| Cotton-tipped applicators | Thorlabs | CTA10 | cotton optical swabs for lens cleaning |
| Coverslips 24×24 mm | Globe Scientific | 1405-10 | |
| Coverslips 24×50 mm | Fisher Scientific | 12-544-EP | |
| DiscoverMP | Refeyn | MP data processing software | |
| Forceps | Electron Microscopy Sciences | 78080-CF | soft-tipped forceps for coverslips handling |
| Human α-thrombin | Haematologic Technologies | HCT-0020 | |
| Immersion oil | Thorlabs | MOIL-30 | |
| Isopropanol | Alfa Aesar | 36644 | |
| Microsoft Excel | Microsoft | spreadsheet | |
| OneMP | Refeyn | Mass Photometry instrument | |
| Origin | OriginLab | scientific graphing software | |
| PBS | Corning | 46-013-CM | 10x stock |
| Syringe filter | Millipore | SLGSR33SS | buffer and sample filtering |
Referências
- Francis, R. J., et al. A phase I trial of antibody directed enzyme prodrug therapy (ADEPT) in patients with advanced colorectal carcinoma or other CEA producing tumours. British Journal of Cancer. 87 (6), 600-607 (2002).
- van Dyck, C. H. Anti-Amyloid-beta Monoclonal Antibodies for Alzheimer’s Disease: Pitfalls and Promise. Biological Psychiatry. 83 (4), 311-319 (2018).
- Vennepureddy, A., Singh, P., Rastogi, R., Atallah, J. P., Terjanian, T. Evolution of ramucirumab in the treatment of cancer – A review of literature. Journal of Oncology Pharmacy Practice. 23 (7), 525-539 (2017).
- Waldmann, T. A. Immunotherapy: past, present and future. Nature Medicine. 9 (3), 269-277 (2003).
- Huang, B., Bates, M., Zhuang, X. Super-resolution fluorescence microscopy. Annual Review of Biochemistry. 78, 993-1016 (2009).
- Rosenberg, M. I. . Protein Analysis and Purification. , (2005).
- Picot, J., Guerin, C. L., Le Van Kim, C., Boulanger, C. M. Flow cytometry: Retrospective, fundamentals and recent instrumentation. Cytotechnology. 64 (2), 109-130 (2012).
- Khan, S. H., Farkas, K., Kumar, R., Ling, J. A versatile method to measure the binding to basic proteins by surface plasmon resonance. Analytical Biochemistry. 421 (2), 385-390 (2012).
- Lofgren, J. A., et al. Comparing ELISA and surface plasmon resonance for assessing clinical immunogenicity of panitumumab. The Journal of Immunology. 178 (11), 7467-7472 (2007).
- Young, G., et al. Quantitative mass imaging of single biological macromolecules. Science. 360 (6387), 423-427 (2018).
- Wu, D., Piszczek, G. Measuring the affinity of protein-protein interactions on a single-molecule level by mass photometry. Analytical Biochemistry. 592, 113575 (2020).
- Cole, D., Young, G., Weigel, A., Sebesta, A., Kukura, P. Label-free single-molecule imaging with numerical-aperture-shaped interferometric scattering microscopy. ACS Photonics. 4 (2), 211-216 (2017).
- Soltermann, F., et al. Quantifying protein-protein interactions by molecular counting with mass photometry. Angewandte Chemie International Edition in English. 59 (27), 10774-10779 (2020).
- Kemmer, G., Keller, S. Nonlinear least-squares data fitting in Excel spreadsheets. Nature Protocols. 5 (2), 267-281 (2010).

