Rapida determinazione dell'affinità anticorpo-antigene mediante fotometria di massa
Summary
Descriviamo un approccio a singola molecola alle misurazioni dell’affinità antigene-anticorpo usando la fotometria di massa (MP). Il protocollo basato su MP è veloce, accurato, utilizza una quantità molto piccola di materiale e non richiede modifiche proteiche.
Abstract
Le misurazioni della specificità e dell’affinità delle interazioni antigene-anticorpo sono di fondamentale importanza per le applicazioni mediche e di ricerca. In questo protocollo, descriviamo l’implementazione di una nuova tecnica a singola molecola, la fotometria di massa (MP), per questo scopo. MP è una tecnica senza etichetta e immobilizzazione che rileva e quantifica masse molecolari e popolazioni di anticorpi e complessi antigene-anticorpi a livello di singola molecola. MP analizza il campione antigene-anticorpo in pochi minuti, consentendo la determinazione precisa dell’affinità di legame e fornendo contemporaneamente informazioni sulla stechiometria e sullo stato oligomerico delle proteine. Questa è una tecnica semplice e diretta che richiede solo quantità di picomole di proteine e non costosi materiali di consumo. La stessa procedura può essere utilizzata per studiare il legame proteina-proteina per proteine con una massa molecolare superiore a 50 kDa. Per le interazioni proteiche multivalenti, le affinità di più siti di legame possono essere ottenute in un’unica misurazione. Tuttavia, il modo di misurazione a singola molecola e la mancanza di etichettatura impongono alcune limitazioni sperimentali. Questo metodo fornisce i migliori risultati se applicato alle misurazioni di affinità di interazione sub-micromolare, antigeni con una massa molecolare di 20 kDa o più grandi, e campioni proteici relativamente puri. Descriviamo anche la procedura per eseguire le fasi di adattamento e calcolo richieste utilizzando il software di analisi dei dati di base.
Introduction
Gli anticorpi sono diventati strumenti onnipresenti della biologia molecolare e sono ampiamente utilizzati sia in applicazioni mediche che di ricerca. In medicina, sono di fondamentale importanza nella diagnostica, ma anche le loro applicazioni terapeutiche si stanno espandendo e nuove terapie basate su anticorpi vengono costantementesviluppate 1,2,3,4. Le applicazioni scientifiche degli anticorpi includono molte tecniche di laboratorio indispensabili come l’immunofluorescenza5,l’immunoprecipitazione6,la citometria aflusso 7,ELISA e l’blotting occidentale. Per ognuna di queste applicazioni, ottenere misurazioni accurate delle proprietà di legame dell’anticorpo, inclusa l’affinità di legame e la specificità, è di fondamentale importanza.
Da quando il primo strumento commerciale di risonanza plasmonica di superficie (SPR) è stato introdotto nel 1990, i biosensori ottici sono diventati il “gold standard” della caratterizzazione degli anticorpi, ma altre tecniche, tra cui ELISA, sono anche abitualmente utilizzate per misurare le affinitàanticorpali 8,9. Questi metodi di solito richiedono l’immobilizzazione o l’etichettatura delle molecole analizzate, che possono potenzialmente influenzare l’interazione di interesse. Sono anche relativamente lenti, coinvolgendo più fasi di dosaggio prima che i risultati possano essere raccolti per l’analisi dei dati. Un metodo a singola molecola recentemente sviluppato, la fotometria di massa (MP), rileva le molecole direttamente in soluzione quando atterrano sulla superficie del microscopio coverslip10,11. Il rilevamento ottico basato sulla diffusione della luce che MP utilizza non richiede l’etichettatura o la modifica delle proteine. Le singole molecole proteiche sono registrate dal microscopio a dispersione interferometrica come macchie scure che appaiono nell’immagine (Figura 1D), e diverse migliaia di molecole possono essere rilevate durante l’acquisizione di dati di un minuto12. Il segnale generato da ogni singola particella viene quantificato e viene calcolato il suo valore di contrasto (oscurità relativa). I valori di contrasto interferometrico sono proporzionali alle masse molecolari delle proteine, il che consente l’identificazione di specie legate e libere nella miscela antigene-anticorpo. Allo stesso tempo, contando gli eventi di atterraggio molecolare, MP misura direttamente le popolazioni di specie. Ciò offre ai metodi basati su MP una capacità unica di quantificare in modo indipendente le affinità di più siti di associazione.
Il legame delle molecole diantigene( Ag ) ai due siti di legame dell’anticorpo intatto (Ab) può essere descritto come: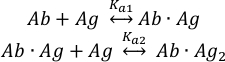
con le costanti di associazione di equilibrio Ka1 e Ka2 definite come: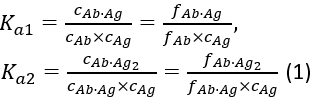
dove ci e fi rappresentano rispettivamente la concentrazione e la frazione del componente i. La concentrazione totale di antigeni (cAg)può essere espressa come: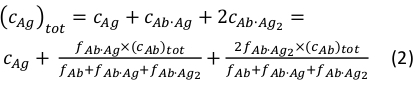
Poiché le concentrazioni totalidell’anticorpo (cAb) tot e dell’antigene (cAg)tot sono note, questa equazione può essere utilizzata per adattarsi direttamente alle frazioni di componenti sperimentali ottenute dalle misurazioni MP e calcolare le costanti di associazione di equilibrio Ka1 e Ka2 (vedi Informazioni supplementari).
I dati MP possono anche essere utilizzati per stimare la cooperatività tra i due siti di legame anticorpale11. Per due paratopi anticorpali con identiche costanti di legame microscopico, i fattori statistici che descrivono il processo di popolazione dell’Ab· Ag e Ab· Icomplessi ag 2 impongono che le costanti apparenti di equilibrio macroscopico Ka1 e Ka2 non siano numericamente uguali, e Ka1 = 4Ka2. Pertanto, i valori sperimentali di Ka1 < 4Ka2 indicano una cooperatività positiva tra i due siti di legame anticorpale. Allo stesso modo, Ka1 > 4Ka2 indica una cooperatività negativa.
Le misurazioni MP dell’affinità legante antigene-anticorpo sono veloci e richiedono una piccola quantità di materiale. Le distribuzioni di massa MP utilizzate per i calcoli costanti di equilibrio forniscono informazioni aggiuntive sulle proprietà del campione e consentono la valutazione della purezza del campione, dell’oligomerizzazione e dell’aggregazione in un singolo esperimento. Lo stesso metodo può essere usato per misurare il legame proteina-proteina ad alta affinità, e mp è particolarmente utile per studi sulle interazioni proteiche multivalenti. I complessi multi-proteina di solito hanno grandi masse molecolari, ottimali per il rilevamento mp, e i dati a singola molecola possono essere usati per misurare la stechiometria e calcolare contemporaneamente affinità di più siti di legame. Queste informazioni sono in genere difficili da ottenere utilizzando metodi basati sulla massa.
Senza modifiche, l’attuale protocollo è adatto per misurazioni di interazioni sub-micromolare ad affinità relativamente elevata con antigeni di massa molecolare di 20 kDa o superiore. Per risultati ottimali, gli stock proteici dovrebbero essere di elevata purezza, ma non ci sono requisiti tampone specifici. Utilizzando MP, il legame antigene-anticorpo può essere valutato in meno di cinque minuti. La raccolta e l’analisi dei dati necessarie per calcoli Kd accurati possono essere eseguite entro 30 minuti.
Protocol
Representative Results
Discussion
Il protocollo basato sulla fotometria di massa qui delineato fornisce un metodo rapido e accurato per misurare le affinità di legame antigene-anticorpo. L’analisi MP utilizza una quantità molto piccola di materiale e ulteriori informazioni, tra cui stechiometria, oligomerizzazione e purezza, possono essere valutate dagli stessi dati (Figura 5). Senza modifiche, questo metodo è applicabile alle misurazioni delle costanti di dissociazione nell’intervallo da 5 nM a 500 nM circa, e per le mol…
Declarações
The authors have nothing to disclose.
Acknowledgements
Ringraziamo Keir Neuman per la sua lettura critica del manoscritto. Questo lavoro è stato supportato dal programma intramurale della NHLBI, NIH.
Materials
| AcquireMP | Refeyn | MP data collection software | |
| Anti-human thrombin | Haematologic Technologies | AHT-5020 | RRID: AB_2864302 |
| Cotton-tipped applicators | Thorlabs | CTA10 | cotton optical swabs for lens cleaning |
| Coverslips 24×24 mm | Globe Scientific | 1405-10 | |
| Coverslips 24×50 mm | Fisher Scientific | 12-544-EP | |
| DiscoverMP | Refeyn | MP data processing software | |
| Forceps | Electron Microscopy Sciences | 78080-CF | soft-tipped forceps for coverslips handling |
| Human α-thrombin | Haematologic Technologies | HCT-0020 | |
| Immersion oil | Thorlabs | MOIL-30 | |
| Isopropanol | Alfa Aesar | 36644 | |
| Microsoft Excel | Microsoft | spreadsheet | |
| OneMP | Refeyn | Mass Photometry instrument | |
| Origin | OriginLab | scientific graphing software | |
| PBS | Corning | 46-013-CM | 10x stock |
| Syringe filter | Millipore | SLGSR33SS | buffer and sample filtering |
Referências
- Francis, R. J., et al. A phase I trial of antibody directed enzyme prodrug therapy (ADEPT) in patients with advanced colorectal carcinoma or other CEA producing tumours. British Journal of Cancer. 87 (6), 600-607 (2002).
- van Dyck, C. H. Anti-Amyloid-beta Monoclonal Antibodies for Alzheimer’s Disease: Pitfalls and Promise. Biological Psychiatry. 83 (4), 311-319 (2018).
- Vennepureddy, A., Singh, P., Rastogi, R., Atallah, J. P., Terjanian, T. Evolution of ramucirumab in the treatment of cancer – A review of literature. Journal of Oncology Pharmacy Practice. 23 (7), 525-539 (2017).
- Waldmann, T. A. Immunotherapy: past, present and future. Nature Medicine. 9 (3), 269-277 (2003).
- Huang, B., Bates, M., Zhuang, X. Super-resolution fluorescence microscopy. Annual Review of Biochemistry. 78, 993-1016 (2009).
- Rosenberg, M. I. . Protein Analysis and Purification. , (2005).
- Picot, J., Guerin, C. L., Le Van Kim, C., Boulanger, C. M. Flow cytometry: Retrospective, fundamentals and recent instrumentation. Cytotechnology. 64 (2), 109-130 (2012).
- Khan, S. H., Farkas, K., Kumar, R., Ling, J. A versatile method to measure the binding to basic proteins by surface plasmon resonance. Analytical Biochemistry. 421 (2), 385-390 (2012).
- Lofgren, J. A., et al. Comparing ELISA and surface plasmon resonance for assessing clinical immunogenicity of panitumumab. The Journal of Immunology. 178 (11), 7467-7472 (2007).
- Young, G., et al. Quantitative mass imaging of single biological macromolecules. Science. 360 (6387), 423-427 (2018).
- Wu, D., Piszczek, G. Measuring the affinity of protein-protein interactions on a single-molecule level by mass photometry. Analytical Biochemistry. 592, 113575 (2020).
- Cole, D., Young, G., Weigel, A., Sebesta, A., Kukura, P. Label-free single-molecule imaging with numerical-aperture-shaped interferometric scattering microscopy. ACS Photonics. 4 (2), 211-216 (2017).
- Soltermann, F., et al. Quantifying protein-protein interactions by molecular counting with mass photometry. Angewandte Chemie International Edition in English. 59 (27), 10774-10779 (2020).
- Kemmer, G., Keller, S. Nonlinear least-squares data fitting in Excel spreadsheets. Nature Protocols. 5 (2), 267-281 (2010).

