Isolement et purification évolutifs de vésicules extracellulaires à partir d’Escherichia coli et d’autres bactéries
Summary
Les bactéries sécrètent des vésicules extracellulaires (VE) de taille nanométrique transportant des molécules biologiques bioactives. La recherche sur les véhicules électriques se concentre sur la compréhension de leur biogenèse, de leur rôle dans les interactions microbes-microbes et hôte-microbe et des maladies, ainsi que de leurs applications thérapeutiques potentielles. Un flux de travail pour l’isolation évolutive des véhicules électriques de diverses bactéries est présenté pour faciliter la normalisation de la recherche sur les véhicules électriques.
Abstract
Diverses espèces bactériennes sécrètent ~20-300 nm de vésicules extracellulaires (VE), composées de lipides, de protéines, d’acides nucléiques, de glycanes et d’autres molécules dérivées des cellules parentales. Les VE fonctionnent comme des vecteurs de communication intra et inter-espèces tout en contribuant à l’interaction entre les bactéries et les organismes hôtes dans le contexte de l’infection et de la colonisation. Compte tenu de la multitude de fonctions attribuées aux VE dans la santé et la maladie, il y a un intérêt croissant pour l’isolement des VE pour les études in vitro et in vivo . On a émis l’hypothèse que la séparation des VE en fonction des propriétés physiques, à savoir la taille, faciliterait l’isolement des vésicules provenant de diverses cultures bactériennes.
Le flux de travail d’isolement comprend la centrifugation, la filtration, l’ultrafiltration et la chromatographie d’exclusion de taille (SEC) pour l’isolement des VE à partir de cultures bactériennes. Une étape de filtration à flux tangentiel (TFF) entraînée par pompe a été incorporée pour améliorer l’évolutivité, permettant l’isolation du matériau des litres de culture cellulaire de départ. Escherichia coli a été utilisé comme système modèle exprimant la nanoluciférase associée à EV et la mCherry non associée à EV en tant que protéines rapporteures. La nanoluciférase a été ciblée sur les VE en fusionnant son extrémité N avec la cytolysine A. Les premières fractions chromatographiques contenant 20-100 nm EVs avec cytolysine A – nanoLuc associée étaient distinctes des fractions ultérieures contenant les protéines libres. La présence de nanoluciférase associée à l’EV a été confirmée par marquage immuno-or et microscopie électronique à transmission. Ce flux de travail d’isolation EV est applicable à d’autres espèces bactériennes à Gram négatif et à Gram positif associées à l’intestin humain. En conclusion, la combinaison de la centrifugation, de la filtration, de l’ultrafiltration/TFF et de la SEC permet une isolation évolutive des VE de diverses espèces bactériennes. L’utilisation d’un flux de travail d’isolement normalisé facilitera les études comparatives des VE microbiennes entre les espèces.
Introduction
Les vésicules extracellulaires (VE) sont des structures de type liposome, de taille nanométrique, composées de lipides, de protéines, de glycanes et d’acides nucléiques, sécrétées par les cellules procaryotes et eucaryotes1. Depuis les premières études visualisant la libération de VE par les bactéries à Gram négatif2, le nombre de fonctions biologiques attribuées aux VE bactériens (20-300 nm de diamètre) n’a cessé de croître au cours des dernières décennies. Leurs fonctions comprennent le transfert de la résistance aux antibiotiques3, la formation de biofilm4, la détection du quorum5 et l’administration de toxines6. L’utilisation des VE bactériens comme thérapeutique suscite également un intérêt croissant, en particulier en vaccinologie7 et en traitement du cancer8.
Malgré l’intérêt croissant pour la recherche sur les véhicules électriques, il existe encore des défis techniques concernant les méthodes d’isolement. Plus précisément, il existe un besoin de méthodes d’isolement reproductibles, évolutives et compatibles avec divers organismes producteurs de VE. Afin de créer un ensemble unifié de principes pour la planification et le rapport sur l’isolement des VE et les méthodes de recherche, la Société internationale pour les vésicules extracellulaires publie et met à jour le document de positionMISEV 9. En outre, le consortium EV-TRACK fournit une plate-forme ouverte pour rendre compte des méthodologies détaillées pour l’isolation des VE utilisées dans les manuscrits publiés afin d’améliorer la transparence10.
Dans ce protocole, les méthodologies précédentes utilisées pour l’isolement des VE à partir de cultures de cellules de mammifères ont été adaptées11,12 pour permettre l’isolement des VE à partir de la culture de cellules bactériennes. Nous avons cherché à utiliser des méthodes qui permettent d’isoler les VE d’une variété de microbes, ce qui peut être évolutif, et d’équilibrer la pureté et le rendement des VE (comme discuté dans le document de positionMISEV 9). Après élimination des cellules bactériennes et des débris par centrifugation et filtration, le milieu de culture est concentré soit par ultrafiltration par dispositif centrifuge (pour un volume allant jusqu’à ~100 mL), soit par TFF entraîné par pompe (pour les plus grands volumes). Les véhicules électriques sont ensuite isolés par SEC à l’aide de colonnes optimisées pour la purification des petits véhicules électriques.
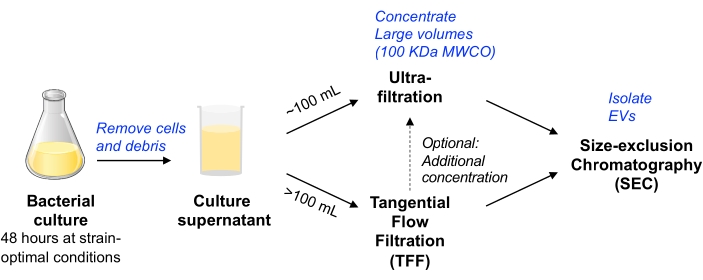
Figure 1 : Vue d’ensemble schématique du flux de travail d’isolation bactérienne des véhicules électriques. Abréviations : EV = vésicule extracellulaire; TFF = filtration à flux tangentiel; SEC = chromatographie d’exclusion de taille; MWCO = seuil de poids moléculaire. Veuillez cliquer ici pour voir une version agrandie de cette figure.
Une souche commenssale de souris d’Escherichia coli (c.-à-d. E. coli MP1 13) a été utilisée comme organisme modèle et modifiée pour exprimer la nanoluciférase associée à l’EV par fusion avec la cytolysine A, comme indiqué précédemment14. Les méthodes utilisées ici peuvent traiter au moins jusqu’à plusieurs litres de cultures bactériennes et séparer efficacement les protéines associées à EV des protéines non associées à EV. Enfin, cette méthode peut également être utilisée pour d’autres espèces bactériennes à Gram positif et à Gram négatif. Toutes les données pertinentes des expériences rapportées ont été soumises à la base de connaissances EV-TRACK (EV-TRACK ID: EV210211)10.
Protocol
Representative Results
Discussion
Dans le protocole ci-dessus, une méthode est décrite qui est évolutive et isole de manière fiable les VE de diverses bactéries gram-négatives/positives et aérobies/anaérobies. Il a plusieurs points d’arrêt potentiels tout au long de la procédure, bien qu’il soit préférable d’éviter de prendre plus de 48 heures pour isoler les VE des milieux de culture bactériens conditionnés.
Tout d’abord, il consiste à cultiver des bactéries pour générer un milieu de culture bactér…
Declarações
The authors have nothing to disclose.
Acknowledgements
La recherche décrite ci-dessus a été soutenue par la subvention de formation NIH TL1 TR002549-03. Nous remercions les Drs John C. Tilton et Zachary Troyer (Case Western Reserve University) d’avoir facilité l’accès à l’instrument d’analyse granulométrique; Lew Brown (Spectradyne) pour l’assistance technique à l’analyse des données de distribution granulométrique; Dr David Putnam de l’Université Cornell pour avoir fourni le plasmide14 pClyA-GFP; et le Dr Mark Goulian de l’Université de Pennsylvanie pour nous avoir fourni le MP113 de E. coli.
Materials
| 0.5 mL flat cap, thin-walled PCR tubes | Thermo Scientific | 3430 | it is important to use thin-walled PCR tubes to obtain accurate readings with Qubit |
| 16% Paraformaldehyde (formaldehyde) aqueous solution | Electron microscopy sciences | 15700 | |
| 250 mL Fiberlite polypropylene centrifuge bottles | ThermoFisher | 010-1495 | |
| 500 mL Fiberlite polypropylene centrifuge bottles | ThermoFisher | 010-1493 | |
| 65 mm Polypropylene Round-Bottom/Conical Bottle Adapter | Beckman Coulter | 392077 | Allows Vivacell to fit in rotor |
| Akkermansia mucinophila | ATCC | BAA-835 | |
| Amicon-15 (100 kDa MWCO) | MilliporeSigma | UFC910024 | |
| Avanti J-20 XPI centrifuge | Beckman Coulter | No longer sold by Beckman. Avanti J-26XP is closest contemporary model. | |
| Bacteroides thetaiotaomicron VPI 5482 | ATCC | 29148 | |
| Bifidobacterium breve | NCIMB | B8807 | |
| Bifidobacterium dentium | ATCC | 27678 | |
| Brain Heart infusion (BHI) broth | Himedia | M2101 | After autoclaving, Both BHI broth and agar were introduced into the anaerobic chamber, supplemented with Menadione (1 µg/L), hematin (1.2 µg/L), and L-Cysteine Hydrochloride (0.05%). They were then incubated for at least 24 h under anaerobic conditions before inoculation with the anaerobic bacterial strains. |
| C-300 microfluidics cartridge | Spectradyne | ||
| Chloramphenicol | MP Biomedicals | ICN19032105 | |
| Escherichia coli HST08 (Steller competent cells) | Takara | 636763 | |
| Escherichia coli MP1 | Dr. Mark Goulian (gift) | commensal bacteria derived from mouse gut | |
| Fiberlite 500 mL to 250 mL adapter | ThermoFisher | 010-0151-05 | used with Fiberlite rotor to enable 250 mL bottles to be used for smaller size of starting bacterial culture |
| Fiberlite fixed-angle centrifuge rotor | ThermoFisher | F12-6×500-LEX | fits 6 x 500 mL bottles |
| Formvar Carbon Film 400 Mesh, Copper | Electron microscopy sciences | FCF-400-CU | |
| Glutaraldehyde (EM-grade, 10% aqeous solution) | Electron microscopy sciences | 16100 | |
| Hematin | ChemCruz | 207729B | Stock solution was made in 0.2 M L-histidine solution as 1.2 mg/mL |
| Infinite M Nano+ Microplate reader | Tecan | This equibment was used to measure the mCherry fluorescence | |
| In-Fusion HD Cloning Plus | Takara | 638909 | For cloning of the PCR fragements into the PCR-lineraized vectors |
| JS-5.3 AllSpin Swinging-Bucket Rotor | Beckman Coulter | 368690 | |
| Lauria Bertani (LB) broth, Miller | Difco | 244620 | |
| L-Cysteine Hydrochloride | J.T. Baker | 2071-05 | It should be weighed and added directly to the autoclaved BHI media inside the anaerobic chamber |
| Masterflex Fitting, Polypropylene, Straight, Female Luer to Hose Barb Adapter, 1/8" ID; 25/PK | cole-parmer – special | HV-30800-08 | connection adapters for filtration tubing circuit |
| Masterflex Fitting, Polypropylene, Straight, Male Luer to Hose Barb Adapter, 1/8" ID; 25/PK | cole-parmer – special | HV-30800-24 | connection adapters for filtration tubing circuit |
| Masterflex L/S Analog Variable-Speed Console Drive, 20 to 600 rpm | Masterflex | HV-07555-00 | |
| Masterflex L/S Easy-Load Head for Precision Tubing, 4-Roller, PARA Housing, SS Rotor | Masterflex | EW-07514-10 | |
| Masterflex L/S Precision Pump Tubing, PharmaPure, L/S 16; 25 ft | Cole Palmer | EW-06435-16 | low-binding/low-leaching tubing |
| Menadione (Vitamin K3) | MP | 102259 | Stock solution was made in ethanol as 1 mg/mL |
| MIDIKROS 41.5CM 100K MPES 0.5MM FLL X FLL 1/PK | Repligen | D04-E100-05-N | TFF device we have used to filter up to 2 L of E. coli culture supernatant |
| Nano-Glo Luciferase Assay System | Promega | N1110 | This assay kit was used to measure the luminescence of the nluc reporter protein |
| NanoLuc (Nluc) Luciferase Antibody, clone 965808 | R&D Systems | MAB10026 | |
| nCS1 microfluidics resistive pulse sensing instrument | Spectradyne | ||
| nCS1 Viewer | Spectradyne | Analysis software for particle size distribution | |
| OneTaq 2x Master Mix with Standard Buffer | NEB | M0482 | DNA polymerase master mix used to perform the routine PCR reactions for colony checking |
| Protein LoBind, 2.0 mL, PCR clean tubes | Eppendorf | 30108450 | |
| Q5 High-Fidelity 2x Master Mix | NEB | M0492 | DNA polymerase master mix used to perform the PCR reactions needed for cloning |
| qEV original, 35 nm | Izon | maximal loading volume of 0.5 mL | |
| qEV rack | Izon | for use with the qEV-original SEC columns | |
| qEV-2, 35 nm | Izon | maximal loading volume of 2 mL | |
| Qubit fluorometer | ThermoFisher | Item no longer available. Closest available product is Qubit 4.0 Fluorometer (cat. No. Q33238) | |
| Qubit protein assay kit | ThermoFisher | Q33211 | Store kit at room temperature. Standards are stored at 4 °C. |
| Sorvall Lynx 4000 centrifuge | ThermoFisher | 75006580 | |
| SpectraMax i3x Microplate reader | Molecular Devices | This equipment was used to measure the nanoluciferase bioluminescence | |
| Stericup Quick-release-GP Sterile Vacuum Filtration system (150, 250, or 500 mL) | MilliporeSigma | S2GPU01RE S2GPU02RE S2GPU05RE |
One or multiple filters can be used to accommodate working volumes. In our experience, you can filter twice the volume listed on the product size. |
| Uranyl acetate | Electron microscopy sciences | 22400 | |
| Vinyl anaerobic chamber | Coy Lab | ||
| Vivacell 100, 100,000 MWCO PES | Sartorius | VC1042 | |
| Whatman Anotop 10 Plus syringe filters (0.02 micron) | MilliporeSigma | WHA68093002 | to filter MRPS diluent |
Referências
- Yanez-Mo, M., et al. Biological properties of extracellular vesicles and their physiological functions. Journal of Extracellular Vesicles. 4, 27066 (2015).
- Chatterjee, S. N., Das, J. Electron microscopic observations on the excretion of cell-wall material by Vibrio cholerae. Journal of General Microbiology. 49 (1), 1-11 (1967).
- Ciofu, O., Beveridge, T. J., Kadurugamuwa, J., Walther-Rasmussen, J., Hoiby, N. Chromosomal beta-lactamase is packaged into membrane vesicles and secreted from Pseudomonas aeruginosa. Journal of Antimicrobial Chemotherapy. 45 (1), 9-13 (2000).
- Yonezawa, H., et al. Outer membrane vesicles of Helicobacter pylori TK1402 are involved in biofilm formation. BMC Microbiology. 9, 197 (2009).
- Mashburn, L. M., Whiteley, M. Membrane vesicles traffic signals and facilitate group activities in a prokaryote. Nature. 437 (7057), 422-425 (2005).
- Kato, S., Kowashi, Y., Demuth, D. R. Outer membrane-like vesicles secreted by Actinobacillus actinomycetemcomitans are enriched in leukotoxin. Microbial Pathogenesis. 32 (1), 1-13 (2002).
- Petousis-Harris, H., et al. Effectiveness of a group B outer membrane vesicle meningococcal vaccine against gonorrhoea in New Zealand: a retrospective case-control study. Lancet. 390 (10102), 1603-1610 (2017).
- Kim, O. Y., et al. Bacterial outer membrane vesicles suppress tumor by interferon-gamma-mediated antitumor response. Nature Communications. 8 (1), 626 (2017).
- Thery, C., et al. Minimal information for studies of extracellular vesicles 2018 (MISEV2018): a position statement of the International Society for Extracellular Vesicles and update of the MISEV2014 guidelines. Journal of Extracellular Vesicles. 7 (1), 1535750 (2018).
- Consortium, E. -. T., et al. EV-TRACK: transparent reporting and centralizing knowledge in extracellular vesicle research. Nature Methods. 14 (3), 228-232 (2017).
- Watson, D. C., et al. Efficient production and enhanced tumor delivery of engineered extracellular vesicles. Biomaterials. 105, 195-205 (2016).
- Watson, D. C., et al. Scalable, cGMP-compatible purification of extracellular vesicles carrying bioactive human heterodimeric IL-15/lactadherin complexes. Journal of Extracellular Vesicles. 7 (1), 1442088 (2018).
- Lasaro, M., et al. Escherichia coli isolate for studying colonization of the mouse intestine and its application to two-component signaling knockouts. Journal of Bacteriology. 196 (9), 1723-1732 (2014).
- Kim, J. Y., et al. Engineered bacterial outer membrane vesicles with enhanced functionality. Journal of Molecular Biology. 380 (1), 51-66 (2008).
- Beveridge, T. J. Structures of gram-negative cell walls and their derived membrane vesicles. Journal of Bacteriology. 181 (16), 4725-4733 (1999).
- Reimer, S. L., et al. Comparative analysis of outer membrane vesicle isolation methods with an Escherichia coli tolA mutant reveals a hypervesiculating phenotype with outer-inner membrane vesicle content. Frontiers in Microbiology. 12, 628801 (2021).

