Isolamento scalabile e purificazione di vescicole extracellulari da Escherichia coli e altri batteri
Summary
I batteri secernono vescicole extracellulari (EV) di dimensioni nanometriche che trasportano molecole biologiche bioattive. La ricerca EV si concentra sulla comprensione della loro biogenesi, del ruolo nelle interazioni e malattie microbo-microbo e ospite-microbo, nonché sulle loro potenziali applicazioni terapeutiche. Viene presentato un flusso di lavoro per l’isolamento scalabile dei veicoli elettrici da vari batteri per facilitare la standardizzazione della ricerca sui veicoli elettrici.
Abstract
Diverse specie batteriche secernono ~ 20-300 nm vescicole extracellulari (EV), composte da lipidi, proteine, acidi nucleici, glicani e altre molecole derivate dalle cellule parentali. Le EV funzionano come vettori di comunicazione intra e interspecie, contribuendo anche all’interazione tra batteri e organismi ospiti nel contesto dell’infezione e della colonizzazione. Data la moltitudine di funzioni attribuite alle EV in salute e malattia, vi è un crescente interesse nell’isolamento delle EV per studi in vitro e in vivo . È stato ipotizzato che la separazione dei veicoli elettrici in base alle proprietà fisiche, vale a dire le dimensioni, faciliterebbe l’isolamento delle vescicole da diverse colture batteriche.
Il flusso di lavoro di isolamento consiste in centrifugazione, filtrazione, ultrafiltrazione e cromatografia ad esclusione dimensionale (SEC) per l’isolamento di EV da colture batteriche. È stata incorporata una fase di filtrazione a flusso tangenziale (TFF) azionata da una pompa per migliorare la scalabilità, consentendo l’isolamento del materiale da litri di coltura cellulare iniziale. Escherichia coli è stato utilizzato come sistema modello che esprime nanoluciferasi associata a EV e mCherry non associata a EV come proteine reporter. La nanoluciferasi è stata mirata alle EV fondendo il suo N-terminale con la citolisina A. Le prime frazioni cromatografiche contenenti EV 20-100 nm con citolisina A – nanoLuc associata erano distinte dalle frazioni successive contenenti le proteine libere. La presenza di nanoluciferasi associate a EV è stata confermata dalla marcatura immunogold e dalla microscopia elettronica a trasmissione. Questo flusso di lavoro di isolamento EV è applicabile ad altre specie batteriche gram-negative e gram-positive associate all’intestino umano. In conclusione, la combinazione di centrifugazione, filtrazione, ultrafiltrazione / TFF e SEC consente l’isolamento scalabile di EV da diverse specie batteriche. L’impiego di un flusso di lavoro di isolamento standardizzato faciliterà gli studi comparativi delle EV microbiche tra le specie.
Introduction
Le vescicole extracellulari (EV) sono strutture simili a liposomi di dimensioni nanometriche composte da lipidi, proteine, glicani e acidi nucleici, secrete da cellule procariotiche ed eucariotiche1. Fin dai primi studi che visualizzavano il rilascio di EV da batteri gram-negativi2, il numero di funzioni biologiche attribuite alle EV batteriche (20-300 nm di diametro) è cresciuto costantemente negli ultimi decenni. Le loro funzioni includono il trasferimento della resistenza agli antibiotici3, la formazione di biofilm4, il quorum sensing5 e il rilascio di tossine6. C’è anche un crescente interesse per l’uso di EV batteriche come terapie, specialmente in vaccinologia7 e terapia del cancro8.
Nonostante il crescente interesse per la ricerca sui veicoli elettrici, ci sono ancora sfide tecniche per quanto riguarda i metodi di isolamento. In particolare, vi è la necessità di metodi di isolamento che siano riproducibili, scalabili e compatibili con diversi organismi produttori di veicoli elettrici. Per creare un insieme unificato di principi per la pianificazione e la segnalazione dei metodi di isolamento e ricerca dei veicoli elettrici, l’International Society for Extracellular Vesicles pubblica e aggiorna il documento di posizione MISEV9. Inoltre, il consorzio EV-TRACK fornisce una piattaforma aperta per la segnalazione di metodologie dettagliate per l’isolamento dei veicoli elettrici utilizzate nei manoscritti pubblicati per migliorare la trasparenza10.
In questo protocollo, le precedenti metodologie utilizzate per l’isolamento di EV da colture cellulari di mammifero sono state adattate11,12 per consentire l’isolamento di EV da colture cellulari batteriche. Abbiamo cercato di impiegare metodi che consentano l’isolamento dei veicoli elettrici da una varietà di microbi, che possono essere scalabili, e bilanciare la purezza e la resa dei veicoli elettrici (come discusso nel documento di posizione MISEV9). Dopo aver rimosso cellule batteriche e detriti mediante centrifugazione e filtrazione, il terreno di coltura viene concentrato mediante ultrafiltrazione del dispositivo centrifugo (per un volume fino a ~ 100 ml) o TFF azionato da pompa (per volumi maggiori). I veicoli elettrici vengono quindi isolati dalla SEC utilizzando colonne ottimizzate per la purificazione di piccoli veicoli elettrici.
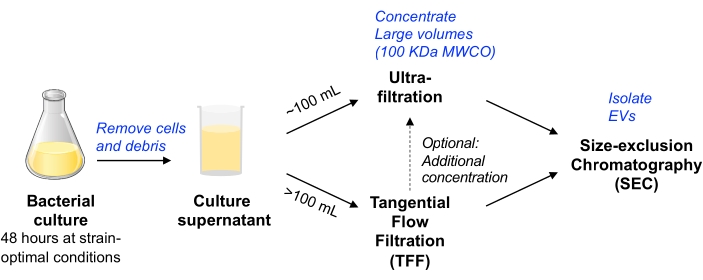
Figura 1: Panoramica schematica del flusso di lavoro di isolamento EV batterico. Abbreviazioni: EV = vescicola extracellulare; TFF = filtrazione tangenziale a flusso; SEC = cromatografia ad esclusione dimensionale; MWCO = cut-off del peso molecolare. Fare clic qui per visualizzare una versione ingrandita di questa figura.
Un ceppo commensale di topo di Escherichia coli (cioè E. coli MP113) è stato utilizzato come organismo modello e modificato per esprimere nanoluciferasi associata a EV mediante fusione alla citolisina A, come precedentemente riportato14. I metodi utilizzati qui possono elaborare almeno fino a diversi litri di colture batteriche e separare efficacemente le proteine associate a EV da quelle non associate a EV. Infine, questo metodo può essere utilizzato anche per altre specie batteriche gram-positive e gram-negative. Tutti i dati rilevanti degli esperimenti riportati sono stati inviati alla knowledge base EV-TRACK (EV-TRACK ID: EV210211)10.
Protocol
Representative Results
Discussion
Nel protocollo di cui sopra, viene descritto un metodo scalabile e che isola in modo affidabile le EV da vari batteri gram-negativi / positivi e aerobici / anaerobici. Ha diversi potenziali punti di arresto durante la procedura, anche se è meglio evitare di impiegare più di 48 ore per isolare gli EV dai terreni di coltura batterica condizionati.
In primo luogo, consiste nel coltivare batteri per generare terreno di coltura batterica condizionato. È stato riscontrato che aumentare il tempo d…
Declarações
The authors have nothing to disclose.
Acknowledgements
La ricerca sopra descritta è stata supportata dalla borsa di formazione NIH TL1 TR002549-03. Ringraziamo i dottori John C. Tilton e Zachary Troyer (Case Western Reserve University) per aver facilitato l’accesso allo strumento analizzatore di dimensioni delle particelle; Lew Brown (Spectradyne) per l’assistenza tecnica nell’analisi dei dati di distribuzione granulometrica; Dr. David Putnam presso la Cornell University per aver fornito pClyA-GFP plasmide14; e il Dr. Mark Goulian dell’Università della Pennsylvania per averci fornito l’E. coli MP113.
Materials
| 0.5 mL flat cap, thin-walled PCR tubes | Thermo Scientific | 3430 | it is important to use thin-walled PCR tubes to obtain accurate readings with Qubit |
| 16% Paraformaldehyde (formaldehyde) aqueous solution | Electron microscopy sciences | 15700 | |
| 250 mL Fiberlite polypropylene centrifuge bottles | ThermoFisher | 010-1495 | |
| 500 mL Fiberlite polypropylene centrifuge bottles | ThermoFisher | 010-1493 | |
| 65 mm Polypropylene Round-Bottom/Conical Bottle Adapter | Beckman Coulter | 392077 | Allows Vivacell to fit in rotor |
| Akkermansia mucinophila | ATCC | BAA-835 | |
| Amicon-15 (100 kDa MWCO) | MilliporeSigma | UFC910024 | |
| Avanti J-20 XPI centrifuge | Beckman Coulter | No longer sold by Beckman. Avanti J-26XP is closest contemporary model. | |
| Bacteroides thetaiotaomicron VPI 5482 | ATCC | 29148 | |
| Bifidobacterium breve | NCIMB | B8807 | |
| Bifidobacterium dentium | ATCC | 27678 | |
| Brain Heart infusion (BHI) broth | Himedia | M2101 | After autoclaving, Both BHI broth and agar were introduced into the anaerobic chamber, supplemented with Menadione (1 µg/L), hematin (1.2 µg/L), and L-Cysteine Hydrochloride (0.05%). They were then incubated for at least 24 h under anaerobic conditions before inoculation with the anaerobic bacterial strains. |
| C-300 microfluidics cartridge | Spectradyne | ||
| Chloramphenicol | MP Biomedicals | ICN19032105 | |
| Escherichia coli HST08 (Steller competent cells) | Takara | 636763 | |
| Escherichia coli MP1 | Dr. Mark Goulian (gift) | commensal bacteria derived from mouse gut | |
| Fiberlite 500 mL to 250 mL adapter | ThermoFisher | 010-0151-05 | used with Fiberlite rotor to enable 250 mL bottles to be used for smaller size of starting bacterial culture |
| Fiberlite fixed-angle centrifuge rotor | ThermoFisher | F12-6×500-LEX | fits 6 x 500 mL bottles |
| Formvar Carbon Film 400 Mesh, Copper | Electron microscopy sciences | FCF-400-CU | |
| Glutaraldehyde (EM-grade, 10% aqeous solution) | Electron microscopy sciences | 16100 | |
| Hematin | ChemCruz | 207729B | Stock solution was made in 0.2 M L-histidine solution as 1.2 mg/mL |
| Infinite M Nano+ Microplate reader | Tecan | This equibment was used to measure the mCherry fluorescence | |
| In-Fusion HD Cloning Plus | Takara | 638909 | For cloning of the PCR fragements into the PCR-lineraized vectors |
| JS-5.3 AllSpin Swinging-Bucket Rotor | Beckman Coulter | 368690 | |
| Lauria Bertani (LB) broth, Miller | Difco | 244620 | |
| L-Cysteine Hydrochloride | J.T. Baker | 2071-05 | It should be weighed and added directly to the autoclaved BHI media inside the anaerobic chamber |
| Masterflex Fitting, Polypropylene, Straight, Female Luer to Hose Barb Adapter, 1/8" ID; 25/PK | cole-parmer – special | HV-30800-08 | connection adapters for filtration tubing circuit |
| Masterflex Fitting, Polypropylene, Straight, Male Luer to Hose Barb Adapter, 1/8" ID; 25/PK | cole-parmer – special | HV-30800-24 | connection adapters for filtration tubing circuit |
| Masterflex L/S Analog Variable-Speed Console Drive, 20 to 600 rpm | Masterflex | HV-07555-00 | |
| Masterflex L/S Easy-Load Head for Precision Tubing, 4-Roller, PARA Housing, SS Rotor | Masterflex | EW-07514-10 | |
| Masterflex L/S Precision Pump Tubing, PharmaPure, L/S 16; 25 ft | Cole Palmer | EW-06435-16 | low-binding/low-leaching tubing |
| Menadione (Vitamin K3) | MP | 102259 | Stock solution was made in ethanol as 1 mg/mL |
| MIDIKROS 41.5CM 100K MPES 0.5MM FLL X FLL 1/PK | Repligen | D04-E100-05-N | TFF device we have used to filter up to 2 L of E. coli culture supernatant |
| Nano-Glo Luciferase Assay System | Promega | N1110 | This assay kit was used to measure the luminescence of the nluc reporter protein |
| NanoLuc (Nluc) Luciferase Antibody, clone 965808 | R&D Systems | MAB10026 | |
| nCS1 microfluidics resistive pulse sensing instrument | Spectradyne | ||
| nCS1 Viewer | Spectradyne | Analysis software for particle size distribution | |
| OneTaq 2x Master Mix with Standard Buffer | NEB | M0482 | DNA polymerase master mix used to perform the routine PCR reactions for colony checking |
| Protein LoBind, 2.0 mL, PCR clean tubes | Eppendorf | 30108450 | |
| Q5 High-Fidelity 2x Master Mix | NEB | M0492 | DNA polymerase master mix used to perform the PCR reactions needed for cloning |
| qEV original, 35 nm | Izon | maximal loading volume of 0.5 mL | |
| qEV rack | Izon | for use with the qEV-original SEC columns | |
| qEV-2, 35 nm | Izon | maximal loading volume of 2 mL | |
| Qubit fluorometer | ThermoFisher | Item no longer available. Closest available product is Qubit 4.0 Fluorometer (cat. No. Q33238) | |
| Qubit protein assay kit | ThermoFisher | Q33211 | Store kit at room temperature. Standards are stored at 4 °C. |
| Sorvall Lynx 4000 centrifuge | ThermoFisher | 75006580 | |
| SpectraMax i3x Microplate reader | Molecular Devices | This equipment was used to measure the nanoluciferase bioluminescence | |
| Stericup Quick-release-GP Sterile Vacuum Filtration system (150, 250, or 500 mL) | MilliporeSigma | S2GPU01RE S2GPU02RE S2GPU05RE |
One or multiple filters can be used to accommodate working volumes. In our experience, you can filter twice the volume listed on the product size. |
| Uranyl acetate | Electron microscopy sciences | 22400 | |
| Vinyl anaerobic chamber | Coy Lab | ||
| Vivacell 100, 100,000 MWCO PES | Sartorius | VC1042 | |
| Whatman Anotop 10 Plus syringe filters (0.02 micron) | MilliporeSigma | WHA68093002 | to filter MRPS diluent |
Referências
- Yanez-Mo, M., et al. Biological properties of extracellular vesicles and their physiological functions. Journal of Extracellular Vesicles. 4, 27066 (2015).
- Chatterjee, S. N., Das, J. Electron microscopic observations on the excretion of cell-wall material by Vibrio cholerae. Journal of General Microbiology. 49 (1), 1-11 (1967).
- Ciofu, O., Beveridge, T. J., Kadurugamuwa, J., Walther-Rasmussen, J., Hoiby, N. Chromosomal beta-lactamase is packaged into membrane vesicles and secreted from Pseudomonas aeruginosa. Journal of Antimicrobial Chemotherapy. 45 (1), 9-13 (2000).
- Yonezawa, H., et al. Outer membrane vesicles of Helicobacter pylori TK1402 are involved in biofilm formation. BMC Microbiology. 9, 197 (2009).
- Mashburn, L. M., Whiteley, M. Membrane vesicles traffic signals and facilitate group activities in a prokaryote. Nature. 437 (7057), 422-425 (2005).
- Kato, S., Kowashi, Y., Demuth, D. R. Outer membrane-like vesicles secreted by Actinobacillus actinomycetemcomitans are enriched in leukotoxin. Microbial Pathogenesis. 32 (1), 1-13 (2002).
- Petousis-Harris, H., et al. Effectiveness of a group B outer membrane vesicle meningococcal vaccine against gonorrhoea in New Zealand: a retrospective case-control study. Lancet. 390 (10102), 1603-1610 (2017).
- Kim, O. Y., et al. Bacterial outer membrane vesicles suppress tumor by interferon-gamma-mediated antitumor response. Nature Communications. 8 (1), 626 (2017).
- Thery, C., et al. Minimal information for studies of extracellular vesicles 2018 (MISEV2018): a position statement of the International Society for Extracellular Vesicles and update of the MISEV2014 guidelines. Journal of Extracellular Vesicles. 7 (1), 1535750 (2018).
- Consortium, E. -. T., et al. EV-TRACK: transparent reporting and centralizing knowledge in extracellular vesicle research. Nature Methods. 14 (3), 228-232 (2017).
- Watson, D. C., et al. Efficient production and enhanced tumor delivery of engineered extracellular vesicles. Biomaterials. 105, 195-205 (2016).
- Watson, D. C., et al. Scalable, cGMP-compatible purification of extracellular vesicles carrying bioactive human heterodimeric IL-15/lactadherin complexes. Journal of Extracellular Vesicles. 7 (1), 1442088 (2018).
- Lasaro, M., et al. Escherichia coli isolate for studying colonization of the mouse intestine and its application to two-component signaling knockouts. Journal of Bacteriology. 196 (9), 1723-1732 (2014).
- Kim, J. Y., et al. Engineered bacterial outer membrane vesicles with enhanced functionality. Journal of Molecular Biology. 380 (1), 51-66 (2008).
- Beveridge, T. J. Structures of gram-negative cell walls and their derived membrane vesicles. Journal of Bacteriology. 181 (16), 4725-4733 (1999).
- Reimer, S. L., et al. Comparative analysis of outer membrane vesicle isolation methods with an Escherichia coli tolA mutant reveals a hypervesiculating phenotype with outer-inner membrane vesicle content. Frontiers in Microbiology. 12, 628801 (2021).

