Масштабируемое выделение и очистка внеклеточных везикул от кишечной палочки и других бактерий
Summary
Бактерии выделяют внеклеточные везикулы (EV) нанометрового размера, несущие биологические молекулы. Исследования ЭЛЕКТРОМОБИЛей сосредоточены на понимании их биогенеза, роли во взаимодействиях микроб-микроб и микроб-хозяин и болезни, а также их потенциальных терапевтических применений. Представлен рабочий процесс для масштабируемой изоляции электромобилей от различных бактерий для облегчения стандартизации исследований электромобилей.
Abstract
Различные виды бактерий выделяют ~ 20-300 нм внеклеточные везикулы (EV), состоящие из липидов, белков, нуклеиновых кислот, гликанов и других молекул, полученных из родительских клеток. EV функционируют как внутри- и межвидовые коммуникационные векторы, а также способствуют взаимодействию между бактериями и организмами-хозяевами в контексте инфекции и колонизации. Учитывая множество функций, приписываемых ev в здоровье и болезнях, растет интерес к выделению EV для исследований in vitro и in vivo . Было выдвинуто предположение, что разделение электромобилей на основе физических свойств, а именно размера, облегчит выделение везикул из различных бактериальных культур.
Рабочий процесс изоляции состоит из центрифугирования, фильтрации, ультрафильтрации и хроматографии с исключением размера (SEC) для выделения EV из бактериальных культур. Для повышения масштабируемости была включена стадия тангенциальной фильтрации потока (TFF), управляемая насосом, что позволило отделить материал от литров стартовой клеточной культуры. Escherichia coli использовалась в качестве модельной системы, экспрессирующей EV-ассоциированную нанолюциферазу и не-EV-ассоциированную mCherry в качестве репортерных белков. Нанолюцифераза была нацелена на EV путем слияния ее N-конца с цитолизином A. Ранние фракции хроматографии, содержащие 20-100 нм EV с ассоциированным цитолизином А – наноЛюк, отличались от более поздних фракций, содержащих свободные белки. Наличие EV-ассоциированной нанолюциферазы было подтверждено иммунозолотой маркировкой и просвечивающей электронной микроскопией. Этот рабочий процесс изоляции ЭЛЕКТРОМОБИЛей применим к другим человеческим кишечно-ассоциированным грамотрицательным и грамположительным видам бактерий. В заключение, сочетание центрифугирования, фильтрации, ультрафильтрации / TFF и SEC обеспечивает масштабируемую изоляцию электромобилей от различных видов бактерий. Использование стандартизированного рабочего процесса изоляции облегчит сравнительные исследования микробных ЭЛЕКТРОМОБИЛей между видами.
Introduction
Внеклеточные везикулы (EV) представляют собой нанометровые липосомоподобные структуры, состоящие из липидов, белков, гликанов и нуклеиновых кислот, секретируемых как прокариотическими, так и эукариотическими клетками1. Начиная с ранних исследований, визуализирующих высвобождение EV из грамотрицательных бактерий2, количество биологических функций, приписываемых бактериальным EV (20-300 нм в диаметре), постоянно растет в последние десятилетия. Их функции включают перенос устойчивости к антибиотикам3, образование биопленки4, ощущение кворума5 и доставку токсинов6. Растет также интерес к использованию бактериальных EV в качестве терапевтических средств, особенно в вакцинологии7 и терапии рака8.
Несмотря на растущий интерес к исследованиям электромобилей, все еще существуют технические проблемы, связанные с методами изоляции. В частности, существует потребность в методах изоляции, которые являются воспроизводимыми, масштабируемыми и совместимыми с различными организмами, производящими электромобили. Чтобы создать единый набор принципов для планирования и отчетности по изоляции ЭЛЕКТРОМОБИЛей и методам исследования, Международное общество внеклеточных везикул публикует и обновляет позиционный документMISEV 9. Кроме того, консорциум EV-TRACK предоставляет открытую платформу для представления подробных методологий изоляции электромобилей, используемых в опубликованных рукописях для повышения прозрачности10.
В этом протоколе предыдущие методологии, используемые для выделения EV из культуры клеток млекопитающих, были адаптированы11,12, чтобы обеспечить выделение EV из бактериальной клеточной культуры. Мы стремились использовать методы, которые позволяют изолировать EV от различных микробов, которые могут быть масштабируемыми, и сбалансировать чистоту и выход EV (как обсуждалось в позиционном документеMISEV 9). После удаления бактериальных клеток и мусора центрифугированием и фильтрацией питательную среду концентрируют либо ультрафильтрацией центробежного устройства (для объема до ~100 мл), либо насосным ТФФ (для больших объемов). Затем электромобили изолируются SEC с помощью столбцов, оптимизированных для очистки небольших электромобилей.
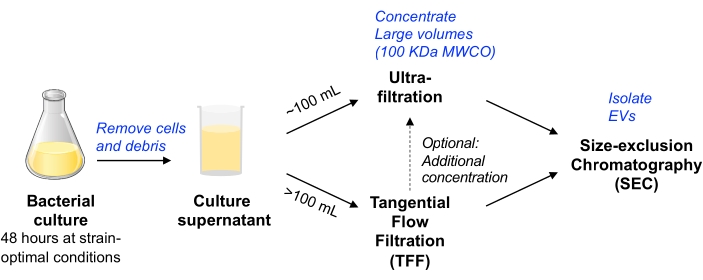
Рисунок 1: Обзор схемы рабочего процесса изоляции бактериальных электромобилей. Сокращения: EV = внеклеточный везикул; TFF = тангенциальная фильтрация потока; SEC = размерная эксклюзионная хроматография; MWCO = отсечка молекулярной массы. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
Мышино-комменсальный штамм Escherichia coli (т.е. E. coli MP113) использовали в качестве модельного организма и модифицировали для экспрессии EV-ассоциированной нанолюциферазы путем слияния с цитолизином А, как сообщалось ранее14. Методы, используемые здесь, могут обрабатывать, по крайней мере, до нескольких литров бактериальных культур и эффективно отделять EV-ассоциированные от не-EV-ассоциированных белков. Наконец, этот метод также может быть использован для других грамположительных и грамотрицательных видов бактерий. Все соответствующие данные представленных экспериментов были представлены в базу знаний EV-TRACK (EV-TRACK ID: EV210211)10.
Protocol
Representative Results
Discussion
В протоколе выше описан способ, который является масштабируемым и надежно изолирует EV от различных грамотрицательных/положительных и аэробных/анаэробных бактерий. Он имеет несколько потенциальных остановочных точек на протяжении всей процедуры, хотя лучше избегать использования бо?…
Declarações
The authors have nothing to disclose.
Acknowledgements
Исследование, описанное выше, было поддержано учебным грантом NIH TL1 TR002549-03. Мы благодарим докторов Джона К. Тилтона и Закари Тройера (Case Western Reserve University) за облегчение доступа к прибору для анализа размера частиц; Лью Браун (Spectradyne) за техническую помощь в анализе данных о распределении частиц по размерам; д-р Дэвид Патнэм из Корнелльского университета за предоставление плазмиды pClyA-GFP14; и д-р Марк Гулиан из Университета Пенсильвании за предоставление нам E. coli MP113.
Materials
| 0.5 mL flat cap, thin-walled PCR tubes | Thermo Scientific | 3430 | it is important to use thin-walled PCR tubes to obtain accurate readings with Qubit |
| 16% Paraformaldehyde (formaldehyde) aqueous solution | Electron microscopy sciences | 15700 | |
| 250 mL Fiberlite polypropylene centrifuge bottles | ThermoFisher | 010-1495 | |
| 500 mL Fiberlite polypropylene centrifuge bottles | ThermoFisher | 010-1493 | |
| 65 mm Polypropylene Round-Bottom/Conical Bottle Adapter | Beckman Coulter | 392077 | Allows Vivacell to fit in rotor |
| Akkermansia mucinophila | ATCC | BAA-835 | |
| Amicon-15 (100 kDa MWCO) | MilliporeSigma | UFC910024 | |
| Avanti J-20 XPI centrifuge | Beckman Coulter | No longer sold by Beckman. Avanti J-26XP is closest contemporary model. | |
| Bacteroides thetaiotaomicron VPI 5482 | ATCC | 29148 | |
| Bifidobacterium breve | NCIMB | B8807 | |
| Bifidobacterium dentium | ATCC | 27678 | |
| Brain Heart infusion (BHI) broth | Himedia | M2101 | After autoclaving, Both BHI broth and agar were introduced into the anaerobic chamber, supplemented with Menadione (1 µg/L), hematin (1.2 µg/L), and L-Cysteine Hydrochloride (0.05%). They were then incubated for at least 24 h under anaerobic conditions before inoculation with the anaerobic bacterial strains. |
| C-300 microfluidics cartridge | Spectradyne | ||
| Chloramphenicol | MP Biomedicals | ICN19032105 | |
| Escherichia coli HST08 (Steller competent cells) | Takara | 636763 | |
| Escherichia coli MP1 | Dr. Mark Goulian (gift) | commensal bacteria derived from mouse gut | |
| Fiberlite 500 mL to 250 mL adapter | ThermoFisher | 010-0151-05 | used with Fiberlite rotor to enable 250 mL bottles to be used for smaller size of starting bacterial culture |
| Fiberlite fixed-angle centrifuge rotor | ThermoFisher | F12-6×500-LEX | fits 6 x 500 mL bottles |
| Formvar Carbon Film 400 Mesh, Copper | Electron microscopy sciences | FCF-400-CU | |
| Glutaraldehyde (EM-grade, 10% aqeous solution) | Electron microscopy sciences | 16100 | |
| Hematin | ChemCruz | 207729B | Stock solution was made in 0.2 M L-histidine solution as 1.2 mg/mL |
| Infinite M Nano+ Microplate reader | Tecan | This equibment was used to measure the mCherry fluorescence | |
| In-Fusion HD Cloning Plus | Takara | 638909 | For cloning of the PCR fragements into the PCR-lineraized vectors |
| JS-5.3 AllSpin Swinging-Bucket Rotor | Beckman Coulter | 368690 | |
| Lauria Bertani (LB) broth, Miller | Difco | 244620 | |
| L-Cysteine Hydrochloride | J.T. Baker | 2071-05 | It should be weighed and added directly to the autoclaved BHI media inside the anaerobic chamber |
| Masterflex Fitting, Polypropylene, Straight, Female Luer to Hose Barb Adapter, 1/8" ID; 25/PK | cole-parmer – special | HV-30800-08 | connection adapters for filtration tubing circuit |
| Masterflex Fitting, Polypropylene, Straight, Male Luer to Hose Barb Adapter, 1/8" ID; 25/PK | cole-parmer – special | HV-30800-24 | connection adapters for filtration tubing circuit |
| Masterflex L/S Analog Variable-Speed Console Drive, 20 to 600 rpm | Masterflex | HV-07555-00 | |
| Masterflex L/S Easy-Load Head for Precision Tubing, 4-Roller, PARA Housing, SS Rotor | Masterflex | EW-07514-10 | |
| Masterflex L/S Precision Pump Tubing, PharmaPure, L/S 16; 25 ft | Cole Palmer | EW-06435-16 | low-binding/low-leaching tubing |
| Menadione (Vitamin K3) | MP | 102259 | Stock solution was made in ethanol as 1 mg/mL |
| MIDIKROS 41.5CM 100K MPES 0.5MM FLL X FLL 1/PK | Repligen | D04-E100-05-N | TFF device we have used to filter up to 2 L of E. coli culture supernatant |
| Nano-Glo Luciferase Assay System | Promega | N1110 | This assay kit was used to measure the luminescence of the nluc reporter protein |
| NanoLuc (Nluc) Luciferase Antibody, clone 965808 | R&D Systems | MAB10026 | |
| nCS1 microfluidics resistive pulse sensing instrument | Spectradyne | ||
| nCS1 Viewer | Spectradyne | Analysis software for particle size distribution | |
| OneTaq 2x Master Mix with Standard Buffer | NEB | M0482 | DNA polymerase master mix used to perform the routine PCR reactions for colony checking |
| Protein LoBind, 2.0 mL, PCR clean tubes | Eppendorf | 30108450 | |
| Q5 High-Fidelity 2x Master Mix | NEB | M0492 | DNA polymerase master mix used to perform the PCR reactions needed for cloning |
| qEV original, 35 nm | Izon | maximal loading volume of 0.5 mL | |
| qEV rack | Izon | for use with the qEV-original SEC columns | |
| qEV-2, 35 nm | Izon | maximal loading volume of 2 mL | |
| Qubit fluorometer | ThermoFisher | Item no longer available. Closest available product is Qubit 4.0 Fluorometer (cat. No. Q33238) | |
| Qubit protein assay kit | ThermoFisher | Q33211 | Store kit at room temperature. Standards are stored at 4 °C. |
| Sorvall Lynx 4000 centrifuge | ThermoFisher | 75006580 | |
| SpectraMax i3x Microplate reader | Molecular Devices | This equipment was used to measure the nanoluciferase bioluminescence | |
| Stericup Quick-release-GP Sterile Vacuum Filtration system (150, 250, or 500 mL) | MilliporeSigma | S2GPU01RE S2GPU02RE S2GPU05RE |
One or multiple filters can be used to accommodate working volumes. In our experience, you can filter twice the volume listed on the product size. |
| Uranyl acetate | Electron microscopy sciences | 22400 | |
| Vinyl anaerobic chamber | Coy Lab | ||
| Vivacell 100, 100,000 MWCO PES | Sartorius | VC1042 | |
| Whatman Anotop 10 Plus syringe filters (0.02 micron) | MilliporeSigma | WHA68093002 | to filter MRPS diluent |
Referências
- Yanez-Mo, M., et al. Biological properties of extracellular vesicles and their physiological functions. Journal of Extracellular Vesicles. 4, 27066 (2015).
- Chatterjee, S. N., Das, J. Electron microscopic observations on the excretion of cell-wall material by Vibrio cholerae. Journal of General Microbiology. 49 (1), 1-11 (1967).
- Ciofu, O., Beveridge, T. J., Kadurugamuwa, J., Walther-Rasmussen, J., Hoiby, N. Chromosomal beta-lactamase is packaged into membrane vesicles and secreted from Pseudomonas aeruginosa. Journal of Antimicrobial Chemotherapy. 45 (1), 9-13 (2000).
- Yonezawa, H., et al. Outer membrane vesicles of Helicobacter pylori TK1402 are involved in biofilm formation. BMC Microbiology. 9, 197 (2009).
- Mashburn, L. M., Whiteley, M. Membrane vesicles traffic signals and facilitate group activities in a prokaryote. Nature. 437 (7057), 422-425 (2005).
- Kato, S., Kowashi, Y., Demuth, D. R. Outer membrane-like vesicles secreted by Actinobacillus actinomycetemcomitans are enriched in leukotoxin. Microbial Pathogenesis. 32 (1), 1-13 (2002).
- Petousis-Harris, H., et al. Effectiveness of a group B outer membrane vesicle meningococcal vaccine against gonorrhoea in New Zealand: a retrospective case-control study. Lancet. 390 (10102), 1603-1610 (2017).
- Kim, O. Y., et al. Bacterial outer membrane vesicles suppress tumor by interferon-gamma-mediated antitumor response. Nature Communications. 8 (1), 626 (2017).
- Thery, C., et al. Minimal information for studies of extracellular vesicles 2018 (MISEV2018): a position statement of the International Society for Extracellular Vesicles and update of the MISEV2014 guidelines. Journal of Extracellular Vesicles. 7 (1), 1535750 (2018).
- Consortium, E. -. T., et al. EV-TRACK: transparent reporting and centralizing knowledge in extracellular vesicle research. Nature Methods. 14 (3), 228-232 (2017).
- Watson, D. C., et al. Efficient production and enhanced tumor delivery of engineered extracellular vesicles. Biomaterials. 105, 195-205 (2016).
- Watson, D. C., et al. Scalable, cGMP-compatible purification of extracellular vesicles carrying bioactive human heterodimeric IL-15/lactadherin complexes. Journal of Extracellular Vesicles. 7 (1), 1442088 (2018).
- Lasaro, M., et al. Escherichia coli isolate for studying colonization of the mouse intestine and its application to two-component signaling knockouts. Journal of Bacteriology. 196 (9), 1723-1732 (2014).
- Kim, J. Y., et al. Engineered bacterial outer membrane vesicles with enhanced functionality. Journal of Molecular Biology. 380 (1), 51-66 (2008).
- Beveridge, T. J. Structures of gram-negative cell walls and their derived membrane vesicles. Journal of Bacteriology. 181 (16), 4725-4733 (1999).
- Reimer, S. L., et al. Comparative analysis of outer membrane vesicle isolation methods with an Escherichia coli tolA mutant reveals a hypervesiculating phenotype with outer-inner membrane vesicle content. Frontiers in Microbiology. 12, 628801 (2021).

