تصنيع واستخدام سقالات الجينات الجافة الكبيرة المسامية للنقل الفيروسي للخلايا التائية
Summary
فيما يلي بروتوكول لإنشاء سقالات ألجينات جافة كبيرة المسام تتوسط في نقل الجينات الفيروسية الفعالة لاستخدامها في الهندسة الوراثية للخلايا التائية ، بما في ذلك الخلايا التائية للعلاج بالخلايا التائية ذات مستقبلات المستضدات الوهمية. تبين أن السقالات تقوم بتحويل الخلايا التائية الأولية المنشطة بنسبة >85٪.
Abstract
أصبحت الهندسة الوراثية للخلايا التائية للعلاج بالخلايا التائية ذات مستقبلات المستضدات الوهمية في طليعة علاج السرطان على مدى السنوات القليلة الماضية. يتم إنتاج الخلايا التائية ذات مستقبلات المستضدات الوهمية عن طريق نقل الجينات الفيروسية إلى الخلايا التائية. يتضمن المعيار الذهبي الحالي لنقل الجينات الفيروسية تدوير الصفائح المغلفة بالريترونيكتين ، وهو أمر مكلف ويستغرق وقتا طويلا. هناك حاجة كبيرة لطرق فعالة وفعالة من حيث التكلفة لتوليد الخلايا التائية ذات مستقبلات المستضدات الوهمية. الموصوفة هنا هي طريقة لتصنيع سقالات ألجينات غير مكلفة وجافة كبيرة المسام ، والمعروفة باسم سقالات Drydux ، والتي تعزز بكفاءة النقل الفيروسي للخلايا التائية المنشطة. تم تصميم السقالات لاستخدامها بدلا من الدوران القياسي الذهبي للصفائح المطلية بالريترونيكتين المزروعة بالفيروس وتبسيط عملية تحويل الخلايا. يتم ربط الجينات مع الكالسيوم-D-gluconate وتجميدها طوال الليل لإنشاء السقالات. يتم تجفيف السقالات المجمدة بالتجميد في مجفف بالتجميد لمدة 72 ساعة لإكمال تكوين السقالات الجافة التي يسهل اختراقها. تتوسط السقالات في نقل الجينات الفيروسية عندما يتم زرع الفيروس والخلايا التائية المنشطة معا فوق السقالة لإنتاج خلايا معدلة وراثيا. تنتج السقالات >85٪ من نقل الخلايا التائية الأولية ، وهو ما يمكن مقارنته بكفاءة نقل الدوران على الألواح المطلية بالريترونيكتين. توضح هذه النتائج أن سقالات الجينات الجافة التي يسهل اختراقها تعمل كبديل أرخص وأكثر ملاءمة لطريقة النقل التقليدية.
Introduction
برز العلاج المناعي كنموذج ثوري لعلاج السرطان نظرا لقدرته على استهداف الأورام على وجه التحديد ، والحد من السمية الخلوية خارج الهدف ، ومنع الانتكاس. على وجه الخصوص ، اكتسب العلاج بالخلايا الخيمرية لمستقبلات المستضد T (CAR-T) شعبية بسبب نجاحه في علاج الأورام اللمفاوية وسرطان الدم. وافقت إدارة الغذاء والدواء الأمريكية على أول علاج بالخلايا التائية ذات مستقبلات المستضدات الوهمية في عام 2017 ، ومنذ ذلك الحين ، وافقت على أربعة علاجات أخرى للخلايا التائية ذات مستقبلات المستضدات الوهمية1،2،3،4،5. تحتوي CARs على مجال التعرف على المستضد يتكون عادة من جزء متغير سلسلة واحدة من جسم مضاد وحيد النسيلة خاص بمستضدمرتبط بالورم 3,4. عندما يتفاعل CAR مع المستضد المرتبط بالورم ، يتم تنشيط الخلايا التائية CAR-T ، مما يؤدي إلى استجابة مضادة للأورام تتضمن إطلاق السيتوكين ، وتحلل الخلايا ، وتعبير عامل النسخ ، وتكاثر الخلايا التائية. لإنتاج الخلايا التائية ذات مستقبلات المستضدات الوهمية ، يتم جمع الدم من المريض للحصول على الخلايا التائية. تضاف مستقبلات المستضدات الخيمرية وراثيا إلى الخلايا التائية للمريض باستخدام فيروس. تزرع الخلايا التائية ذات مستقبلات المستضدات الوهمية في المختبر وتغرس مرة أخرى في المريض2،3،4،6. يتم تحديد التوليد الناجح للخلايا التائية ذات مستقبلات المستضدات الوهمية من خلال كفاءة النقل ، والتي تصف عدد الخلايا التائية المعدلة وراثيا إلى خلايا تائية ذات مستقبلات المستضدات الوهمية.
حاليا ، المعيار الذهبي لتوليد الخلايا التائية ذات مستقبلات المستضدات الوهمية هو دوران الخلايا التائية المنشطة والفيروس على الألواح المطلية بالريترونيكتين 7,8. يبدأ النقل عندما تتفاعل الجسيمات الفيروسية مع سطح الخلايا التائية. يعزز Retronectin التمركز المشترك للفيروس والخلايا عن طريق زيادة كفاءة الربط بين الجسيمات الفيروسية والخلايا ، مما يعزز النقل 7,8. لا يعمل Retronectin بشكل جيد من تلقاء نفسه ويحتاج إلى أن يكون مصحوبا بالدوران ، مما يعزز نقل الجينات عن طريق تركيز الجسيمات الفيروسية وزيادة نفاذية سطح الخلية التائية ، مما يسمح بعدوى فيروسية أسهل8. على الرغم من نجاح الدوران على الألواح المطلية بالريترونيكتين ، إلا أنها عملية معقدة تتطلب دورات دوران متعددة وكواشف باهظة الثمن. لذلك ، فإن الطرق البديلة لنقل الجينات الفيروسية الأسرع والأرخص مرغوبة للغاية.
الجينات هي عديد السكاريد الأنيوني الطبيعي المستخدم على نطاق واسع في الصناعة الطبية الحيوية نظرا لتكلفتها المنخفضة ، وملف السلامة الجيد ، والقدرة على تكوين الهلاميات المائية عند الاختلاط مع الكاتيونات ثنائية التكافؤ9،10،11،12. الجينات عبارة عن بوليمر متوافق مع GMP ومعترف به عموما على أنه آمن (GRAS) من قبل إدارة الغذاء والدواءالأمريكية 13. يؤدي ربط الجينات مع الكاتيونات إلى إنشاء هلاميات مائية مستقرة تستخدم غالبا في التئام الجروح ، وتوصيل الأدوية والبروتينات الكيميائية الصغيرة ، ونقل الخلايا9،10،11،12،14،15،16. نظرا لخصائص التبلور الممتازة ، فإن الجينات هي المادة المفضلة لإنشاء سقالات مسامية عن طريق التجفيف بالتجميد10,17. هذه الخصائص للجينات تجعلها مرشحا جذابا لإنتاج سقالة يمكنها التوسط في نقل الجينات الفيروسية للخلايا المنشطة.
يوصف هنا بروتوكول لصنع سقالات الجينات الجافة الكبيرة التي يسهل اختراقها ، والمعروفة باسم سقالات Drydux ، والتي تنقل الخلايا التائية بشكل ثابت عن طريق نقل الجينات الفيروسية17,18. يوضح الشكل 1 عملية صنع هذه السقالات. هذه السقالات تلغي الحاجة إلى تدوير الألواح المطلية بالريترونيكتين. تشجع سقالات الجينات الكبيرة التي يسهل اختراقها تفاعل الجسيمات الفيروسية والخلايا التائية لتمكين نقل الجينات بكفاءة في خطوة واحدة دون التأثير على وظائف وصلاحية الخلايا التائية المهندسة17. عند اتباعها بشكل صحيح ، تتمتع سقالات الجينات الكبيرة التي يسهل اختراقها بكفاءة نقل لا تقل عن 80٪ ، مما يبسط ويقصر عملية النقل الفيروسي.
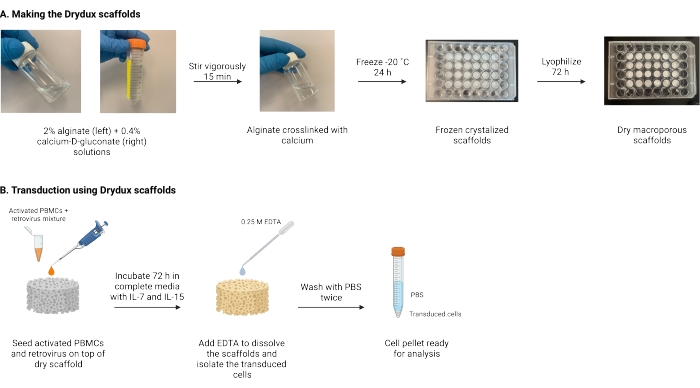
الشكل 1: التخطيطي والجدول الزمني للبروتوكول . (أ) الجدول الزمني لصنع سقالات الألجينات الجافة التي يسهل اختراقها. يرتبط الجينات مع الكالسيوم-D-غلوكونات ويتم تجميده بين عشية وضحاها. يتم تجفيف السقالات المجمدة بالتجميد لمدة 72 ساعة لإنشاء سقالات Drydux. ب: الجدول الزمني لنقل الخلايا المنشطة عبر الفيروس. يتم زرع الخلايا المنشطة والفيروسات (MOI 2) فوق السقالة ويتم تحضينها في وسائط كاملة مكملة ب IL-7 و IL-15. تمتص السقالات الخليط وتعزز نقل الجينات الفيروسية. يستخدم EDTA لإذابة السقالات وعزل الخلايا المحولة. بعد الغسيل مرتين باستخدام PBS ، يمكن استخدام حبيبات الخلية للتحليل. الاختصارات: PBS = محلول ملحي مخزن بالفوسفات ؛ PBMCs = خلايا الدم أحادية النواة المحيطية. الرجاء الضغط هنا لعرض نسخة أكبر من هذا الشكل.
Protocol
Representative Results
Discussion
يستمر العلاج بالخلايا التائية ذات مستقبلات المستضدات الوهمية في اكتساب الاهتمام لكل من التطبيقات البحثية والتجارية. على الرغم من النجاح الذي حققه العلاج بالخلايا التائية ذات مستقبلات المستضدات الوهمية في علاج سرطانات الدم، فإن التكلفة العالية للإجراء تحد من استخدامه. يقدم البروتوكول ا…
Declarações
The authors have nothing to disclose.
Acknowledgements
تم دعم هذا العمل من قبل المعاهد الوطنية للصحة من خلال أرقام منح المنح R37-CA260223 و R21CA246414. نشكر نواة قياس التدفق الخلوي NCSU على التدريب والتوجيه بشأن تحليل قياس التدفق الخلوي. تم إنشاء المخططات باستخدام Biorender.com
Materials
| 0.5 M EDTA | Invitrogen | 15575-038 | UltraPure, pH 8.0 |
| 1x DPBS | Gibco | 14190-144 | No calcium chloride or magnesium chloride |
| 3% Acetic Acid with Methylene Blue | Stemcell Technologies Inc | 07060 | |
| Activated Periphreal Blood Mononuclear Cells | – | – | Fresh or frozen |
| Calcium-D-Gluconate | Alfa Aesar | A11649 | |
| CD28.2 Antibody | BD | 555725 | 1 mg/mL |
| CD3 Antibody | Miltenyi | 130-093-387 | 100 μg/mL |
| Click's Media | FUJIFILM IRVINE SCIENTIFIC MS | 9195 | |
| DI Water | – | – | |
| Glutamax | Gibco | 35-050-061 | |
| HyClone FBS | Cytvia | SH3039603 | |
| HyClone RPMI 1640 Media | Cytvia | SH3009601 | |
| Penicillin-streptomycin (P/S) | Gibco | 15-140-122 | |
| Peripheral Blood Mononuclear Cells | – | – | Fresh or frozen |
| PRONOVA UP MVG | NovaMatrix | 4200101 | Sodium alginate |
| Recombinant Human IL-15 | Peprotech | 200-15 | 5 ng/mL |
| Recombinant Human IL-7 | Peprotech | 200-07 | 10 ng/mL |
| Retrovirus | – | – | 1 x 106 TU/mL |
Referências
- Prinzing, B. L., Gottschalk, S. M., Krenciute, G. C. A. R. T-cell therapy for glioblastoma: ready for the next round of clinical testing. Expert Review of Anticancer Therapy. 18 (5), 451-461 (2018).
- Bagley, S. J., Desai, A. S., Linette, G. P., June, C. H., O’Rourke, D. M. CAR T-cell therapy for glioblastoma: recent clinical advances and future challenges. Neuro-oncology. 20 (11), 1429-1438 (2018).
- Nair, R., Westin, J. CAR T cells. Advances in Experimental Medicine and Biology. 1342, 297-317 (2021).
- Jackson, H. J., Rafiq, S., Brentjens, R. J. Driving CAR T-cells forward. Nature Reviews. Clinical Oncology. 13 (6), 370-383 (2016).
- Sterner, R. C., Sterner, R. M. CAR-T cell therapy: current limitations and potential strategies. Blood Cancer Journal. 11 (4), 69 (2021).
- Miliotou, A. N., Papadopoulou, L. C. CAR T-cell therapy: A new era in cancer immunotherapy. Current Pharmaceutical Biotechnology. 19 (1), 5-18 (2018).
- Lee, H. -. J., et al. Retronectin enhances lentivirus-mediated gene delivery into hematopoietic progenitor cells. Biologicals: Journal of the International Association of Biological Standardization. 37 (4), 203-209 (2009).
- Rajabzadeh, A., Hamidieh, A. A., Rahbarizadeh, F. Spinoculation and retronectin highly enhance the gene transduction efficiency of Mucin-1-specific chimeric antigen receptor (CAR) in human primary T cells. BMC Molecular and Cell Biology. 22 (1), 57 (2021).
- Sun, J., Tan, H. Alginate-based biomaterials for regenerative medicine applications. Materials. 6 (4), 1285-1309 (2013).
- Nayak, A. K., Mohanta, B. C., Hasnain, M. S., Hoda, M. N., Tripathi, G. Chapter 14 – Alginate-based scaffolds for drug delivery in tissue engineering. Alginates in Drug Delivery. , 359-386 (2020).
- Lee, K. Y., Mooney, D. J. Alginate: properties and biomedical applications. Progress in Polymer Science. 37 (1), 106-126 (2012).
- Kuo, C. K., Ma, P. X. Ionically crosslinked alginate hydrogels as scaffolds for tissue engineering: part 1. Structure, gelation rate and mechanical properties. Biomaterials. 22 (6), 511-521 (2001).
- Soccol, C., et al. Probiotic nondairy beverages. Handbook of Plant-Based Fermented Food and Beverage Technology, Second Edition. , 707-728 (2012).
- Moody, C. T., et al. Restoring carboxylates on highly modified alginates improves gelation, tissue retention and systemic capture. Acta Biomaterialia. 138, 208-217 (2022).
- Brudno, Y., et al. Replenishable drug depot to combat post-resection cancer recurrence. Biomaterials. 178, 373-382 (2018).
- Moody, C. T., Palvai, S., Brudno, Y. Click cross-linking improves retention and targeting of refillable alginate depots. Acta Biomaterialia. 112, 112-121 (2020).
- Agarwalla, P., et al. Scaffold-mediated static transduction of T Cells for CAR-T Cell therapy. Advanced Healthcare Materials. 9 (14), 2000275 (2020).
- Agarwalla, P., et al. Bioinstructive implantable scaffolds for rapid in vivo manufacture and release of CAR-T cells. Nature Biotechnology. 40 (8), 1250-1258 (2022).
- Vera, J., et al. T lymphocytes redirected against the kappa light chain of human immunoglobulin efficiently kill mature B lymphocyte-derived malignant cells. Blood. 108 (12), 3890-3897 (2006).
- . PRONOVA UP MVG. IFF Nutrition Norge AS Available from: https://novamatrix.biz/store/pronova-up-mvg/ (2022)
- Zappasodi, R., Budhu, S., Abu-Akeel, M., Merghoub, T. In vitro assays for effector T cell functions and activity of immunomodulatory antibodies. Methods in Enzymology. 631, 43-59 (2020).
- Kong, B. S., Lee, C., Cho, Y. M. Protocol for the assessment of human T cell activation by real-time metabolic flux analysis. STAR Protocols. 3 (1), 101084 (2022).
- Bio-Rad cell activation protocols. Bio-Rad Available from: https://www.bio-rad-antibodies.com/cell-activation.html?JSESSIONID_STERLING=D6E538F76818E53C29884D6CC7334F24 (2022)
- Lin, H. -. R., Yeh, Y. -. J. Porous alginate/hydroxyapatite composite scaffolds for bone tissue engineering: Preparation, characterization, andin vitro studies. Journal of Biomedical Materials Research. 71 (1), 52-65 (2004).
- Wu, J., Zhao, Q., Sun, J., Zhou, Q. Preparation of poly(ethylene glycol) aligned porous cryogels using a unidirectional freezing technique. Soft Matter. 8 (13), 3620 (2012).

