ייצור ושימוש בפיגומי אלגינט מקרו-נקבוביים יבשים להתמרה נגיפית של תאי T
Summary
להלן פרוטוקול ליצירת פיגומי אלגינט מקרו-נקבוביים יבשים המתווכים העברת גנים נגיפית יעילה לשימוש בהנדסה גנטית של תאי T, כולל תאי T לטיפול בתאי CAR-T. הודגם כי הפיגומים מתמרים תאי T ראשוניים פעילים עם התמרה של >85%.
Abstract
הנדסה גנטית של תאי T לטיפול בתאי CAR-T הגיעה לחזית הטיפול בסרטן בשנים האחרונות. תאי CAR-T מיוצרים על ידי העברת גנים נגיפיים לתאי T. תקן הזהב הנוכחי של העברת גנים ויראליים כרוך בספינוקולציה של צלחות מצופות רטרונקטין, שהיא יקרה וגוזלת זמן. קיים צורך משמעותי בשיטות יעילות וחסכוניות ליצירת תאי CAR-T. מתוארת כאן שיטה לייצור פיגומי אלגינט מקרו-נקבוביים זולים ויבשים, המכונים פיגומי Drylux, המקדמים ביעילות התמרה נגיפית של תאי T פעילים. הפיגומים מתוכננים לשימוש במקום ספינוקולציה בתקן זהב של צלחות מצופות רטרונקטין שנזרעו בנגיף ולפשט את תהליך התמרת התאים. אלגינט מקושר באופן צולב עם סידן-D-גלוקונאט וקפוא למשך הלילה ליצירת הפיגומים. הפיגומים הקפואים מיובשים בהקפאה בליאופיליזר למשך 72 שעות כדי להשלים את היווצרות הפיגומים המקרו-נקבוביים היבשים. הפיגומים מתווכים העברת גנים נגיפית כאשר נגיפים ותאי T מופעלים נזרעים יחד על גבי הפיגום כדי לייצר תאים מהונדסים גנטית. הפיגומים מייצרים >85% התמרה של תאי T ראשוניים, הדומה ליעילות ההתמרה של ספינוקולציה על לוחות מצופים רטרונקטין. תוצאות אלה מראות כי פיגומי אלגינט מקרו-נקבוביים יבשים משמשים חלופה זולה ונוחה יותר לשיטת ההתמרות הקונבנציונלית.
Introduction
אימונותרפיה התגלתה כפרדיגמה מהפכנית לטיפול בסרטן בשל יכולתה להתמקד ספציפית בגידולים, להגביל ציטוטוקסיות מחוץ למטרה ולמנוע הישנות. במיוחד, טיפול בתאי קולטן אנטיגן כימרי T (CAR-T) צבר פופולריות בשל הצלחתו בטיפול בלימפומות ולוקמיה. ה-FDA אישר את הטיפול הראשון בתאי CAR-T בשנת 2017, ומאז אישר ארבעה טיפולים נוספים בתאי CAR-T 1,2,3,4,5. ל- CARs יש תחום זיהוי אנטיגן המורכב בדרך כלל מקטע משתנה שרשרת יחיד של נוגדן חד שבטי שהוא ספציפי לאנטיגןהקשור לגידול 3,4. כאשר CAR מקיים אינטראקציה עם האנטיגן הקשור לגידול שלו, תאי CAR-T מופעלים, מה שמוביל לתגובה אנטי-סרטנית הכוללת שחרור ציטוקינים, דה-גרנולציה ציטוליטית, ביטוי גורם שעתוק והתפשטות תאי T. כדי לייצר תאי CAR-T, הדם נאסף מהחולה כדי לקבל את תאי ה- T שלהם. CARs מתווספים גנטית לתאי T של המטופל באמצעות וירוס. תאי CAR-T גדלים במבחנה ומוחדרים בחזרה לחולה 2,3,4,6. ייצור מוצלח של תאי CAR-T נקבע על ידי יעילות ההתמרת, המתארת את מספר תאי ה-T המהונדסים גנטית לתאי CAR-T.
נכון לעכשיו, תקן הזהב לייצור תאי CAR-T הוא ספינוקולציה של תאי T מופעלים ונגיפים על לוחות מצופים רטרונקטין 7,8. ההתמרה מתחילה כאשר חלקיקים נגיפיים מתקשרים עם פני השטח של תאי T. רטרונקטין מקדם קולוקליזציה של נגיף ותאים על ידי הגברת יעילות הקשירה בין חלקיקי הנגיף לתאים, מה שמשפר את הטרנסדוקציה 7,8. רטרונקטין אינו פועל היטב בפני עצמו וצריך להיות מלווה בספינוקולציה, המשפרת את העברת הגנים על ידי ריכוז החלקיקים הנגיפיים והגדלת חדירות פני השטח של תא T, מה שמאפשר זיהום נגיפי קל יותר8. למרות ההצלחה של ספינוקולציה על לוחות מצופים רטרונקטין, זהו תהליך מורכב הדורש מחזורי ספין מרובים וריאגנטים יקרים. לכן, שיטות חלופיות להעברת גנים ויראליים מהירים וזולים יותר רצויות מאוד.
אלגינט הוא רב-סוכר אניוני טבעי הנמצא בשימוש נרחב בתעשייה הביו-רפואית בשל עלותו הנמוכה, פרופיל הבטיחות הטוב ויכולתו ליצור הידרוג’לים בעת ערבוב עם קטיונים דיוולנטיים 9,10,11,12. אלגינט הוא פולימר תואם GMP ובדרך כלל מוכר כבטוח (GRAS) על ידי ה-FDA13. קישור צולב של אלגינט עם קטיונים יוצר הידרוג’לים יציבים המשמשים לעתים קרובות לריפוי פצעים, העברת תרופות כימיות קטנות וחלבונים, והובלת תאים 9,10,11,12,14,15,16. בשל תכונות הג’ל המצוינות שלו, אלגינט הוא החומר המועדף ליצירת פיגומים נקבוביים על ידיייבוש בהקפאה של 10,17. מאפיינים אלה של אלגינט הופכים אותו למועמד אטרקטיבי לייצור פיגום שיכול לתווך העברת גנים נגיפית של תאים פעילים.
הפרוטוקול המתואר כאן הוא פרוטוקול לייצור פיגומי אלגינט מקרו-נקבוביים יבשים, המכונים פיגומי Drylux, המתמרים באופן סטטי תאי T על ידי העברת גנים נגיפיים17,18. תהליך ייצור הפיגומים האלה מוצג באיור 1. פיגומים אלה מבטלים את הצורך בספינוקולציה של לוחות מצופים רטרונקטין. פיגומי האלגינט המקרו-נקבוביים מעודדים אינטראקציה של חלקיקים נגיפיים ותאי T כדי לאפשר העברת גנים יעילה בשלב אחד מבלי להשפיע על הפונקציונליות והכדאיות של תאי T מהונדסים17. כאשר עוקבים אחריהם נכון, פיגומי אלגינט מקרו-נקבוביים אלה הם בעלי יעילות התמרה של לפחות 80%, מה שמפשט ומקצר את תהליך ההתמרה הנגיפית.
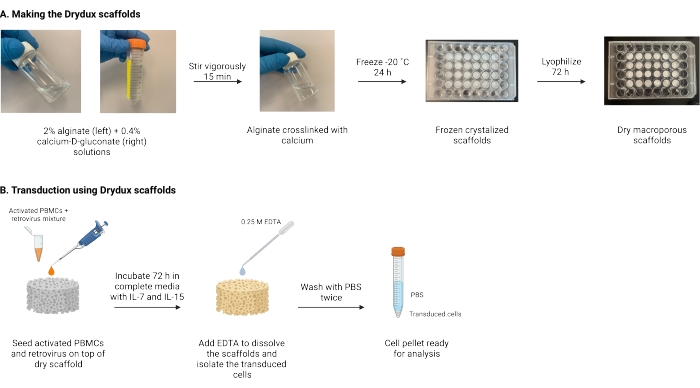
איור 1: סכימה וציר זמן של הפרוטוקול . (A) ציר הזמן להכנת פיגומי אלגינט מקרו-נקבוביים יבשים. אלגינט מקושר באופן צולב עם סידן-D-גלוקונאט וקפוא למשך הלילה. הפיגומים הקפואים עוברים ליופיליזציה למשך 72 שעות כדי ליצור את פיגומי Drydox. (B) ציר הזמן להתמרה נגיפית של תאים פעילים. תאים פעילים ונגיפים (MOI 2) נזרעים על גבי הפיגום ודוגרים במדיה מלאה בתוספת IL-7 ו- IL-15. הפיגומים סופגים את התערובת ומקדמים העברת גנים נגיפית. EDTA משמש להמסת הפיגומים ולבידוד התאים המתמרים. לאחר שטיפה פעמיים עם PBS, כדור התא יכול לשמש לניתוח. קיצורים: PBS = מלח עם מאגר פוספטים; PBMCs = תאי דם חד-גרעיניים היקפיים. אנא לחץ כאן כדי להציג גרסה גדולה יותר של נתון זה.
Protocol
Representative Results
Discussion
טיפול בתאי CAR-T ממשיך לצבור עניין הן ביישומים מחקריים והן ביישומים מסחריים. למרות ההצלחה שיש לטיפול בתאי CAR-T בטיפול בסרטן הדם, העלות הגבוהה של ההליך מגבילה את השימוש בו. הפרוטוקול המוצג כאן מציג שיטה חדשה להעברת גנים נגיפיים של תאי T ללא צורך בספינוקולציה של צלחות מצופות רטרונקטין. ייצור פיג…
Declarações
The authors have nothing to disclose.
Acknowledgements
עבודה זו נתמכה על ידי המכונים הלאומיים לבריאות באמצעות מספרי פרס מענק R37-CA260223, R21CA246414. אנו מודים לליבת הציטומטריה של זרימה NCSU על הדרכה והדרכה בניתוח ציטומטריה של זרימה. סכמות נוצרו עם Biorender.com
Materials
| 0.5 M EDTA | Invitrogen | 15575-038 | UltraPure, pH 8.0 |
| 1x DPBS | Gibco | 14190-144 | No calcium chloride or magnesium chloride |
| 3% Acetic Acid with Methylene Blue | Stemcell Technologies Inc | 07060 | |
| Activated Periphreal Blood Mononuclear Cells | – | – | Fresh or frozen |
| Calcium-D-Gluconate | Alfa Aesar | A11649 | |
| CD28.2 Antibody | BD | 555725 | 1 mg/mL |
| CD3 Antibody | Miltenyi | 130-093-387 | 100 μg/mL |
| Click's Media | FUJIFILM IRVINE SCIENTIFIC MS | 9195 | |
| DI Water | – | – | |
| Glutamax | Gibco | 35-050-061 | |
| HyClone FBS | Cytvia | SH3039603 | |
| HyClone RPMI 1640 Media | Cytvia | SH3009601 | |
| Penicillin-streptomycin (P/S) | Gibco | 15-140-122 | |
| Peripheral Blood Mononuclear Cells | – | – | Fresh or frozen |
| PRONOVA UP MVG | NovaMatrix | 4200101 | Sodium alginate |
| Recombinant Human IL-15 | Peprotech | 200-15 | 5 ng/mL |
| Recombinant Human IL-7 | Peprotech | 200-07 | 10 ng/mL |
| Retrovirus | – | – | 1 x 106 TU/mL |
Referências
- Prinzing, B. L., Gottschalk, S. M., Krenciute, G. C. A. R. T-cell therapy for glioblastoma: ready for the next round of clinical testing. Expert Review of Anticancer Therapy. 18 (5), 451-461 (2018).
- Bagley, S. J., Desai, A. S., Linette, G. P., June, C. H., O’Rourke, D. M. CAR T-cell therapy for glioblastoma: recent clinical advances and future challenges. Neuro-oncology. 20 (11), 1429-1438 (2018).
- Nair, R., Westin, J. CAR T cells. Advances in Experimental Medicine and Biology. 1342, 297-317 (2021).
- Jackson, H. J., Rafiq, S., Brentjens, R. J. Driving CAR T-cells forward. Nature Reviews. Clinical Oncology. 13 (6), 370-383 (2016).
- Sterner, R. C., Sterner, R. M. CAR-T cell therapy: current limitations and potential strategies. Blood Cancer Journal. 11 (4), 69 (2021).
- Miliotou, A. N., Papadopoulou, L. C. CAR T-cell therapy: A new era in cancer immunotherapy. Current Pharmaceutical Biotechnology. 19 (1), 5-18 (2018).
- Lee, H. -. J., et al. Retronectin enhances lentivirus-mediated gene delivery into hematopoietic progenitor cells. Biologicals: Journal of the International Association of Biological Standardization. 37 (4), 203-209 (2009).
- Rajabzadeh, A., Hamidieh, A. A., Rahbarizadeh, F. Spinoculation and retronectin highly enhance the gene transduction efficiency of Mucin-1-specific chimeric antigen receptor (CAR) in human primary T cells. BMC Molecular and Cell Biology. 22 (1), 57 (2021).
- Sun, J., Tan, H. Alginate-based biomaterials for regenerative medicine applications. Materials. 6 (4), 1285-1309 (2013).
- Nayak, A. K., Mohanta, B. C., Hasnain, M. S., Hoda, M. N., Tripathi, G. Chapter 14 – Alginate-based scaffolds for drug delivery in tissue engineering. Alginates in Drug Delivery. , 359-386 (2020).
- Lee, K. Y., Mooney, D. J. Alginate: properties and biomedical applications. Progress in Polymer Science. 37 (1), 106-126 (2012).
- Kuo, C. K., Ma, P. X. Ionically crosslinked alginate hydrogels as scaffolds for tissue engineering: part 1. Structure, gelation rate and mechanical properties. Biomaterials. 22 (6), 511-521 (2001).
- Soccol, C., et al. Probiotic nondairy beverages. Handbook of Plant-Based Fermented Food and Beverage Technology, Second Edition. , 707-728 (2012).
- Moody, C. T., et al. Restoring carboxylates on highly modified alginates improves gelation, tissue retention and systemic capture. Acta Biomaterialia. 138, 208-217 (2022).
- Brudno, Y., et al. Replenishable drug depot to combat post-resection cancer recurrence. Biomaterials. 178, 373-382 (2018).
- Moody, C. T., Palvai, S., Brudno, Y. Click cross-linking improves retention and targeting of refillable alginate depots. Acta Biomaterialia. 112, 112-121 (2020).
- Agarwalla, P., et al. Scaffold-mediated static transduction of T Cells for CAR-T Cell therapy. Advanced Healthcare Materials. 9 (14), 2000275 (2020).
- Agarwalla, P., et al. Bioinstructive implantable scaffolds for rapid in vivo manufacture and release of CAR-T cells. Nature Biotechnology. 40 (8), 1250-1258 (2022).
- Vera, J., et al. T lymphocytes redirected against the kappa light chain of human immunoglobulin efficiently kill mature B lymphocyte-derived malignant cells. Blood. 108 (12), 3890-3897 (2006).
- . PRONOVA UP MVG. IFF Nutrition Norge AS Available from: https://novamatrix.biz/store/pronova-up-mvg/ (2022)
- Zappasodi, R., Budhu, S., Abu-Akeel, M., Merghoub, T. In vitro assays for effector T cell functions and activity of immunomodulatory antibodies. Methods in Enzymology. 631, 43-59 (2020).
- Kong, B. S., Lee, C., Cho, Y. M. Protocol for the assessment of human T cell activation by real-time metabolic flux analysis. STAR Protocols. 3 (1), 101084 (2022).
- Bio-Rad cell activation protocols. Bio-Rad Available from: https://www.bio-rad-antibodies.com/cell-activation.html?JSESSIONID_STERLING=D6E538F76818E53C29884D6CC7334F24 (2022)
- Lin, H. -. R., Yeh, Y. -. J. Porous alginate/hydroxyapatite composite scaffolds for bone tissue engineering: Preparation, characterization, andin vitro studies. Journal of Biomedical Materials Research. 71 (1), 52-65 (2004).
- Wu, J., Zhao, Q., Sun, J., Zhou, Q. Preparation of poly(ethylene glycol) aligned porous cryogels using a unidirectional freezing technique. Soft Matter. 8 (13), 3620 (2012).

