T細胞のウイルス形質導入のための乾燥マクロポーラスアルギン酸スキャフォールドの作製と利用
Summary
本明細書は、CAR-T細胞療法のためのT細胞を含むT細胞の遺伝子工学において使用するための効率的なウイルス遺伝子導入を媒介する乾燥マクロポーラスアルギン酸スキャフォールドを作成するためのプロトコルである。足場は、活性化された初代T細胞を>85%の形質導入で形質導入することが示された。
Abstract
CAR-T細胞治療のためのT細胞の遺伝子工学は、ここ数年で癌治療の最前線に来ています。CAR-T細胞は、T細胞へのウイルス遺伝子導入によって産生される。ウイルス遺伝子導入の現在のゴールドスタンダードは、レトロネクチンコーティングプレートのスピンオキュレーションを含み、これは高価で時間がかかります。CAR-T細胞を生成するための効率的で費用効果の高い方法に対する大きなニーズがあります。ここで説明するのは、活性化T細胞のウイルス形質導入を効率的に促進する、Dryduxスキャフォールドとして知られる安価で乾燥したマクロポーラスアルギン酸スキャフォールドを製造する方法です。足場は、ウイルスを播種したレトロネクチンコーティングプレートのゴールドスタンダードのスピンオキュレーションの代わりに使用するように設計されており、細胞を形質導入するプロセスを簡素化します。アルギン酸塩はカルシウム-D-グルコン酸塩と架橋され、一晩凍結して足場を作ります。凍結した足場を凍結乾燥機で72時間凍結乾燥して、乾燥したマクロポーラス足場の形成を完了します。足場は、ウイルスと活性化T細胞が足場の上に一緒に播種されて遺伝子組み換え細胞を生成するときに、ウイルス遺伝子導入を仲介します。足場は>85%の初代T細胞形質導入を生成し、これはレトロネクチンコーティングプレート上のスピンノキュレーションの形質導入効率に匹敵します。これらの結果は、乾燥マクロポーラスアルギン酸スキャフォールドが従来の形質導入法に代わる安価で便利な代替手段として機能することを示しています。
Introduction
免疫療法は、腫瘍を特異的に標的とし、オフターゲット細胞毒性を制限し、再発を防ぐ能力により、革新的な癌治療パラダイムとして浮上しています。特に、キメラ抗原受容体T(CAR-T)細胞療法は、リンパ腫や白血病の治療に成功したことで人気を博しています。FDAは2017年に最初のCAR-T細胞療法を承認し、それ以来、さらに4つのCAR-T細胞療法を承認しました1,2,3,4,5。CARは、通常、腫瘍関連抗原3,4に特異的であるモノクローナル抗体の一本鎖可変断片からなる抗原認識ドメインを有する。CARが腫瘍関連抗原と相互作用すると、CAR-T細胞が活性化され、サイトカイン放出、細胞溶解性脱顆粒、転写因子発現、およびT細胞増殖を含む抗腫瘍応答を引き起こします。CAR-T細胞を産生するために、患者から血液を採取してT細胞を得る。CARは、ウイルスを使用して患者のT細胞に遺伝的に追加されます。CAR-T細胞はインビトロで増殖し、患者に注入されます2、3、4、6。CAR-T細胞の生成の成功は、CAR-T細胞に遺伝子改変されたT細胞の数を記述する形質導入効率によって決定される。
現在、CAR-T細胞生成のゴールドスタンダードは、レトロネクチンコーティングプレート上での活性化T細胞およびウイルスのスピンオキュレーションである7,8。形質導入は、ウイルス粒子がT細胞の表面と係合するときに始まります。レトロネクチンは、ウイルス粒子と細胞との間の結合効率を高めることによってウイルスと細胞の共局在を促進し、形質導入を増強する7,8。レトロネクチンはそれ自体ではうまく機能せず、ウイルス粒子を濃縮し、T細胞の表面透過性を高めることによって遺伝子導入を促進する脊髄分泌を伴う必要があり、ウイルス感染を容易にします8。レトロネクチンコーティングプレートでのスピンオキュレーションの成功にもかかわらず、それは複数のスピンサイクルと高価な試薬を必要とする複雑なプロセスです。したがって、より迅速かつ安価なウイルス遺伝子導入のための代替方法が非常に望ましい。
アルギン酸塩は、その低コスト、優れた安全性プロファイル、および二価カチオンとの混合時にヒドロゲルを形成する能力のために、生物医学産業で広く使用されている天然アニオン性多糖類です9,10,11,12。アルギン酸塩はGMP準拠のポリマーであり、FDA13によって一般的に安全(GRAS)として認められています。アルギン酸塩を陽イオンと架橋すると、創傷治癒、少量の化学薬品やタンパク質の送達、および細胞輸送によく使用される安定したヒドロゲルが作成されます9、10、11、12、14、15、16。その優れたゲル化特性のために、アルギン酸塩は凍結乾燥によって多孔質足場を作成するための好ましい材料である10,17。アルギン酸塩のこれらの特性は、活性化細胞のウイルス遺伝子導入を媒介することができる足場を製造するための魅力的な候補となる。
ここで説明するのは、ウイルス遺伝子導入によってT細胞を静的に形質導入する、Drydux足場として知られる乾燥マクロポーラスアルギン酸足場を作製するためのプロトコルである17,18。これらの足場を作成するプロセスを図 1 に示します。これらの足場は、レトロネクチンコーティングプレートの脊髄分泌の必要性を排除します。マクロポーラスアルギン酸スキャフォールドは、ウイルス粒子とT細胞の相互作用を促進し、操作されたT細胞の機能および生存率に影響を与えることなく、単一ステップで効率的な遺伝子導入を可能にする17。正しく従えば、これらのマクロポーラスアルギン酸塩足場は、少なくとも80%の形質導入効率を有し、ウイルス形質導入プロセスを単純化および短縮する。
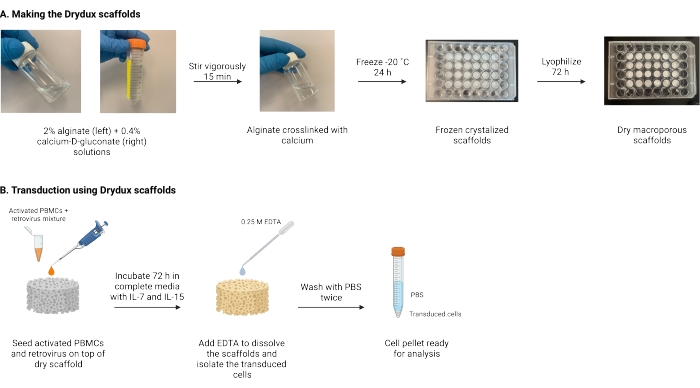
図1:プロトコルの概略図とタイムライン 。 (A)乾燥マクロポーラスアルギン酸塩足場を作製するためのタイムライン。アルギン酸塩はカルシウム-D-グルコン酸塩と架橋され、一晩凍結されます。凍結した足場を72時間凍結乾燥して、Drydux足場を作ります。(B)活性化細胞のウイルス形質導入のタイムライン。活性化細胞およびウイルス(MOI 2)を足場の上に播種し、IL-7およびIL-15を添加した完全培地中でインキュベートする。足場は混合物を吸収し、ウイルス遺伝子導入を促進します。EDTAは、足場を溶解し、形質導入された細胞を単離するために使用されます。PBSで2回洗浄した後、細胞ペレットを分析に使用できます。略語:PBS =リン酸緩衝生理食塩水;PBMC =末梢血単核細胞。 この図の拡大版を表示するには、ここをクリックしてください。
Protocol
Representative Results
Discussion
CAR-T細胞療法は、研究と商業的応用の両方で関心を集め続けています。CAR-T細胞療法が血液がんの治療に成功しているにもかかわらず、この手順の高コストはその使用を制限しています。ここで紹介するプロトコルは、レトロネクチンコーティングプレートの脊髄分泌を必要とせずにT細胞のウイルス遺伝子導入のための新しい方法を紹介します。形質導入を媒介する乾燥マクロポーラスアル?…
Declarações
The authors have nothing to disclose.
Acknowledgements
この研究は、助成金番号R37-CA260223、R21CA246414を通じて国立衛生研究所によってサポートされました。フローサイトメトリー分析に関するトレーニングとガイダンスを提供してくれたNCSUフローサイトメトリーコアに感謝します。回路図は Biorender.com で作成されました
Materials
| 0.5 M EDTA | Invitrogen | 15575-038 | UltraPure, pH 8.0 |
| 1x DPBS | Gibco | 14190-144 | No calcium chloride or magnesium chloride |
| 3% Acetic Acid with Methylene Blue | Stemcell Technologies Inc | 07060 | |
| Activated Periphreal Blood Mononuclear Cells | – | – | Fresh or frozen |
| Calcium-D-Gluconate | Alfa Aesar | A11649 | |
| CD28.2 Antibody | BD | 555725 | 1 mg/mL |
| CD3 Antibody | Miltenyi | 130-093-387 | 100 μg/mL |
| Click's Media | FUJIFILM IRVINE SCIENTIFIC MS | 9195 | |
| DI Water | – | – | |
| Glutamax | Gibco | 35-050-061 | |
| HyClone FBS | Cytvia | SH3039603 | |
| HyClone RPMI 1640 Media | Cytvia | SH3009601 | |
| Penicillin-streptomycin (P/S) | Gibco | 15-140-122 | |
| Peripheral Blood Mononuclear Cells | – | – | Fresh or frozen |
| PRONOVA UP MVG | NovaMatrix | 4200101 | Sodium alginate |
| Recombinant Human IL-15 | Peprotech | 200-15 | 5 ng/mL |
| Recombinant Human IL-7 | Peprotech | 200-07 | 10 ng/mL |
| Retrovirus | – | – | 1 x 106 TU/mL |
Referências
- Prinzing, B. L., Gottschalk, S. M., Krenciute, G. C. A. R. T-cell therapy for glioblastoma: ready for the next round of clinical testing. Expert Review of Anticancer Therapy. 18 (5), 451-461 (2018).
- Bagley, S. J., Desai, A. S., Linette, G. P., June, C. H., O’Rourke, D. M. CAR T-cell therapy for glioblastoma: recent clinical advances and future challenges. Neuro-oncology. 20 (11), 1429-1438 (2018).
- Nair, R., Westin, J. CAR T cells. Advances in Experimental Medicine and Biology. 1342, 297-317 (2021).
- Jackson, H. J., Rafiq, S., Brentjens, R. J. Driving CAR T-cells forward. Nature Reviews. Clinical Oncology. 13 (6), 370-383 (2016).
- Sterner, R. C., Sterner, R. M. CAR-T cell therapy: current limitations and potential strategies. Blood Cancer Journal. 11 (4), 69 (2021).
- Miliotou, A. N., Papadopoulou, L. C. CAR T-cell therapy: A new era in cancer immunotherapy. Current Pharmaceutical Biotechnology. 19 (1), 5-18 (2018).
- Lee, H. -. J., et al. Retronectin enhances lentivirus-mediated gene delivery into hematopoietic progenitor cells. Biologicals: Journal of the International Association of Biological Standardization. 37 (4), 203-209 (2009).
- Rajabzadeh, A., Hamidieh, A. A., Rahbarizadeh, F. Spinoculation and retronectin highly enhance the gene transduction efficiency of Mucin-1-specific chimeric antigen receptor (CAR) in human primary T cells. BMC Molecular and Cell Biology. 22 (1), 57 (2021).
- Sun, J., Tan, H. Alginate-based biomaterials for regenerative medicine applications. Materials. 6 (4), 1285-1309 (2013).
- Nayak, A. K., Mohanta, B. C., Hasnain, M. S., Hoda, M. N., Tripathi, G. Chapter 14 – Alginate-based scaffolds for drug delivery in tissue engineering. Alginates in Drug Delivery. , 359-386 (2020).
- Lee, K. Y., Mooney, D. J. Alginate: properties and biomedical applications. Progress in Polymer Science. 37 (1), 106-126 (2012).
- Kuo, C. K., Ma, P. X. Ionically crosslinked alginate hydrogels as scaffolds for tissue engineering: part 1. Structure, gelation rate and mechanical properties. Biomaterials. 22 (6), 511-521 (2001).
- Soccol, C., et al. Probiotic nondairy beverages. Handbook of Plant-Based Fermented Food and Beverage Technology, Second Edition. , 707-728 (2012).
- Moody, C. T., et al. Restoring carboxylates on highly modified alginates improves gelation, tissue retention and systemic capture. Acta Biomaterialia. 138, 208-217 (2022).
- Brudno, Y., et al. Replenishable drug depot to combat post-resection cancer recurrence. Biomaterials. 178, 373-382 (2018).
- Moody, C. T., Palvai, S., Brudno, Y. Click cross-linking improves retention and targeting of refillable alginate depots. Acta Biomaterialia. 112, 112-121 (2020).
- Agarwalla, P., et al. Scaffold-mediated static transduction of T Cells for CAR-T Cell therapy. Advanced Healthcare Materials. 9 (14), 2000275 (2020).
- Agarwalla, P., et al. Bioinstructive implantable scaffolds for rapid in vivo manufacture and release of CAR-T cells. Nature Biotechnology. 40 (8), 1250-1258 (2022).
- Vera, J., et al. T lymphocytes redirected against the kappa light chain of human immunoglobulin efficiently kill mature B lymphocyte-derived malignant cells. Blood. 108 (12), 3890-3897 (2006).
- . PRONOVA UP MVG. IFF Nutrition Norge AS Available from: https://novamatrix.biz/store/pronova-up-mvg/ (2022)
- Zappasodi, R., Budhu, S., Abu-Akeel, M., Merghoub, T. In vitro assays for effector T cell functions and activity of immunomodulatory antibodies. Methods in Enzymology. 631, 43-59 (2020).
- Kong, B. S., Lee, C., Cho, Y. M. Protocol for the assessment of human T cell activation by real-time metabolic flux analysis. STAR Protocols. 3 (1), 101084 (2022).
- Bio-Rad cell activation protocols. Bio-Rad Available from: https://www.bio-rad-antibodies.com/cell-activation.html?JSESSIONID_STERLING=D6E538F76818E53C29884D6CC7334F24 (2022)
- Lin, H. -. R., Yeh, Y. -. J. Porous alginate/hydroxyapatite composite scaffolds for bone tissue engineering: Preparation, characterization, andin vitro studies. Journal of Biomedical Materials Research. 71 (1), 52-65 (2004).
- Wu, J., Zhao, Q., Sun, J., Zhou, Q. Preparation of poly(ethylene glycol) aligned porous cryogels using a unidirectional freezing technique. Soft Matter. 8 (13), 3620 (2012).

