Herstellung und Verwendung von trockenen makroporösen Alginatgerüsten für die virale Transduktion von T-Zellen
Summary
Hierin ist ein Protokoll zur Herstellung trockener makroporöser Alginatgerüste, die einen effizienten viralen Gentransfer für den Einsatz in der Gentechnik von T-Zellen, einschließlich T-Zellen für die CAR-T-Zelltherapie, vermitteln. Es wurde gezeigt, dass die Gerüste aktivierte primäre T-Zellen mit >85% Transduktion transduzieren.
Abstract
Die Gentechnik von T-Zellen für die CAR-T-Zelltherapie ist in den letzten Jahren in den Vordergrund der Krebsbehandlung gerückt. CAR-T-Zellen werden durch viralen Gentransfer in T-Zellen hergestellt. Der derzeitige Goldstandard des viralen Gentransfers beinhaltet die Spinokulation von retronektinbeschichteten Platten, was teuer und zeitaufwendig ist. Es besteht ein erheblicher Bedarf an effizienten und kostengünstigen Methoden zur Erzeugung von CAR-T-Zellen. Hier wird ein Verfahren zur Herstellung kostengünstiger, trockener makroporöser Alginatgerüste, bekannt als Drydux-Gerüste, beschrieben, die die virale Transduktion aktivierter T-Zellen effizient fördern. Die Gerüste sind so konzipiert, dass sie anstelle der Goldstandard-Spinokulation von retronektinbeschichteten Platten, die mit Viren besät sind, verwendet werden und den Prozess zur Übertragung von Zellen vereinfachen. Alginat wird mit Calcium-D-Gluconat vernetzt und über Nacht eingefroren, um die Gerüste zu bilden. Die gefrorenen Gerüste werden in einem Gefriertrockner für 72 h gefriergetrocknet, um die Bildung der trockenen makroporösen Gerüste zu vervollständigen. Die Gerüste vermitteln den viralen Gentransfer, wenn Virus- und aktivierte T-Zellen auf dem Gerüst zusammengesät werden, um genetisch veränderte Zellen zu produzieren. Die Gerüste erzeugen >85% primäre T-Zell-Transduktion, was mit der Transduktionseffizienz der Spinokulation auf retronektinbeschichteten Platten vergleichbar ist. Diese Ergebnisse zeigen, dass trockene makroporöse Alginatgerüste eine kostengünstigere und bequemere Alternative zur herkömmlichen Transduktionsmethode darstellen.
Introduction
Die Immuntherapie hat sich aufgrund ihrer Fähigkeit, Tumore spezifisch anzugreifen, die Off-Target-Zytotoxizität zu begrenzen und einen Rückfall zu verhindern, zu einem revolutionären Krebsbehandlungsparadigma entwickelt. Insbesondere die chimäre Antigenrezeptor-T (CAR-T) -Zelltherapie hat aufgrund ihres Erfolgs bei der Behandlung von Lymphomen und Leukämien an Popularität gewonnen. Die FDA hat die erste CAR-T-Zelltherapie im Jahr 2017 zugelassen und seitdem vier weitere CAR-T-Zelltherapien 1,2,3,4,5 zugelassen. CARs haben eine Antigenerkennungsdomäne, die normalerweise aus einem einkettigen variablen Fragment eines monoklonalen Antikörpers besteht, der spezifisch für ein tumorassoziiertes Antigen 3,4 ist. Wenn eine CAR mit ihrem tumorassoziierten Antigen interagiert, werden die CAR-T-Zellen aktiviert, was zu einer Antitumorreaktion mit Zytokinfreisetzung, zytolytischer Degranulation, Transkriptionsfaktorexpression und T-Zellproliferation führt. Um CAR-T-Zellen zu produzieren, wird Blut vom Patienten gesammelt, um seine T-Zellen zu erhalten. CARs werden den T-Zellen des Patienten mit Hilfe eines Virus genetisch hinzugefügt. Die CAR-T-Zellen werden in vitro gezüchtet unddem Patienten 2,3,4,6 wieder infundiert. Die erfolgreiche Erzeugung von CAR-T-Zellen wird durch die Transduktionseffizienz bestimmt, die die Anzahl der T-Zellen beschreibt, die genetisch zu CAR-T-Zellen verändert werden.
Derzeit ist der Goldstandard für die CAR-T-Zellerzeugung die Spinokulation von aktivierten T-Zellen und Viren auf retronektinbeschichteten Platten 7,8. Die Transduktion beginnt, wenn Viruspartikel mit der Oberfläche der T-Zellen interagieren. Retronectin fördert die Kolokalisierung von Virus und Zellen, indem es die Bindungseffizienz zwischen den Viruspartikeln und den Zellen erhöht und die Transduktion verbessert 7,8. Retronectin allein wirkt nicht gut und muss von einer Spinokulation begleitet werden, die den Gentransfer verbessert, indem sie die Viruspartikel konzentriert und die Oberflächenpermeabilität der T-Zelle erhöht, was eine leichtere Virusinfektion ermöglicht8. Trotz des Erfolgs der Spinokulation auf retronektinbeschichteten Platten ist es ein komplexer Prozess, der mehrere Spinzyklen und teure Reagenzien erfordert. Daher sind alternative Methoden für den viralen Gentransfer, die schneller und billiger sind, sehr wünschenswert.
Alginat ist ein natürliches anionisches Polysaccharid, das in der biomedizinischen Industrie aufgrund seiner niedrigen Kosten, seines guten Sicherheitsprofils und seiner Fähigkeit, Hydrogele beim Mischen mit zweiwertigen Kationen 9,10,11,12 zu bilden, häufig verwendet wird. Alginat ist ein GMP-konformes Polymer und wird von der FDA13 allgemein als sicher (GRAS) anerkannt. Die Vernetzung von Alginat mit Kationen erzeugt stabile Hydrogele, die häufig in der Wundheilung, der Abgabe kleiner chemischer Medikamente und Proteine und des Zelltransports verwendetwerden 9,10,11,12,14,15,16. Aufgrund seiner hervorragenden Geliereigenschaften ist Alginat das bevorzugte Material zur Herstellung poröser Gerüste durch Gefriertrocknung10,17. Diese Eigenschaften von Alginat machen es zu einem attraktiven Kandidaten für die Herstellung eines Gerüsts, das den viralen Gentransfer aktivierter Zellen vermitteln kann.
Hier wird ein Protokoll zur Herstellung trockener makroporöser Alginatgerüste, bekannt als Drydux-Gerüste, beschrieben, die T-Zellen statisch durch viralen Gentransfer transduzieren17,18. Der Prozess zur Herstellung dieser Gerüste ist in Abbildung 1 dargestellt. Diese Gerüste machen die Spinokulation retronektinbeschichteter Platten überflüssig. Die makroporösen Alginatgerüste fördern die Interaktion von Viruspartikeln und T-Zellen, um einen effizienten Gentransfer in einem einzigen Schritt zu ermöglichen, ohne die Funktionalität und Lebensfähigkeit der technisch hergestellten T-Zellen zu beeinträchtigen17. Bei korrekter Befolgung haben diese makroporösen Alginatgerüste eine Transduktionseffizienz von mindestens 80%, was den viralen Transduktionsprozess vereinfacht und verkürzt.
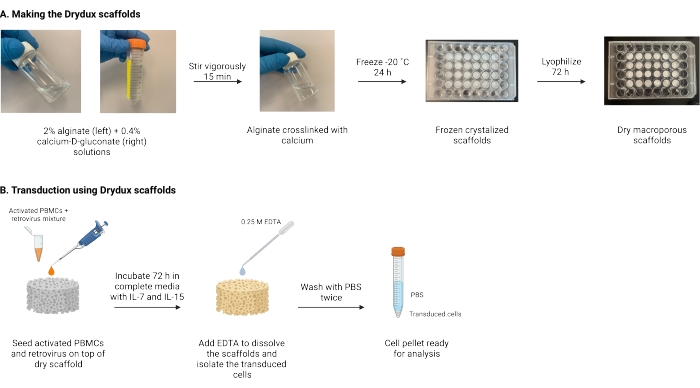
Abbildung 1: Schematische Darstellung und Zeitleiste des Protokolls . (A) Zeitplan für die Herstellung der trockenen makroporösen Alginatgerüste. Alginat wird mit Calcium-D-gluconat vernetzt und über Nacht eingefroren. Die gefrorenen Gerüste werden für 72 h lyophilisiert, um die Drydux-Gerüste herzustellen. (B) Zeitplan für die virale Transduktion aktivierter Zellen. Aktivierte Zellen und Viren (MOI 2) werden auf dem Gerüst ausgesät und in kompletten Medien inkubiert, ergänzt mit IL-7 und IL-15. Die Gerüste absorbieren die Mischung und fördern den viralen Gentransfer. EDTA wird verwendet, um die Gerüste aufzulösen und die transduzierten Zellen zu isolieren. Nach zweimaligem Waschen mit PBS kann das Zellpellet zur Analyse verwendet werden. Abkürzungen: PBS = phosphatgepufferte Kochsalzlösung; PBMCs = periphere mononukleäre Blutzellen. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.
Protocol
Representative Results
Discussion
Die CAR-T-Zelltherapie gewinnt weiterhin an Interesse sowohl für die Forschung als auch für kommerzielle Anwendungen. Trotz des Erfolgs der CAR-T-Zelltherapie bei der Behandlung von Blutkrebs schränken die hohen Kosten des Verfahrens seine Verwendung ein. Das hier vorgestellte Protokoll stellt eine neue Methode für den viralen Gentransfer von T-Zellen vor, ohne dass eine Spinokulation von retronektinbeschichteten Platten erforderlich ist. Die Herstellung trockener makroporöser Alginatgerüste zur Vermittlung der Tra…
Declarações
The authors have nothing to disclose.
Acknowledgements
Diese Arbeit wurde von den National Institutes of Health durch die Grant Award Nummern R37-CA260223, R21CA246414 unterstützt. Wir danken dem NCSU-Durchflusszytometrie-Kern für die Schulung und Anleitung zur Durchflusszytometrie-Analyse. Schaltpläne wurden mit Biorender.com erstellt
Materials
| 0.5 M EDTA | Invitrogen | 15575-038 | UltraPure, pH 8.0 |
| 1x DPBS | Gibco | 14190-144 | No calcium chloride or magnesium chloride |
| 3% Acetic Acid with Methylene Blue | Stemcell Technologies Inc | 07060 | |
| Activated Periphreal Blood Mononuclear Cells | – | – | Fresh or frozen |
| Calcium-D-Gluconate | Alfa Aesar | A11649 | |
| CD28.2 Antibody | BD | 555725 | 1 mg/mL |
| CD3 Antibody | Miltenyi | 130-093-387 | 100 μg/mL |
| Click's Media | FUJIFILM IRVINE SCIENTIFIC MS | 9195 | |
| DI Water | – | – | |
| Glutamax | Gibco | 35-050-061 | |
| HyClone FBS | Cytvia | SH3039603 | |
| HyClone RPMI 1640 Media | Cytvia | SH3009601 | |
| Penicillin-streptomycin (P/S) | Gibco | 15-140-122 | |
| Peripheral Blood Mononuclear Cells | – | – | Fresh or frozen |
| PRONOVA UP MVG | NovaMatrix | 4200101 | Sodium alginate |
| Recombinant Human IL-15 | Peprotech | 200-15 | 5 ng/mL |
| Recombinant Human IL-7 | Peprotech | 200-07 | 10 ng/mL |
| Retrovirus | – | – | 1 x 106 TU/mL |
Referências
- Prinzing, B. L., Gottschalk, S. M., Krenciute, G. C. A. R. T-cell therapy for glioblastoma: ready for the next round of clinical testing. Expert Review of Anticancer Therapy. 18 (5), 451-461 (2018).
- Bagley, S. J., Desai, A. S., Linette, G. P., June, C. H., O’Rourke, D. M. CAR T-cell therapy for glioblastoma: recent clinical advances and future challenges. Neuro-oncology. 20 (11), 1429-1438 (2018).
- Nair, R., Westin, J. CAR T cells. Advances in Experimental Medicine and Biology. 1342, 297-317 (2021).
- Jackson, H. J., Rafiq, S., Brentjens, R. J. Driving CAR T-cells forward. Nature Reviews. Clinical Oncology. 13 (6), 370-383 (2016).
- Sterner, R. C., Sterner, R. M. CAR-T cell therapy: current limitations and potential strategies. Blood Cancer Journal. 11 (4), 69 (2021).
- Miliotou, A. N., Papadopoulou, L. C. CAR T-cell therapy: A new era in cancer immunotherapy. Current Pharmaceutical Biotechnology. 19 (1), 5-18 (2018).
- Lee, H. -. J., et al. Retronectin enhances lentivirus-mediated gene delivery into hematopoietic progenitor cells. Biologicals: Journal of the International Association of Biological Standardization. 37 (4), 203-209 (2009).
- Rajabzadeh, A., Hamidieh, A. A., Rahbarizadeh, F. Spinoculation and retronectin highly enhance the gene transduction efficiency of Mucin-1-specific chimeric antigen receptor (CAR) in human primary T cells. BMC Molecular and Cell Biology. 22 (1), 57 (2021).
- Sun, J., Tan, H. Alginate-based biomaterials for regenerative medicine applications. Materials. 6 (4), 1285-1309 (2013).
- Nayak, A. K., Mohanta, B. C., Hasnain, M. S., Hoda, M. N., Tripathi, G. Chapter 14 – Alginate-based scaffolds for drug delivery in tissue engineering. Alginates in Drug Delivery. , 359-386 (2020).
- Lee, K. Y., Mooney, D. J. Alginate: properties and biomedical applications. Progress in Polymer Science. 37 (1), 106-126 (2012).
- Kuo, C. K., Ma, P. X. Ionically crosslinked alginate hydrogels as scaffolds for tissue engineering: part 1. Structure, gelation rate and mechanical properties. Biomaterials. 22 (6), 511-521 (2001).
- Soccol, C., et al. Probiotic nondairy beverages. Handbook of Plant-Based Fermented Food and Beverage Technology, Second Edition. , 707-728 (2012).
- Moody, C. T., et al. Restoring carboxylates on highly modified alginates improves gelation, tissue retention and systemic capture. Acta Biomaterialia. 138, 208-217 (2022).
- Brudno, Y., et al. Replenishable drug depot to combat post-resection cancer recurrence. Biomaterials. 178, 373-382 (2018).
- Moody, C. T., Palvai, S., Brudno, Y. Click cross-linking improves retention and targeting of refillable alginate depots. Acta Biomaterialia. 112, 112-121 (2020).
- Agarwalla, P., et al. Scaffold-mediated static transduction of T Cells for CAR-T Cell therapy. Advanced Healthcare Materials. 9 (14), 2000275 (2020).
- Agarwalla, P., et al. Bioinstructive implantable scaffolds for rapid in vivo manufacture and release of CAR-T cells. Nature Biotechnology. 40 (8), 1250-1258 (2022).
- Vera, J., et al. T lymphocytes redirected against the kappa light chain of human immunoglobulin efficiently kill mature B lymphocyte-derived malignant cells. Blood. 108 (12), 3890-3897 (2006).
- . PRONOVA UP MVG. IFF Nutrition Norge AS Available from: https://novamatrix.biz/store/pronova-up-mvg/ (2022)
- Zappasodi, R., Budhu, S., Abu-Akeel, M., Merghoub, T. In vitro assays for effector T cell functions and activity of immunomodulatory antibodies. Methods in Enzymology. 631, 43-59 (2020).
- Kong, B. S., Lee, C., Cho, Y. M. Protocol for the assessment of human T cell activation by real-time metabolic flux analysis. STAR Protocols. 3 (1), 101084 (2022).
- Bio-Rad cell activation protocols. Bio-Rad Available from: https://www.bio-rad-antibodies.com/cell-activation.html?JSESSIONID_STERLING=D6E538F76818E53C29884D6CC7334F24 (2022)
- Lin, H. -. R., Yeh, Y. -. J. Porous alginate/hydroxyapatite composite scaffolds for bone tissue engineering: Preparation, characterization, andin vitro studies. Journal of Biomedical Materials Research. 71 (1), 52-65 (2004).
- Wu, J., Zhao, Q., Sun, J., Zhou, Q. Preparation of poly(ethylene glycol) aligned porous cryogels using a unidirectional freezing technique. Soft Matter. 8 (13), 3620 (2012).

