מדידת התכונות המכאניות של תאי חיים באמצעות מיקרוסקופ כוח אטומי
Summary
מסמך זה מדגים פרוטוקול כדי לאפיין את התכונות מכאניות של תאי חיים באמצעות microindentation באמצעות מיקרוסקופ כוח אטומי (AFM).
Abstract
תכונות מכאניות של תאים ומטריצה תאית (ECM) ממלאות תפקידים חשובים בתהליכים ביולוגיים רבים, כולל בידול בתאי גזע, היווצרות גידול, וריפוי פצעים. שינויים בקשיחות של תאים וECM הם לעתים קרובות סימנים של שינויים בפיזיולוגיה של תא או מחלות ברקמות. לפיכך, תא קשיחות היא מדד להערכת המצב של תרביות תאים. בין מספר רב של שיטות שיושמו על מנת למדוד את הנוקשות של תאים ורקמות, מיקרו כניסה באמצעות מיקרוסקופ כוח אטומי (AFM) מספקת דרך למדוד את הנוקשות של תאי חיים באופן מהימן. שיטה זו כבר מיושמת באופן נרחב כדי לאפיין את הנוקשות בקנה מידה מייקר עבור מגוון רחב של חומרים, החל ממשטחי מתכת לרקמות רכות ותאים ביולוגיים. העיקרון הבסיסי של שיטה זו הוא לכניסה לתא עם קצה AFM של גיאומטריה נבחרה ולמדוד את הכח המופעל מהכיפוף של שלוחה AFM. התאמת עקומת כוח הכניסה למצב הרץl לגיאומטרית הקצה המקביל יכול לתת מדידות כמותיות של חומר קשיח. מסמך זה מדגים את ההליך כדי לאפיין את הנוקשות של תאי חיים באמצעות AFM. צעדים מרכזיים, כולל תהליך של כיול AFM, רכישת כוח עקומה, וניתוח נתונים באמצעות שגרת MATLAB הם הפגינו. מגבלות של שיטה זו הם דנו גם.
Introduction
תכונות מכאניות, במיוחד נוקשות, של תאים בודדים ומטריצות תאי המקיפות (ECM) הן קריטיות לתהליכים ביולוגיים רבים, כולל צמיחת תאים, תנועתיות, חלוקה, התמיינות, והומאוסטזיס רקמות. 1 זה כבר הוכיח כי נוקשות מכאני תא נקבעת בעיקר על ידי cytoskeleton, במיוחד את הרשתות של אקטין וסיבי ביניים וחלבונים אחרים הקשורים בהם. 2 תוצאות של בדיקות מכאניות ברשתות במבחנה של אקטין וסיבי ביניים מראות כי את המכניקה של התאים תלויה במידה רבה את מבנה cytoskeletal והמתח טרום ב שלד התא. 3-5 נוקשות של תאי חיים אז הוא נחשב למדד כדי להעריך את מבנה cytoskeletal 6, 7 פעילות שרירן ורב תהליכים תאיים אחרים. יותר מכך, שינויים בתכונות מכאניות של תאים מצויים גם לעתים קרובות להיות associ מקרובated עם תנאי מחלה שונים, כגון היווצרות גרורה סרטניים 8-10 ניטור הנוקשות מכאנית של תאי חיים ולכן יכולות לספק דרך חדשנית לניטור פיזיולוגיה תא;. לזהות ולאבחן מחלות 8;. וכדי להעריך את היעילות של טיפולים תרופתיים 11 , 12
שיטות מרובות, כולל microrheology חלקיק מעקב, 13-16 cytometry פיתול מגנטית, 17 שאיפת micropipette 18,19 וmicroindentation 20-22 פותחו כדי למדוד את האלסטיות של תאים. microrheology מעקב אחר החלקיקים משרטטת את תנודות התרמיות של חלקיקים או ניאון submicron הזריקו לתוך תאים או סמני fiducial בתוך שלד תא התא. 23 תכונות אלסטיות וצמיגות של תאים מחושבות מהתקות החלקיקים נמדדו באמצעות משפט תנודות-פיזור. 14,23 שיטה זו מאפשרת מדידות בו זמניות של מקומיתכונות מכאניות עם רזולוציה מרחבית גבוהה במקומות שונים בתא. עם זאת, הזרקת חלקיקי ניאון לתאים עלולה לגרום לשינויים בתפקוד תא, מבנה שלד תא, ומכאן מכניקה הסלולרי. שיטת שאיפת micropipette חלה לחץ שלילי בmicropipette בקוטר הנע בין 1 ל -5 מיקרומטר למצוץ חתיכה קטנה של קרום תא לתוך פיפטה. תא נוקשות מחושבת מהלחץ השלילי מיושם ועיוות קרום תא. -18 שיטה זו, עם זאת, אינו יכולה לזהות את ההתפלגות הטרוגנית של נוקשות על פני התא. cytometry פיתול המגנטית (MTC) חלה שדה מגנטי כדי ליצור מומנט בחרוזים פאראמגנטיים סופר מחובר לקרום התא. סלולרי 17 נוקשות נגזרה בשיטה זו ממערכת היחסים בין המומנט מיושם ועיוות הפיתול של קרום התא. זה קשה לשלוט על המיקום של חרוזים מגנטיים בשיטת MTC, וזה גם challenging לאפיין את העיוות מתפתלת עם רזולוציה גבוהה. Microindentation חל indenter עם גיאומטריה מוגדרת היטב לאגרוף לתוך התא. כוח indenting והכניסה וכתוצאה מכך תאים לעתים קרובות לעקוב חיזוי של מודל הרץ. moduli של יאנג של תאים ניתן לחשב את עקומות כוח ההזחה על ידי התאמתן למודל הרץ. שיטה זו כבר מיושמת באופן נרחב כדי לבחון את התכונות מכאניות של רקמות ותאים, למרות המגבלות שלה, כגון חוסר ודאות בקביעת קשר נקודה, תחולתו של מודל הרץ, ואת הפוטנציאל לפגיעה פיזית בתאים. בין התקנים רבים לmicroindentaion 20, מיקרוסקופ כוח האטומי (AFM) הוא זמין באופן מסחרי וכבר מיושם באופן נרחב לאפיון תכונות מכאניות של תאי חיים ורקמות 21,24-27.
מסמך זה מדגים את ההליך של שימוש מקלט MFP3D-Bio AFM לאפיין מכניקה סלולרי. AFM לא עלly מספק טופוגרפיה ברזולוציה גבוהה של תאים, אלא גם כבר מיושם באופן נרחב כדי לאפיין את התכונות מכאניות של תאים ורקמות. העיקרון של כניסת AFM מודגם באיור 1. שלוחה AFM גישות תא מכמה מיקרומטרים הנ"ל; יוצרת קשר עם התא; כניסות הסלולריים, כך שסטיית שלוחה מגיעה לנקודת סט שנבחרה מראש, ומתרחקת מהתא. במהלך תהליך זה סטיית שלוחה נרשמת כפונקציה של מיקומו, כפי שמוצגת באיור 1. לפני יצירת קשר עם התא, שלוחה נעה במדיום ללא כל סטייה נראית לעין. כאשר indenting בתא, מתכופפת שלוחה ועליות אותות הסטייה. את cantilevers הוא מודל כקורה אלסטיות, כך שהסטייה שלהם היא פרופורציונלית לכח המופעל על התא. על ידי הגדרת סטיית שלוחה המרבית, את הגודל המרבי של כוח המופעל על המדגם מוגבל, כדי למנוע דamage לתאים. החלק של עקומת כוח מהנקודה לנקודה B באיור 1 ג, שבו כניסות קצה לתוך התא, הוא מתאימים למודל הרץ כדי לחלץ את נוקשות התא.
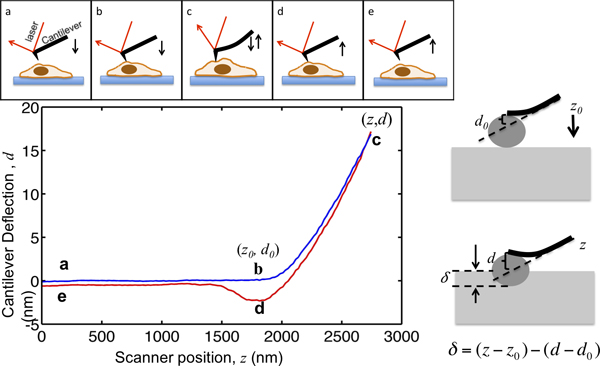
איור 1. איור של microindentation ופרשנות של עקומת כוח AFM. הפנל העליון מראה את התנועה של שלוחה AFM מונעת על ידי סורק piezo. המיקום האנכי של שלוחה ושלוחת z סטיית האות D הוא רשם במהלך התהליך. שלוחה מתחילה מנקודה, כמה מיקרומטרים מעל לתא. בעת שהתקרב לתא, δ כניסת המדגם נשאר אפס עד שהוא מגיע לנקודה ב ', שבו הקצה בא במגע עם התאים. הקואורדינטות של נקודת B בעלילה הן ערכים קריטייםלניתוח נתונים, מסומן על ידי (z 0, ד 0>). מ-B ל-C, את כניסות שלוחה לתוך התא עד שסטיית שלוחה מגיעה לנקודה שנקבעה, אשר מוגדרת להיות היחס בין כוח המרבי indenting ממוקד ומעיין שלוחה המתמיד. ברגע שהאות מגיעה לסטייה מהערך המרבי המוגדר מראש, שלוחה לאחר מכן נסוג מתא לנקודת D, שבו לעתים קרובות להיות משך כלפי מטה בשל הידבקות קצה מדגם, מתנתקת מהתא וחוזר למיקומו הראשוני בדואר. הפנל הימני מדגים את הקשר בין הכניסה וz המוקלט ואות ד. בפנל השמאלי התחתון היא עלילה של עקומת נציג כוח, כניסה המרבית של שלוחה, שקבועות הקפיץ נמדדה להיות 0.07N / מ ', מוגדר להיות 17 ננומטר, כך שהכח המרבי indenting להחיל מדגם הוא 1.2 NN. מקומות מפתח במהלך הכניסה מסומנים.
Protocol
Representative Results
Discussion
יש שיטת כניסת AFM יתרונות לאפיין תכונות מכאניות של תאי חיים. אם כי פחות רגיש מאשר cytometry המגנטית הפיתול ופינצטה אופטית, שיכול למדוד את הכוחות ברמת piconewton 32, AFM יכול לזהות כוח התנגדות מדוגמאות הנעות בין עשרות Pico-ניוטון למאות ננו ניוטון, דומות לטווח של כוח ש יכול להיות …
Disclosures
The authors have nothing to disclose.
Acknowledgements
המחברים מודים לד"ר פול Janmey באוניברסיטת פנסילבניה למתן קווים סלולריים בשימוש במאמר זה. QW גם להכיר JF Byfield והאוון אנדרסון לדיוני תובנות שלהם על טכניקות AFM.
References
- Discher, D. E., Janmey, P., Wang, Y. L. Tissue cells feel and respond to the stiffness of their substrate. Science. 310, 1139-1143 (2005).
- Wagner, O. I., et al. Softness, strength and self-repair in intermediate filament networks. Exp. Cell Res. 313, 2228-2235 (2007).
- Wang, N., et al. Mechanical behavior in living cells consistent with the tensegrity model. Proceedings of the National Academy of Sciences of the United States of America. 98, 7765-7770 (2001).
- Wang, N., et al. Cell prestress. I. Stiffness and prestress are closely associated in adherent contractile cells. American Journal of Physiology. Cell Physiology. 282, 606-616 (2002).
- Kasza, K. E., et al. Filamin A is essential for active cell stiffening but not passive stiffening under external force. Biophysical Journal. 96, 4326-4335 (2009).
- Elson, E. L. Cellular mechanics as an indicator of cytoskeletal structure and function. Annual Review of Biophysics and Biophysical Chemistry. 17, 397-430 (1988).
- Schafer, A., Radmacher, M. Influence of myosin II activity on stiffness of fibroblast cells. Acta Biomaterialia. 1, 273-280 (2005).
- Guck, J., et al. Optical deformability as an inherent cell marker for testing malignant transformation and metastatic competence. Biophysical Journal. 88, 3689-3698 (2005).
- Cross, S. E., Jin, Y. S., Rao, J., Gimzewski, J. K. Nanomechanical analysis of cells from cancer patients. Nature Nanotechnology. 2, 780-783 (2007).
- Plodinec, M., et al. The nanomechanical signature of breast cancer. Nature Nanotechnology. 7, 757-765 (2012).
- Rotsch, C., Radmacher, M. Drug-induced changes of cytoskeletal structure and mechanics in fibroblasts: an atomic force microscopy study. Biophysical Journal. 78 (00), 520-535 (2000).
- Cross, S. E., Jin, Y. S., Lu, Q. Y., Rao, J., Gimzewski, J. K. Green tea extract selectively targets nanomechanics of live metastatic cancer cells. Nanotechnology. 22, 215101 (2011).
- Hoffman, B. D., Crocker, J. C. Cell mechanics: dissecting the physical responses of cells to force. Annual Review of Biomedical Engineering. 11, 259-288 (2009).
- Hoffman, B. D., Massiera, G., Van Citters, K. M., Crocker, J. C. The consensus mechanics of cultured mammalian cells. Proceedings of the National Academy of Sciences of the United States of America. 103, 10259-10264 (2006).
- Lau, A. W., Hoffman, B. D., Davies, A., Crocker, J. C., Lubensky, T. C. Microrheology, stress fluctuations, and active behavior of living cells. Physical Review Letters. 91, 198101 (1981).
- Liu, J., et al. Microrheology probes length scale dependent rheology. Physical Review Letters. 96, 118104 (2006).
- Deng, L., et al. Fast and slow dynamics of the cytoskeleton. Nature Materials. 5, 636-640 (2006).
- Oh, M. J., Kuhr, F., Byfield, F., Levitan, I. Micropipette Aspiration of Substrate-attached Cells to Estimate Cell Stiffness. J. Vis. Exp. (67), e3886 (2012).
- Hochmuth, R. M. Micropipette aspiration of living cells. Journal of Biomechanics. 33, 15-22 (2000).
- Levental, I., et al. A simple indentation device for measuring micrometer-scale tissue stiffness. J. Phys-Condens. Mat. 22, (2010).
- Mahaffy, R. E., Park, S., Gerde, E., Kas, J., Shih, C. K. Quantitative analysis of the viscoelastic properties of thin regions of fibroblasts using atomic force microscopy. Biophysical Journal. 86, 1777-1793 (2004).
- Radmacher, M. Measuring the elastic properties of biological samples with the AFM. IEEE Engineering in Medicine and Biology Magazine: The Quarterly Magazine of the Engineering in Medicine & Biology Society. 16, 47-57 (1997).
- Crocker, J. C., Hoffman, B. D. Multiple-particle tracking and two-point microrheology in cells. Methods in Cell Biology. 83, 141-178 (2007).
- Liu, F., Tschumperlin, D. J. Micro-mechanical characterization of lung tissue using atomic force microscopy. J. Vis. Exp. (54), e2911 (2011).
- Solon, J., Levental, I., Sengupta, K., Georges, P. C., Janmey, P. A. Fibroblast adaptation and stiffness matching to soft elastic substrates. Biophysical Journal. 93, 4453-4461 (2007).
- Wu, H. W., Kuhn, T., Moy, V. T. Mechanical properties of l929 cells measured by atomic force microscopy: Effects of anticytoskeletal drugs and membrane crosslinking. Scanning. 20, 389-397 (1998).
- Radmacher, M., Fritz, M., Kacher, C. M., Cleveland, J. P., Hansma, P. K. Measuring the viscoelastic properties of human platelets with the atomic force microscope. Biophysical Journal. 70, 556-567 (1996).
- Levy, R., Maaloum, M. Measuring the spring constant of atomic force microscope cantilevers: thermal fluctuations and other methods. Nanotechnology. 13, 33-37 (2002).
- Lin, D. C., Dimitriadis, E. K., Horkay, F. Robust strategies for automated AFM force curve analysis–I. Non-adhesive indentation of soft, inhomogeneous materials. Journal of Biomechanical Engineering. 129, 430-440 (2007).
- Davis, J. T., Wen, Q., Janmey, P. A., Otteson, D. C., Foster, W. J. Muller cell expression of genes implicated in proliferative vitreoretinopathy is influenced by substrate elastic modulus. Investigative Ophthalmology & Visual Science. 53, 3014-3019 (2012).
- Engler, A. J., Rehfeldt, F., Sen, S., Discher, D. E. Microtissue elasticity: Measurements by atomic force microscopy and its influence on cell differentiation. Method Cell Biol. 83, 521-545 (2007).
- Lele, T. P., et al. Tools to study cell mechanics and mechanotransduction. Methods in Cell Biology. 83 (07), 443-472 (2007).
- A-Hassan, E., et al. Relative microelastic mapping of living cells by atomic force microscopy. Biophysical Journal. 74, 1564-1578 (1998).
- Costa, K. D., Sim, A. J., Yin, F. C. Non-Hertzian approach to analyzing mechanical properties of endothelial cells probed by atomic force microscopy. Journal of Biomechanical Engineering. 128, 176-184 (2006).
- Xiong, Y., Lee, A. C., Suter, D. M., Lee, G. U. Topography and nanomechanics of live neuronal growth cones analyzed by atomic force microscopy. Biophysical Journal. 96, 5060-5072 (2009).
- Byfield, F. J., et al. Absence of filamin A prevents cells from responding to stiffness gradients on gels coated with collagen but not fibronectin. Biophysical Journal. 96, 5095-5102 (2009).
- Cross, S. E., et al. AFM-based analysis of human metastatic cancer cells. Nanotechnology. 19, 384003 (2008).
- Storm, C., Pastore, J. J., MacKintosh, F. C., Lubensky, T. C., Janmey, P. A. Nonlinear elasticity in biological gels. Nature. 435, 191-194 (2005).
- Wen, Q., Janmey, P. A. Polymer physics of the cytoskeleton. Current Opinion in Solid State & Materials Science. 15, 177-182 (2011).
- Dimitriadis, E. K., Horkay, F., Maresca, J., Kachar, B., Chadwick, R. S. Determination of elastic moduli of thin layers of soft material using the atomic force microscope. Biophysical Journal. 82 (02), 2798-2810 (2002).
- Trache, A., Lim, S. M. Live cell response to mechanical stimulation studied by integrated optical and atomic force microscopy. J. Vis. Exp. (44), e2072 (2010).
- Lim, S. M., Kreipe, B. A., Trzeciakowski, J., Dangott, L., Trache, A. Extracellular matrix effect on RhoA signaling modulation in vascular smooth muscle cells. Exp. Cell Res. 316, 2833-2848 (2010).

