원자 힘 현미경을 사용하여 살아있는 세포의 기계적 특성을 측정
Summary
이 논문은 원자 힘 현미경 (AFM)을 사용하여 microindentation을 통해 살아있는 세포의 기계적 특성을 특성화 할 수있는 프로토콜을 보여줍니다.
Abstract
세포와 세포 외 기질 (ECM)의 기계적인 특성은 줄기 세포 분화, 종양 형성, 상처 치유 등 많은 생물 학적 과정에 중요한 역할을한다. 세포와 ECM의 강성의 변화는 종종 세포 생리학 또는 조직의 질병의 변화의 징후입니다. 따라서, 세포 강성 세포 배양의 상태를 평가하는 인덱스입니다. 세포와 조직의 강성을 측정하는 적용 방법의 무리 사이, 원자 힘 현미경 (AFM)을 사용하여 마이크로 들여 쓰기 안정적으로 살아있는 세포의 강성을 측정하는 방법을 제공합니다. 이 방법은 널리 금속 표면에서 부드러운 생물학적 조직과 세포에 이르기까지 다양한 재료에 대한 마이크로 스케일 강성의 특성을 적용하고있다. 이 방법의 기본 원리는 선택한 형상 AFM 팁과 셀을 들여 쓰기 AFM 캔틸레버의 휨에서 적용되는 힘을 측정하는 것입니다. 헤르츠 모드로 강제 압입 곡선을 피팅해당 팁 지오메트리 난 재료 강성의 정량적 측정을 제공 할 수 있습니다. 이 논문은 AFM을 이용하여 살아있는 세포의 강성을 특성화하는 과정을 보여줍니다. MATLAB 루틴을 사용하여 AFM 교정 과정, 강제 곡선 수집, 데이터 분석 등 주요 단계를 설명합니다. 이 방법의 제한 사항에 대해서도 설명합니다.
Introduction
각각의 세포와 그 주변의 세포 외 기질의 기계적 특성, 특히 강성 (ECM)은 세포 성장, 운동, 분열, 분화 및 조직 항상성 등 많은 생물 학적 과정에 중요한 1. 그것은 세포 기계적 강성은 주로에 의해 결정되는 증명되었다 악틴 및 중간 필라멘트의 체외 네트워크에서의 기계적 시험의 골격, 악틴 및 중간 필라멘트 및 그와 관련된 다른 단백질 특히 네트워크 2. 결과는 세포 역학의 골격 구조와 미리 스트레스에 크게 의존하는 것이 좋습니다 세포 골격. 살아있는 세포의 3-5 강성은 다음 골격 구조 6, 미오신 활동 7 및 다른 많은 세포 과정을 평가하는 지표로 간주됩니다. 더 중요한 것은, 세포 기계적 성질의 변화는 종종 밀접하게 연관된다는 것을 발견하는종양의 형성과 전이 등 다양한 질병 상태와 ated 8-10 모니터링 살아있는 세포의 기계적 강성 따라서 세포 생리학을 모니터링하는 새로운 방법을 제공 할 수 있습니다. 감지 및 질병에게 8을 진단;. 및 약물 치료의 효과를 평가하기 11 12
입자 추적 미세 유변학, 13-16 자기 왜곡 세포 계측법, 17 micropipette의 열망 18,19 및 microindentation 20-22 등 다양한 방법이 세포의 탄력성을 측정하기 위해 개발되었습니다. 입자 추적 미세 유변학은 세포의 cytoskeleton 세포 내부 또는 기준점 표지에 주입 미크론 형광 입자 하나의 열 진동을 추적합니다. 세포의 23 탄성과 점성 특성이 변동 방산 정리를 사용하여 측정 된 입자의 변위에서 계산됩니다. 14,23이 방법은 수 지역의 동시 측정셀에 다른 장소에서 높은 공간 해상도를 가진 기계적 성질. 그러나 세포에 형광 입자를 주입하면 세포 기능의 변화, 세포 골격 구조, 따라서 세포 역학으로 이어질 수 있습니다. micropipette의 열망 방법은 피펫으로 세포막의 작은 조각을 빨아 1 ~ 5 μm의에 이르기까지 직경 마이크로 피펫에 부정적인 압력을 적용합니다. 세포의 강성이 적용 부정적인 압력과 세포막의 변형. 18이 방법은 계산한다, 그러나, 세포를 통해 강성의 불균일 분포를 감지 할 수 없습니다. 자기 왜곡 세포 계측법 (MTC)는 세포막에 부착 된 초 상자성 구슬 토크를 생성하는 자기장을 적용합니다. 17 셀 강성이 적용되는 토크와 세포막의 왜곡 변형 사이의 관계에서이 방법으로 파생됩니다. 그것은 MTC 방법에 자석 구슬의 위치를 제어하기 어렵고, 또한 challengi입니다높은 해상도 왜곡 변형의 특성을 NG. Microindentation은 세포에 구멍을 뚫을 수있는 잘 정의 된 지오메트리 압자를 적용합니다. 들여 쓰기 힘과 세포의 결과 들여 쓰기는 종종 헤르츠 모델의 예측을 수행합니다. 세포의 영의 계수는 헤르츠 모델로 피팅에 의해 강제 압입 곡선으로부터 계산 될 수있다. 이 방법은 널리 접점 결정, 헤르츠 모델의 적용, 물리적으로 세포를 손상하는 가능성의 불확실성 등의 한계에도 불구하고 조직과 세포의 기계적 특성을 시험하기 위하여 적용되었습니다. microindentaion 20 많은 장치 사이에서 원자 힘 현미경 (AFM)은 시판되고 널리 살아있는 세포와 조직 21,24-27의 기계적 성질을 특성화하기 위해 적용되었습니다.
이 논문은 세포 역학의 특성을 정신 병원 MFP3D 바이오 AFM을 사용하는 절차를 보여줍니다. AFM하지에LY 세포의 고해상도 지형을 제공하지만 또한 널리 조직 세포의 기계적 특성을 특성화하기 위해 적용되었습니다. AFM 들여 쓰기의 원리는 그림 1에 나와 있습니다. AFM 캔틸레버는 위의 몇 마이크로 미터에서 셀을 접근, 세포와의 접촉을 만든다; 들여 쓰기 셀 캔틸레버 편향이 미리 선택된 세트 포인트에 도달 할 수 있도록하고, 멀리 셀에서 가져옵니다. 그림 1과 같이이 과정에서 캔틸레버의 처짐은 그 위치의 함수로 기록됩니다. 세포와 접촉하기 전에, 캔틸레버는 명백한 편향하지 않고 중간에 이동합니다. 셀 캔틸레버 굴절과 편향 신호 증가에 들여 쓰기를합니다. 캔틸레버들은 편향은 셀에 적용된 힘에 비례하도록 탄성 빔으로 모델링된다. 최대 캔틸레버 편향을 설정하여 샘플에 적용되는 힘의 최대 크기는 D를 방지하기 위해 제한됩니다세포 amage. 셀에 팁 들여 쓰기는 세포의 강성을 추출 헤르츠 모델에 적합하다 그림 1에서 C를 가리 B 지점에서 힘 곡선의 부분입니다.
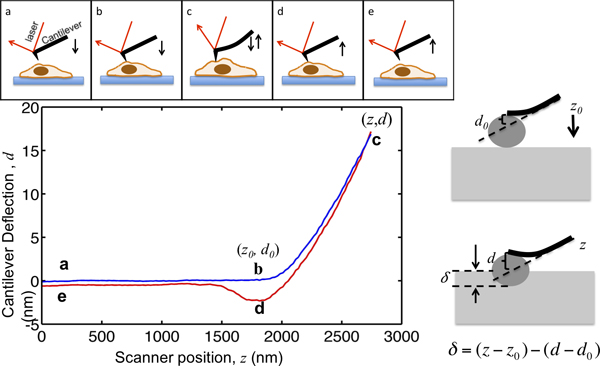
그림 1. AFM의 microindentation와 힘 곡선의 해석의 그림입니다. 상단 패널은 피에조 스캐너에 의한 AFM 캔틸레버의 움직임을 보여줍니다. 캔틸레버 Z와 캔틸레버 편향 신호 D의 수직 위치는 과정에서 기록됩니다. 캔틸레버 포인트, 셀 위의 몇 마이크로 미터부터 시작합니다. 셀을 접근하면서 끝이 세포와 접촉에 와서 B 지점에 도달 할 때까지, 샘플 들여 쓰기 δ 제로 남아있다. 플롯의 점 B의 좌표는 중요한 값이다데이터 분석, (Z 0, D 0>)로 표시. B에서 C로, 셀에 캔틸레버 들여 쓰기 캔틸레버 편향 대상으로 최대의 들여 쓰기 힘과 상수 캔틸레버 봄의 비율로 설정되어 세트 포인트에 도달 할 때까지. 편향 신호가 설정 한 최대 값에 도달하면, 캔틸레버 다음 셀은 종종 팁 – 샘플 부착으로 인해 아래를 뽑아 점 D에 철회 세포를 반환에서 전자의 초기 위치로 분리되어 있습니다. 오른쪽 패널은 들여 쓰기 및 기록 Z와 D 신호 사이의 관계를 보여줍니다. 왼쪽 하단 패널에있는 스프링 상수가 M / 0.07N로 측정하는 대표 힘 곡선, 외팔보의 최대 들여 쓰기의 음모로는 최대의 들여 쓰기 힘에 적용될 수 있도록 17 나노로 설정되어 있습니다 예제 1.2 윈은입니다. 들여 쓰기를하는 동안 키 위치가 표시됩니다.
Protocol
Representative Results
Discussion
AFM 들여 쓰기 방법은 살아있는 세포의 기계적 성질을 특성화하는 장점이 있습니다. piconewton 레벨 32 힘을 측정 할 수있는 자기 왜곡 세포 계측법 및 광학 핀셋보다 덜 민감이기는하지만, AFM은 힘의 범위를 비교 피코 뉴턴의 수십에서 나노 뉴턴의 수백에 이르는 샘플에서 저항 힘을 감지 할 수 마이크로 피펫 19을 사용하여 셀에 적용 할 수 있습니다. 힘의이 범위는 셀 19의 ?…
Disclosures
The authors have nothing to disclose.
Acknowledgements
저자는이 논문에서 사용 된 세포주를 제공하기 위해 펜실베니아 대학에서 박사 폴 Janmey 감사합니다. QW는 AFM 기술에 대한 통찰력있는 논의를 위해 JF 바이 필드와 에반 앤더슨을 인정합니다.
References
- Discher, D. E., Janmey, P., Wang, Y. L. Tissue cells feel and respond to the stiffness of their substrate. Science. 310, 1139-1143 (2005).
- Wagner, O. I., et al. Softness, strength and self-repair in intermediate filament networks. Exp. Cell Res. 313, 2228-2235 (2007).
- Wang, N., et al. Mechanical behavior in living cells consistent with the tensegrity model. Proceedings of the National Academy of Sciences of the United States of America. 98, 7765-7770 (2001).
- Wang, N., et al. Cell prestress. I. Stiffness and prestress are closely associated in adherent contractile cells. American Journal of Physiology. Cell Physiology. 282, 606-616 (2002).
- Kasza, K. E., et al. Filamin A is essential for active cell stiffening but not passive stiffening under external force. Biophysical Journal. 96, 4326-4335 (2009).
- Elson, E. L. Cellular mechanics as an indicator of cytoskeletal structure and function. Annual Review of Biophysics and Biophysical Chemistry. 17, 397-430 (1988).
- Schafer, A., Radmacher, M. Influence of myosin II activity on stiffness of fibroblast cells. Acta Biomaterialia. 1, 273-280 (2005).
- Guck, J., et al. Optical deformability as an inherent cell marker for testing malignant transformation and metastatic competence. Biophysical Journal. 88, 3689-3698 (2005).
- Cross, S. E., Jin, Y. S., Rao, J., Gimzewski, J. K. Nanomechanical analysis of cells from cancer patients. Nature Nanotechnology. 2, 780-783 (2007).
- Plodinec, M., et al. The nanomechanical signature of breast cancer. Nature Nanotechnology. 7, 757-765 (2012).
- Rotsch, C., Radmacher, M. Drug-induced changes of cytoskeletal structure and mechanics in fibroblasts: an atomic force microscopy study. Biophysical Journal. 78 (00), 520-535 (2000).
- Cross, S. E., Jin, Y. S., Lu, Q. Y., Rao, J., Gimzewski, J. K. Green tea extract selectively targets nanomechanics of live metastatic cancer cells. Nanotechnology. 22, 215101 (2011).
- Hoffman, B. D., Crocker, J. C. Cell mechanics: dissecting the physical responses of cells to force. Annual Review of Biomedical Engineering. 11, 259-288 (2009).
- Hoffman, B. D., Massiera, G., Van Citters, K. M., Crocker, J. C. The consensus mechanics of cultured mammalian cells. Proceedings of the National Academy of Sciences of the United States of America. 103, 10259-10264 (2006).
- Lau, A. W., Hoffman, B. D., Davies, A., Crocker, J. C., Lubensky, T. C. Microrheology, stress fluctuations, and active behavior of living cells. Physical Review Letters. 91, 198101 (1981).
- Liu, J., et al. Microrheology probes length scale dependent rheology. Physical Review Letters. 96, 118104 (2006).
- Deng, L., et al. Fast and slow dynamics of the cytoskeleton. Nature Materials. 5, 636-640 (2006).
- Oh, M. J., Kuhr, F., Byfield, F., Levitan, I. Micropipette Aspiration of Substrate-attached Cells to Estimate Cell Stiffness. J. Vis. Exp. (67), e3886 (2012).
- Hochmuth, R. M. Micropipette aspiration of living cells. Journal of Biomechanics. 33, 15-22 (2000).
- Levental, I., et al. A simple indentation device for measuring micrometer-scale tissue stiffness. J. Phys-Condens. Mat. 22, (2010).
- Mahaffy, R. E., Park, S., Gerde, E., Kas, J., Shih, C. K. Quantitative analysis of the viscoelastic properties of thin regions of fibroblasts using atomic force microscopy. Biophysical Journal. 86, 1777-1793 (2004).
- Radmacher, M. Measuring the elastic properties of biological samples with the AFM. IEEE Engineering in Medicine and Biology Magazine: The Quarterly Magazine of the Engineering in Medicine & Biology Society. 16, 47-57 (1997).
- Crocker, J. C., Hoffman, B. D. Multiple-particle tracking and two-point microrheology in cells. Methods in Cell Biology. 83, 141-178 (2007).
- Liu, F., Tschumperlin, D. J. Micro-mechanical characterization of lung tissue using atomic force microscopy. J. Vis. Exp. (54), e2911 (2011).
- Solon, J., Levental, I., Sengupta, K., Georges, P. C., Janmey, P. A. Fibroblast adaptation and stiffness matching to soft elastic substrates. Biophysical Journal. 93, 4453-4461 (2007).
- Wu, H. W., Kuhn, T., Moy, V. T. Mechanical properties of l929 cells measured by atomic force microscopy: Effects of anticytoskeletal drugs and membrane crosslinking. Scanning. 20, 389-397 (1998).
- Radmacher, M., Fritz, M., Kacher, C. M., Cleveland, J. P., Hansma, P. K. Measuring the viscoelastic properties of human platelets with the atomic force microscope. Biophysical Journal. 70, 556-567 (1996).
- Levy, R., Maaloum, M. Measuring the spring constant of atomic force microscope cantilevers: thermal fluctuations and other methods. Nanotechnology. 13, 33-37 (2002).
- Lin, D. C., Dimitriadis, E. K., Horkay, F. Robust strategies for automated AFM force curve analysis–I. Non-adhesive indentation of soft, inhomogeneous materials. Journal of Biomechanical Engineering. 129, 430-440 (2007).
- Davis, J. T., Wen, Q., Janmey, P. A., Otteson, D. C., Foster, W. J. Muller cell expression of genes implicated in proliferative vitreoretinopathy is influenced by substrate elastic modulus. Investigative Ophthalmology & Visual Science. 53, 3014-3019 (2012).
- Engler, A. J., Rehfeldt, F., Sen, S., Discher, D. E. Microtissue elasticity: Measurements by atomic force microscopy and its influence on cell differentiation. Method Cell Biol. 83, 521-545 (2007).
- Lele, T. P., et al. Tools to study cell mechanics and mechanotransduction. Methods in Cell Biology. 83 (07), 443-472 (2007).
- A-Hassan, E., et al. Relative microelastic mapping of living cells by atomic force microscopy. Biophysical Journal. 74, 1564-1578 (1998).
- Costa, K. D., Sim, A. J., Yin, F. C. Non-Hertzian approach to analyzing mechanical properties of endothelial cells probed by atomic force microscopy. Journal of Biomechanical Engineering. 128, 176-184 (2006).
- Xiong, Y., Lee, A. C., Suter, D. M., Lee, G. U. Topography and nanomechanics of live neuronal growth cones analyzed by atomic force microscopy. Biophysical Journal. 96, 5060-5072 (2009).
- Byfield, F. J., et al. Absence of filamin A prevents cells from responding to stiffness gradients on gels coated with collagen but not fibronectin. Biophysical Journal. 96, 5095-5102 (2009).
- Cross, S. E., et al. AFM-based analysis of human metastatic cancer cells. Nanotechnology. 19, 384003 (2008).
- Storm, C., Pastore, J. J., MacKintosh, F. C., Lubensky, T. C., Janmey, P. A. Nonlinear elasticity in biological gels. Nature. 435, 191-194 (2005).
- Wen, Q., Janmey, P. A. Polymer physics of the cytoskeleton. Current Opinion in Solid State & Materials Science. 15, 177-182 (2011).
- Dimitriadis, E. K., Horkay, F., Maresca, J., Kachar, B., Chadwick, R. S. Determination of elastic moduli of thin layers of soft material using the atomic force microscope. Biophysical Journal. 82 (02), 2798-2810 (2002).
- Trache, A., Lim, S. M. Live cell response to mechanical stimulation studied by integrated optical and atomic force microscopy. J. Vis. Exp. (44), e2072 (2010).
- Lim, S. M., Kreipe, B. A., Trzeciakowski, J., Dangott, L., Trache, A. Extracellular matrix effect on RhoA signaling modulation in vascular smooth muscle cells. Exp. Cell Res. 316, 2833-2848 (2010).

