A Novel Stretching platform voor toepassingen in de Cel en Weefsel Mechanobiology
Summary
We presenteren in dit artikel een nieuw strekken platform dat kan worden gebruikt om cel responsen op complexe anisotrope biaxiale mechanische vervorming onderzoeken en kwantificeren van de mechanische eigenschappen van biologisch weefsel.
Abstract
Gereedschappen die het uitoefenen van mechanische krachten om cellen en weefsels of waarmee kan kwantificeren de mechanische eigenschappen van biologisch weefsel dramatisch bijgedragen tot het begrijpen van fundamentele mechanobiology. Deze technieken zijn uitgebreid gebruikt om aan te tonen hoe het ontstaan en de progressie van verschillende ziekten sterk worden beïnvloed door mechanische signalen. Dit artikel presenteert een multi-functionele biaxiale (BAXS) platform dat mechanisch kunnen stimuleren enkele cellen of kwantificeren van de mechanische stijfheid van weefsels. De BAXS platform bestaat uit vier voice coil motoren die onafhankelijk kunnen worden bestuurd. Enkele cellen kunnen worden gekweekt op een flexibel substraat dat kan worden bevestigd aan de motor zodat men de cellen blootgesteld aan complexe, dynamische en ruimtelijk variërende spanning velden. Omgekeerd, doordat een kracht load cell, kan ook kwantificeren de mechanische eigenschappen van primaire weefsels ze worden blootgesteld aan deformatie cycli.In beide gevallen moet een goede set van klemmen worden ontworpen en gemonteerd aan de BAXS platform motoren om stevig vast te houden het flexibel substraat of het weefsel van belang. De BAXS platform kan op een omgekeerde microscoop worden gemonteerd gelijktijdige doorvallend licht en / of fluorescentie beeldvorming uit te voeren om de structurele of biochemische reactie van het monster tijdens het spannen experimenten onderzoeken. Dit artikel geeft experimentele details van het ontwerp en het gebruik van de BAXS platform en presenteert de resultaten voor enkele cel en hele weefsel studies. De BAXS platform werd gebruikt om de vervorming van kernen in enkele muis myoblast cellen in reactie meten spanning substraat en de stijfheid van geïsoleerde muis aorta meten. De BAXS platform is een veelzijdig instrument dat kan worden gecombineerd met verschillende optische microscopie om nieuwe mechanobiologische inzichten op de sub-cellulair, cellulaire en hele weefsel niveaus bieden.
Introduction
De mechanische micro speelt een belangrijke rol in vele celfuncties zoals proliferatie, migratie en differentiatie, die een grote invloed hebben op de ontwikkeling en homeostase van weefsels en ook ziekten 1-6. In de loop der jaren, hebben een veelheid van experimentele instrumenten gebruikt om mechanisch te stimuleren cellen of weefsels en meet mechanische eigenschappen van biologische weefsels met als doel het vergroten van ons begrip van de fundamentele mechanobiology en het bestuderen van het ontstaan en de progressie van ziekten 6-17. Men moet echter vaak afhankelijk van verschillende experimentele apparatuur om de doelstellingen van een bepaalde studie te bereiken. Dit artikel presenteert een enkele, multi-functionele, biaxiale (BAXS) platform dat zorgt voor studies die de rol te onderzoeken dat de mechanische eigenschappen en de mechanische krachten spelen in de biologie aan de sub-cellulaire om hele weefsel lengteschalen. De BAXS platform biedt niet alleen voor de quantification van de mechanische eigenschappen van geïsoleerde weefsels, maar vergemakkelijkt ook het vermogen om eenvoudige, complexe en dynamische belasting velden aan levende cellen om hun reacties begrijpen strekken dat voorkomt in vivo. De BAXS platform onderhoudt ook de capaciteit om live-cell microscopie voeren tijdens mechanische testen en storingen op cellen en weefsels.
De BAXS platform is een op maat gemaakte inrichting die kan worden gebruikt om het effect van substraat vervorming onderzoeken op cellulair niveau uitvoeren tractie op biologische weefsels (Figuur 1A). Een aluminium verwarming werd vervaardigd op een standaard 10 cm Petrischaal ontvangen en fysiologische oplossingen handhaven op 37 ° C met een temperatuurregelaar en Kapton heaters (Figuur 1B). Deze BAXS platform kan worden geïntegreerd op een omgekeerde fase contrast en / of fluorescentie microscoop en maakt gelijktijdige beeldvorming (figuur 1C).Kortom, de BAXS platform bestaat uit vier lineaire voice coil motoren waarvan de bewegende delen van miniatuur lineaire beweging kogellagers georiënteerd langs twee loodrechte assen (figuur 1D) zijn gemonteerd. Een lineaire positioneertafel is gemonteerd op elk van de vier motoren verticale beweging van het klemsysteem wordt gebruikt (figuur 1E) mogelijk. De positie van elke motor wordt bewaakt door een optische encoder met een resolutie van 500 nm (figuur 1F). Alle vier de motoren worden onafhankelijk geregeld met een motion controller in dienst optische encoder feedback om beweging commando's (figuur 1G) uit te voeren. Een LabVIEW interface biedt volledige controle over de omvang verplaatsing, snelheid en versnelling van elke motor om volledig klantgerichte, statische en dynamische vervorming van de cellen of weefselmonsters genereren.
De gebruikte techniek om vervorming induceren wordt bereikt door eenvoudigweg allowing cellen stevig vasthouden aan een flexibel en transparant substraat en vervolgens stretching dit substraat met behulp van de vier motoren van de BAXS platform. De BAXS platform maakt het monteren van een op maat gemaakte set van klemmen aan het substraat op de voice coil motoren hechten. Hiervoor hebben we een reeks van klemmen waaraan een flexibel en transparant substraat van polydimethylsiloxaan (PDMS), kan worden bevestigd (figuren 2A-C en figuur 3). Als de klemmen worden blootgesteld aan fysiologische oplossingen werden alle onderdelen vervaardigd uit roestvast staal om voor sterilisatie. Deze klemmen zijn zorgvuldig ontworpen om het substraat zo dicht mogelijk bij het microscoopobjectief brengen om de beeldkwaliteit te verbeteren terwijl het minimaliseren van de belasting van het substraat tijdens het spannen (fig. 2D).
Dezelfde BAXS platform kan ook worden gebruikt om de stijfheid van kleine weefselmonsters te kwantificeren, met behulp van een geschikte set van klemmen met ADAPted steunen voor de weefselmonsters en een load cell om de krachten te controleren. Verschillende benaderingen kunnen worden genomen om een weefsel te monteren op het platform BAXS motoren; in dit geval de roestvrijstalen insect minutiens kunnen kan haak door de opening van vaatweefsel om trekproeven (figuren 4A-B) verricht. Als alternatief voor dikke weefsels zonder natuurlijke opening, weefsel randen ofwel plaats gehouden met klemmen aan de spreekspoel motoren of gelijmd kleine glasplaatjes met biologische lijm en aan de motoren met de klemmen. Om treksterkte voeren tests een miniatuur load cell is vereist en kan gemakkelijk worden opgenomen op de BAXS platform motoren en gebruikt om de kracht die op het weefsel tijdens een cyclus strekken (figuur 4C) meten. Aangezien de BAXS platform is samengesteld uit vier motoren, de invoering van een tweede load cell kan men trekproeven uitgevoerd langs twee orthogonale richtingen. Dit vermogen maakt het mogelijk om quantify de mechanische stijfheid van een weefsel langs twee loodrechte richtingen in hetzelfde experiment.
Belangrijk in alle configuraties, de cellen of weefselmonsters plaats altijd gehandhaafd op een temperatuur geregeld bad dat toegankelijk is voor de gebruiker. Dit vermogen maakt de invoering van farmacologische middelen in monster strekken om de temporele respons van het monster te onderzoeken. Bovendien, aangezien de optische as van de omgekeerde microscoop vrij blijft, alle vormen van microscopie nog beschikbaar voor de gebruiker. Ten slotte alle vier motoren van de BAXS platform onafhankelijk is het mogelijk om zeer configureerbare spanning velden toegepast om het monster plaats. In vivo cellen en weefsels worden blootgesteld aan complexe anisotrope strekken die geschikter nagebootst in dit platform, in tegenstelling de traditionele eenassige stretching platform 7,13,15,18,19. Bovendien zijn de fysische eigenschappenvan de veldstam on the fly kan worden gewijzigd tijdens een experiment. Deze vaardigheden kan de gebruiker de cellulaire en weefselniveau reactie op een groot aantal zeer complexe anisotrope, tijdelijk en ruimtelijk variërende spanning actiegebieden. Dit artikel beschrijft de voordelen en beperkingen van de BAXS platform, alsmede het ontwerp, de werkingsprincipes en de experimentele gegevens voor enkele cel en hele weefsel experimenten.

Figuur 1. Overzicht van de BAXS platform. A) Bovenaanzicht van de BAXS platform met de vier voice coil motor. B) Gedetailleerd beeld van de petrischaal verwarmingselement gebruikt om cellen en weefsels bij 37 ° C. C te houden) Het platform kan op een omgekeerde microscoop worden gemonteerd live- cell imaging tijdens stretching experimenten.D) Gedetailleerd beeld van de voice coil motor; het bewegende deel van het platform. E) gedetailleerd beeld van de lineaire positionering podium waardoor verticale verplaatsing van de klem-systemen. F) Gedetailleerd beeld van de optische encoder die real-time positie van de motor zorgt voor de motion controller. G) Gedetailleerd beeld van de motion controller met de vier optische encoder ingangen en vermogens om de vier voice coil motoren.
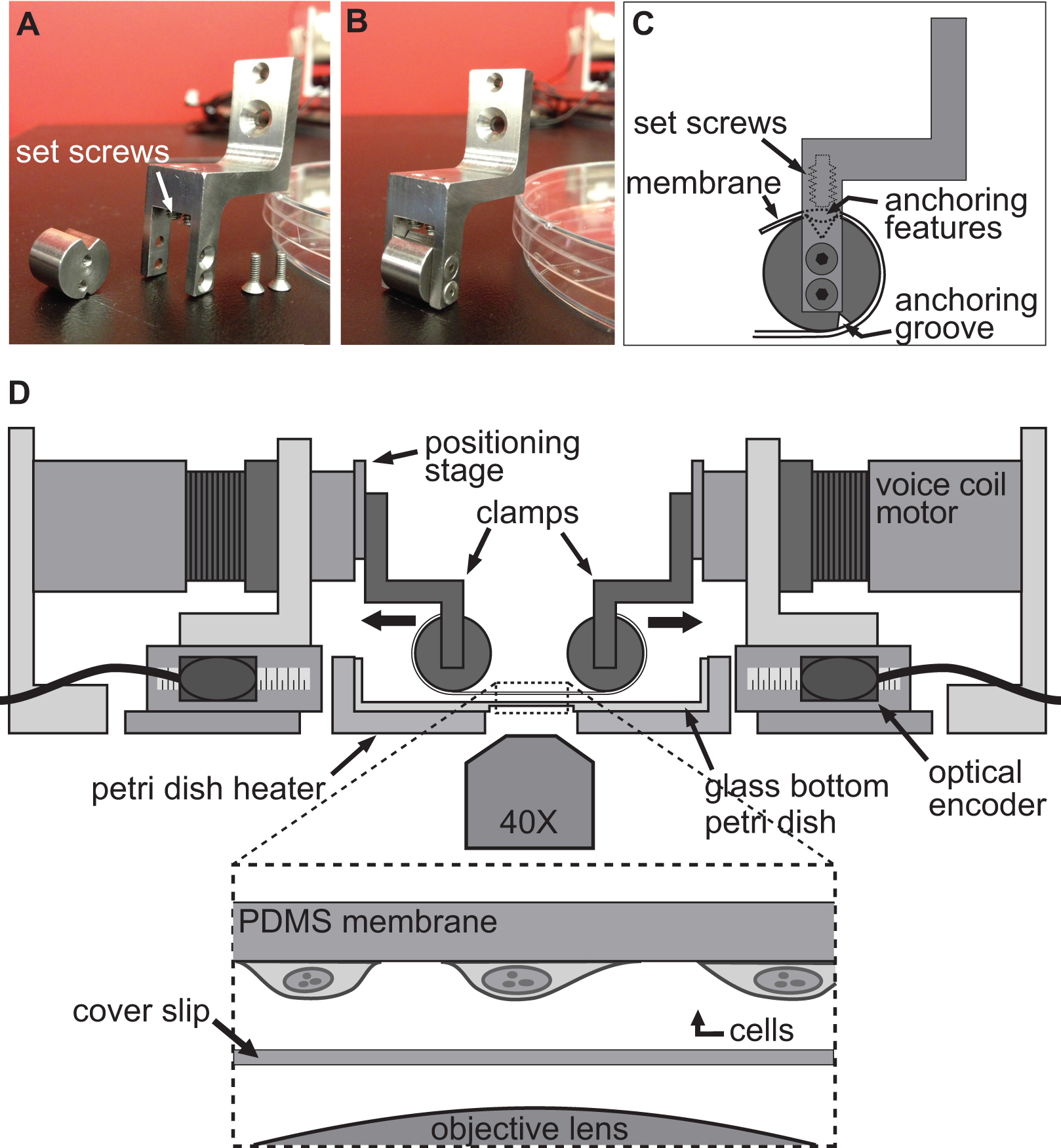
Figuur 2. Spansysteem voor mobiele stretching experimenten. AB) Foto de details van de klemmen worden gebruikt om de PDMS substraat hechten aan de spreekspoel motoren strekken. C) Het substraat wordt gewikkeld rond het cilindrische gedeelte van de klem met de verankering Features zitten in de groef aan de top. Dan is de ondergrond wordt bevestigd met behulp van de stelschroeven dat het substraat te duwen / verankering functies in de bovenste groef. D) Illustratie van de BAXS platform met de klemmen die de ondergrond op zijn plaats. De inzet toont een gedetailleerd aanzicht van het substraat met cellen verbonden te zitten boven een dekglas en het microscoopobjectief.
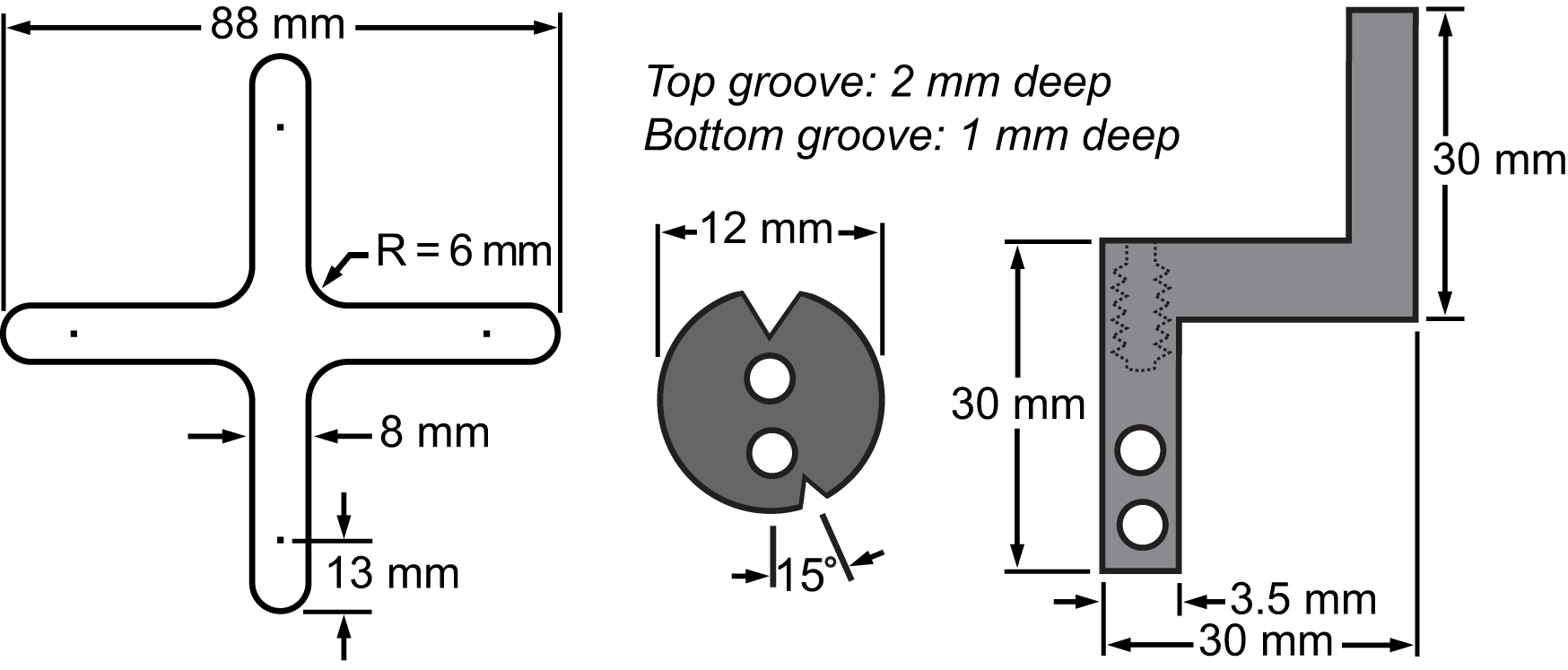
Figuur 3. Bill van materialen van het membraan en het spansysteem. Tekeningen toont de afmetingen van de belangrijkste onderdelen geïntegreerd in het biaxiale platform cel strekken experimenten.
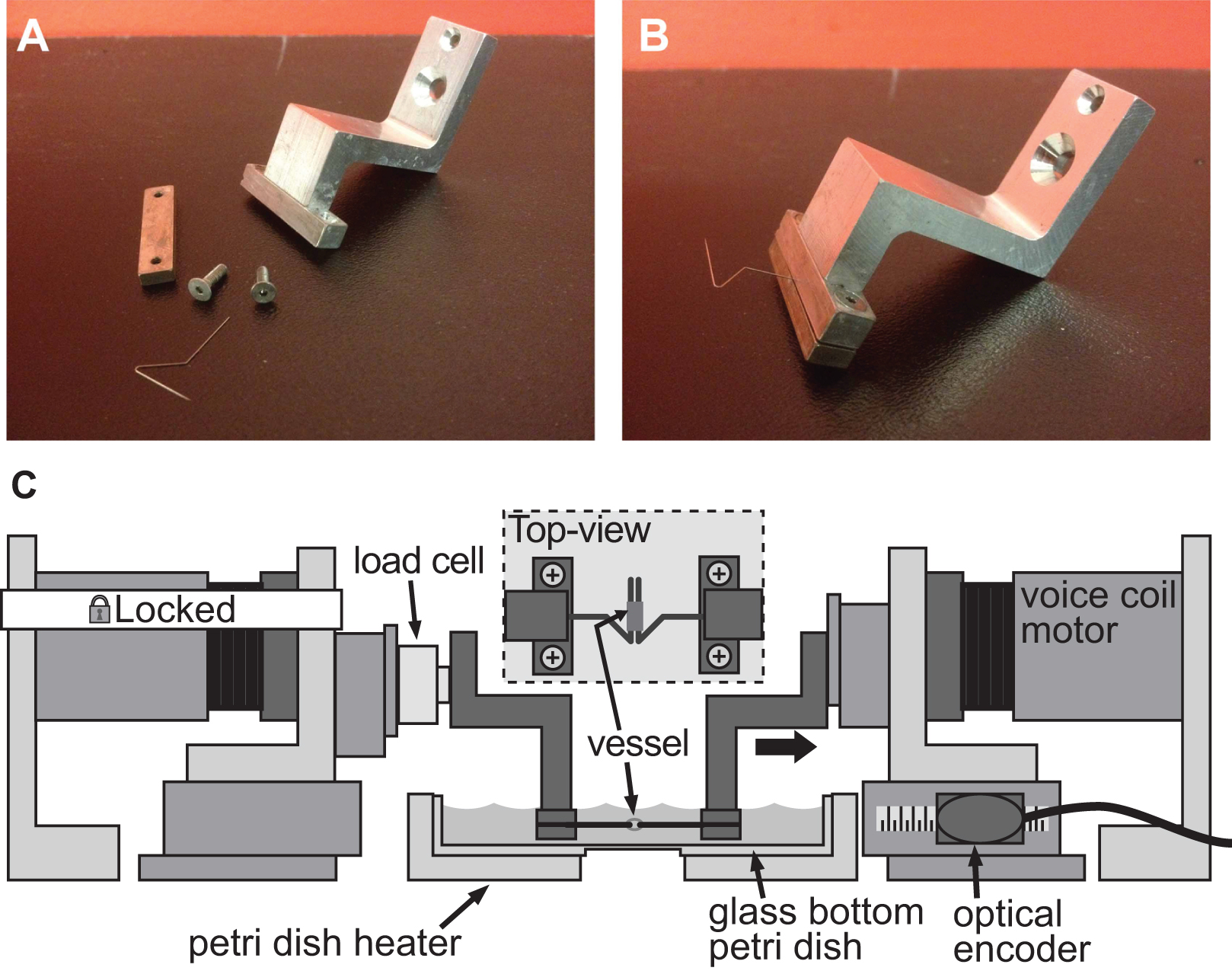
Figuur 4. Exruim van een klemsysteem voor stijfheid beoordeling van klein kaliber schepen. AB) Gedetailleerde foto's van het klemsysteem gebruikt om vervorming te induceren in een 1 mm diameter muis aorta. Roestvrij stalen pennen zijn zorgvuldig gevormd in open driehoeken, zodat het schip te glijden op beide pinnen. C) Illustratie van de BAXS platform met de klemmen houden van het vaartuig en een meetcel bevestigd tussen de vaste motor en de linker klem. De inzet toont een gedetailleerd bovenaanzicht van het vat gemonteerd op de pennen.
Protocol
Representative Results
Discussion
De BAXS platform gepresenteerde vergemakkelijkt talrijke experimenten in de studie van mechanobiology uit onderzoek van enkelvoudige cellen tot volledige weefsels. Bovendien, het platform is zeer flexibel en configureerbaar, waardoor talrijke mechanische stimulatie experimenten en multi-axiale trekproeven. Het platform maakt ook het onderhoud van cellen en weefsels in fysiologische omstandigheden en toelaten om gelijktijdig microscopie tijdens het spannen experimenten. De twee experimenten in de vorige paragrafen beschr…
Disclosures
The authors have nothing to disclose.
Acknowledgements
DT werd ondersteund door een postdoctorale studententijd van le Fonds de Recherche du Quebec-Nature et Technologies (FQRNT) en een MITACS Elevate Strategic Fellowship. CMC werd ondersteund door een postdoctorale studententijd van le Fonds de Recherche en Sante du Quebec (FRSQ) en de Ernest en Margaret Ford cardiologie begiftigd research fellowship van de Universiteit van Ottawa Heart Institute. EOB werd ondersteund door exploitatiesubsidies MOP80204 van het Canadese Institute for Health Research (CIHR) en T6335 van de Heart and Stroke Foundation van Ontario. De CIHR en Medtronic leveren collectief EOB met een peer-reviewed Research Chair (URC # 57093). AEP wordt gefinancierd door de Natural Sciences and Engineering Research Council (NSERC) Discovery Grant, een NSERC Discovery Accelerator Supplement en dankbaar erkent de steun van de Canada Research Chairs (CRC)-programma en een Early Onderzoeker Award van de provincie Ontario.
Materials
| PDMS | Ellsworth Adhesives | 184 SIL ELAST KIT 0.5KG | The ratio base to cross-linker used in this protocol is 20:1. Mix in a laminar hood to keep dust from contamining your |
| FluoSpheres fluorescent microspheres | Invitrogen | F8810 | Keep away from light. |
| Linear voice coil | Moticont | LVCM-051-051-01 | The motro comes in two pieces (magnet and coil). It has to be mounted on a ball bearing sytem to be functional. |
| Ball bearing slide | Edmund Optics | NT37-360 | Miniature and Small Linear Motion Ball Bearing Slides |
| linear positioning stage | Edmund Optics | 38-960 | Center Drive 1.25" Square Linear Translation Stages |
| optical encoder | GSI microE systems | Mercury II 1600S – 0.5um resolution | reflective incremental encoder. |
| motion controller | Galil | DMC-2143(DIN)-DC48 with AMP-20440 | 4 axis controller with a 4 axis amplifier |
| load cell | Honeywell | 31 low | miniature load cell with a range of 0-150 g |
| Insect minutiens pins (0,20mm) | Pin Service Austerlitz Insect pins | Stainless steel pins that are bended in an opened triangle shape | |
| SU-8 2050 | Micro Chem | SU-8 2050 | Permanent epoxy negative photoresist. Keep away from heat and light |
| Air-plasma treatment system | Glowresearch | Autoglow Oxygen Plasma System | |
| Rat-tail collagen | Invitrogen | A10483-01 | Collagen I, Rat Tail 5mg/ml |
| Hoechst 33342 | Invitrogen | R37605 | DNA-specific fluorescent dye. Keep in the fridge. |
| Kapton (Polyimide Film) Insulated Flexible Heaters | omega.ca | KHLV-0504/(10)-P | 28V flexible heaters; can be supplied with a 24V |
| 1/16 DIN Autotune Temperature and Process Controllers | omega.ca | CN63200-R1-LV | Temperature controller; supply 24 V. |
| DMEM culture medium | Hyclone | SH3024301 | Dulbecco’s Modified 30 Eagle Medium. Keep at 4 C |
| Penicillin-Streptomycin | Hyclone | SV30010 | Keep stock frozen. Keep working solution at 4 C. |
| Fetal bovine serum (FBS) | Hyclone | SH3039603C | Keep frozen. |
| Trypsin 0,05% | Hyclone | SH30236,02 | Keep frozen. Digestion of cell attachement proteins for subcultivation |
| Hepes | Wisent Inc | 330-050-EL | HEPES-buffered salt solution |
| NaCl | Fisher Scientific | BP358-1 | HEPES-buffered salt solution / Krebs physiological solution |
| KCl | Fisher Scientific | BP366-500 | HEPES-buffered salt solution / Krebs physiological solution |
| MgSO4 | Fisher Scientific | M65-500 | HEPES-buffered salt solution / Krebs physiological solution |
| CaCl2 | Fisher Scientific | C614-500 | HEPES-buffered salt solution / Krebs physiological solution |
| Dextrose | Fisher Scientific | BP220-1 | HEPES-buffered salt solution / Krebs physiological solution |
| NaHCO3 | Fisher Scientific | BP328-1 | Krebs physiological solution |
| KH2PO4 | Fisher Scientific | BP362-500 | Krebs physiological solution |
| Carbogen 95% O2/ 5% CO2 | Lindle | DIN:02154749 | Krebs physiological solution oxygenation |
| Nocodazole | Sigma | M1404 | Microtubules depolymerization agent |
| Cytochalasin-D | Sigma | C8273 | Actin filaments depolymerization agent |
| Anti-α-SMA-FITC | Sigma | F3777 | Used to stain and quantify smooth muscle cells content |
| Picrosirius red stain | Fluka | 43665 | Used to stain and quantify collagen content |
References
- Yim, E. K., Sheetz, M. P. Force-dependent cell signaling in stem cell differentiation. Stem Cell Res Ther. 3, (2012).
- Vogel, V., Sheetz, M. Local force and geometry sensing regulate cell functions. Nat Rev Mol Cell Biol. 7, 265-275 (2006).
- Wang, N., Tytell, J. D., Ingber, D. E. Mechanotransduction at a distance: mechanically coupling the extracellular matrix with the nucleus. Nat Rev Mol Cell Biol. 10, 75-82 (2009).
- Ingber, D. E. Mechanobiology and diseases of mechanotransduction. Ann Med. 35, 564-577 (2003).
- Janmey, P. A., Miller, R. T. Mechanisms of mechanical signaling in development and disease. J Cell Sci. 124, 9-18 (2011).
- Bukoreshtliev, N. V., Haase, K., Pelling, A. E. Mechanical cues in cellular signalling and communication. Cell Tissue Res. 352, 77-94 (2013).
- Chen, Y., Pasapera, A. M., Koretsky, A. P., Waterman, C. M. Orientation-specific responses to sustained uniaxial stretching in focal adhesion growth and turnover. Proc Natl Acad Sci USA. 110, (2013).
- Rosenzweig, D. H., Matmati, M., Khayat, G., Chaudhry, S., Hinz, B., Quinn, T. M. Culture of Primary Bovine Chondrocytes on a Continuously Expanding Surface Inhibits Dedifferentiation. Tissue Eng Part A. 18, 2466-2476 (2012).
- Balachandran, K., et al. Cyclic strain induces dual-mode endothelial-mesenchymal transformation of the cardiac valve. Proc Natl Acad Sci USA. 108, 19943-19948 (1994).
- Steward, R., Cheng, C. M., Ye, J., Bellin, R., LeDuc, P. Mechanical stretch and shear flow induced reorganization and recruitment of fibronectin in fibroblasts. Sci Rep. 1, (2011).
- Wang, D., Xie, Y., Yuan, B., Xu, J., Gong, P., Jiang, X. A stretching device for imaging real-time molecular dynamics of live cells adhering to elastic membranes on inverted microscopes during the entire process of the stretch. Integr Biol (Camb). 2, 288-293 (2010).
- Haskett, D., Johnson, G., Zhou, A., Utzinger, U., Van de Geest, J. Microstructural and biomechanical alterations of the human aorta as a function of age and location. Biomech Model Mechanobiol. 9, 725-736 (2010).
- Duprey, A., Khanafer, K., Schlicht, M., Avril, S., Williams, D., Berguer, R. In vitro characterisation of physiological and maximum elastic modulus of ascending thoracic aortic aneurysms using uniaxial tensile testing. Eur J Vasc Endovasc Surg. 39, 700-707 (2010).
- Tremblay, D., et al. A comparison of mechanical properties of materials used in aortic arch reconstruction. Ann Thorac Surg. 88, 1484-1491 (2009).
- Khanafer, K., Duprey, A., Zainal, M., Schlicht, M., Williams, D., Berguer, R. Determination of the elastic modulus of ascending thoracic aortic aneurysm at different ranges of pressure using uniaxial tensile testing. The Journal of thoracic and cardiovascular surgery. 142, 682-686 (2011).
- Van de Geest, J. P., Sacks, M. S., Vorp, D. A. The effects of aneurysm on the biaxial mechanical behavior of human abdominal aorta. J Biomech. 39, 1324-1334 (2006).
- Guolla, L., Bertrand, M., Haase, K., Pelling, A. E. Force transduction and strain dynamics in actin stress fibres in response to nanonewton forces. J Cell Sci. 125, 603-613 (2012).
- Wang, J. H., Goldschmidt-Clermont, P., Wille, J., Yin, F. C. Specificity of endothelial cell reorientation in response to cyclic mechanical stretching. J Biomech. 34, 1563-1572 (2001).
- Jungbauer, S., Gao, H., Spatz, J. P., Kemkemer, R. Two characteristic regimes in frequency-dependent dynamic reorientation of fibroblasts on cyclically stretched substrates. Biophys J. 95, 3470-3478 (2008).
- Dahl, K. N., Ribeiro, A. J. S., Lammerding, J. Nuclear shape, mechanics, and mechanotransduction. Circ Res. 102, 1307-1318 (2008).
- Shivashankar, G. V. Mechanosignaling to the cell nucleus and gene regulation. Annu Rev Biophys. 40, 361-378 (2011).
- Chiquet, M., Gelman, L., Lutz, R., Maier, S. From mechanotransduction to extracellular matrix gene expression in fibroblasts. Biochim Biophys Acta. 1793, 911-920 (2009).
- Sullivan, T., et al. Loss of A-type lamin expression compromises nuclear envelope integrity leading to muscular dystrophy. J Cell Biol. 147, 913-920 (1999).
- Lammerding, J., et al. Lamin A/C deficiency causes defective nuclear mechanics and mechanotransduction. J Clin Invest. 113, 370-378 (2004).
- Tremblay, D., Andrzejewski, L., Leclerc, A., Pelling, A. E. Actin and microtubules play distinct roles in governing the anisotropic deformation of cell nuclei in response to substrate strain. Cytoskeleton. , (2013).
- Cuerrier, C. M., et al. Chronic over-expression of heat shock protein 27 attenuates atherogenesis and enhances plaque remodeling: a combined histological and mechanical assessment of aortic lesions. PLoS ONE. 8, (2013).
- Tremblay, D., Cartier, R., Mongrain, R., Leask, R. L. Regional dependency of the vascular smooth muscle cell contribution to the mechanical properties of the pig ascending aortic tissue. J Biomech. 43, 2448-2451 (2010).
- Barker, A. J., Lanning, C., Shandas, R. Quantification of hemodynamic wall shear stress in patients with bicuspid aortic valve using phase-contrast MRI. Ann Biomed Eng. 38, 788-800 (2010).
- Haga, J. H., Li, Y. S. J., Chien, S. Molecular basis of the effects of mechanical stretch on vascular smooth muscle cells. J Biomech. 40, 947-960 (2007).
- Frydrychowicz, A., et al. Time-resolved magnetic resonance angiography and flow-sensitive 4-dimensional magnetic resonance imaging at 3 Tesla for blood flow and wall shear stress analysis. The Journal of thoracic and cardiovascular surgery. 136, 400-407 (2008).
- Boccafoschi, F., Mosca, C., Bosetti, M., Cannas, M. The role of mechanical stretching in the activation and localization of adhesion proteins and related intracellular molecules. J Cell Biochem. 112, 1403-1409 (2011).
- Yang, G., Crawford, R. C., Wang, J. H. C. Proliferation and collagen production of human patellar tendon fibroblasts in response to cyclic uniaxial stretching in serum-free conditions. J Biomech. 37, 1543-1550 (2004).
- Goldyn, A. M., Rioja, B. A., Spatz, J. P., Ballestrem, C., Kemkemer, R. Force-induced cell polarisation is linked to RhoA-driven microtubule-independent focal-adhesion sliding. J Cell Sci. 122, 3644-3651 (2009).
- Heo, S. J., et al. Fiber stretch and reorientation modulates mesenchymal stem cell morphology and fibrous gene expression on oriented nanofibrous microenvironments. Ann Biomed Eng. 39, 2780-2790 (2011).
- Zdero, R., et al. Linear and torsional mechanical characteristics of intact and reconstructed scapholunate ligaments. J Biomech Eng. 131, (2009).

