Una Plataforma Novela Estiramiento para Aplicaciones en Celular y Tisular Mecanobiología
Summary
Se presenta en este artículo una plataforma novela de estiramiento que se puede utilizar para investigar las respuestas de células individuales a complejo deformación mecánica biaxial anisotrópico y cuantificar las propiedades mecánicas de los tejidos biológicos.
Abstract
Las herramientas que permiten la aplicación de fuerzas mecánicas a las células y tejidos o que pueden cuantificar las propiedades mecánicas de los tejidos biológicos han contribuido de manera espectacular a la comprensión de mecanobiología básica. Estas técnicas se han utilizado ampliamente para demostrar cómo el inicio y la progresión de diversas enfermedades están muy influenciados por las señales mecánicas. Este artículo presenta un estiramiento biaxial (BAXS) plataforma multifuncional que puede estimular mecánicamente las células individuales o cuantificar la rigidez mecánica de los tejidos. La plataforma BAXS consta de cuatro motores de bobina de voz que pueden ser controlados de forma independiente. Única células pueden ser cultivadas en un sustrato flexible que se puede acoplar a los motores que permiten una para exponer las células a campos de tensiones complejas, dinámicas y espacialmente variables. Por el contrario, mediante la incorporación de una célula de carga de fuerza, se puede cuantificar también las propiedades mecánicas de los tejidos primarios como los que están expuestos a los ciclos de deformación.En ambos casos, un conjunto adecuado de abrazaderas debe ser diseñado y montado en los motores de la plataforma BAXS con el fin de sostener firmemente el sustrato flexible o el tejido de interés. La plataforma BAXS se puede montar en un microscopio invertido para llevar a cabo simultánea luz transmitida y / o imágenes de fluorescencia para examinar la respuesta estructural o bioquímica de la muestra durante los experimentos de estiramiento. Este artículo proporciona detalles experimentales del diseño y el uso de la plataforma BAXS y presenta los resultados de una sola célula y estudios de todo el tejido. La plataforma BAXS se utilizó para medir la deformación de los núcleos en células individuales de mioblastos de ratón en respuesta al sustrato cepa y para medir la rigidez de las aortas aisladas de ratón. La plataforma BAXS es una herramienta versátil que se puede combinar con diversos microscopías óptica con el fin de proporcionar nuevos conocimientos mecanobiológicos en los niveles de tejido sub-celulares, celular y conjunto.
Introduction
El microambiente mecánica juega un papel importante en muchas funciones celulares tales como proliferación, migración, y diferenciación, que tienen un impacto profundo en el desarrollo y la homeostasis de los tejidos y también en enfermedades 1-6. A través de los años, una multitud de herramientas experimentales se han utilizado para estimular mecánicamente las células o tejidos y medir las propiedades mecánicas de los tejidos biológicos con el objetivo de aumentar la comprensión de mecanobiología básica y el estudio de la aparición y progresión de enfermedades de 6-17. Sin embargo, hay que a menudo se basan en varios dispositivos experimentales diferentes con el fin de lograr los objetivos de un estudio en particular. En este artículo se presenta un solo biaxial plataforma, multi-funcional, que se extiende (BAXS) que permite que los estudios que investigan el papel que las propiedades mecánicas y las fuerzas mecánicas juegan en biología en la sub-celular a escalas de longitud tejido enteros. La plataforma BAXS no sólo permite la quantification de las propiedades mecánicas de los tejidos aislados, sino que también facilita la capacidad de aplicar campos de deformación simples, complejos, y dinámicas a las células vivas a fin de comprender sus respuestas al estiramiento que se produce in vivo. La plataforma BAXS también mantiene la capacidad de realizar la microscopía de células vivas durante las pruebas mecánicas y perturbaciones en las células y tejidos.
La plataforma BAXS es un aparato construido a la medida que se puede utilizar para investigar el efecto de la deformación del sustrato a nivel celular y realizar ensayos de tracción sobre los tejidos biológicos (Figura 1A). Un calentador de aluminio se fabricó para dar cabida a un plato estándar de 10 cm de Petri y mantener las soluciones fisiológicas a 37 ° C usando un controlador de temperatura y calentadores de Kapton (Figura 1B). Esta plataforma BAXS se puede integrar en un contraste de fase invertida y / o un microscopio de fluorescencia y permite la formación de imágenes simultánea (Figura 1C).En breve, la plataforma BAXS consta de cuatro motores de bobina de voz lineales de los cuales las partes móviles están montados en miniatura de bolas de movimiento lineal diapositivas del rodamiento orientadas a lo largo de dos ejes perpendiculares (Figura 1D). Una etapa de posicionamiento lineal está montado en cada uno de los cuatro motores para permitir el movimiento vertical del sistema de sujeción que se utilizará (Figura 1E). La posición de cada motor se controla mediante un codificador óptico con una resolución de 500 nm (Figura 1F). Los cuatro motores son controlados de manera independiente con un controlador de movimiento que emplea realimentación del codificador óptico para comandos de movimiento (Figura 1G) de ejecutar. Una interfaz de LabVIEW proporciona un control total sobre la magnitud de desplazamiento, velocidad y aceleración de cada motor con el fin de generar la deformación completamente personalizable, estático y dinámico, de las células o muestras de tejido.
La técnica utilizada para inducir una deformación en las células se consigue simplemente allowing de células se adhieran firmemente a un sustrato flexible y transparente y luego se extiende este sustrato utilizando los cuatro motores de la plataforma BAXS. La plataforma BAXS permite el montaje de cualquier conjunto de diseño personalizado de pinzas para sujetar el sustrato en los motores de bobina de voz. Para este fin, se diseñó un conjunto de abrazaderas a la que un sustrato flexible y transparente, hecha de polidimetilsiloxano (PDMS), puede ser conectado al mismo (Figuras 2A-C y la Figura 3). Como las abrazaderas estarán expuestos a soluciones fisiológicas, todas las partes se mecanizan a partir de acero inoxidable para permitir la esterilización. Estas abrazaderas han sido cuidadosamente diseñados para llevar el sustrato lo más cerca posible al objetivo del microscopio para mejorar la calidad de imagen al tiempo que minimiza la presión sobre el sustrato durante el estiramiento (Figura 2D).
La misma plataforma BAXS también se puede utilizar para cuantificar la rigidez de pequeñas muestras de tejido, utilizando un conjunto adecuado de abrazaderas con ADAPTed soportes para las muestras de tejido y una célula de carga para monitorizar fuerzas. Varios enfoques pueden ser tomados para montar un tejido a los motores de la plataforma BAXS; en este caso los minutiens de insectos de acero inoxidable pines pueden conectar a través de la apertura de los tejidos vasculares con el fin de realizar ensayos de tracción (Figuras 4A-B). Alternativamente, para tejidos gruesos sin una abertura natural, bordes de tejido puede ser celebrada en su posición con las abrazaderas unidas a los motores de bobina de voz o pegados a las pequeñas placas de vidrio con pegamento biológico y unidos a los motores con las abrazaderas. Con el fin de realizar las pruebas de tracción se requiere una célula de carga en miniatura y se puede incorporar fácilmente en los motores de la plataforma BAXS y se utiliza para medir la fuerza que actúa sobre el tejido durante un ciclo de estiramiento (Figura 4C). Como la plataforma BAXS se compone de cuatro motores, la introducción de una segunda célula de carga permite a uno realizar ensayos de tracción a lo largo de dos direcciones ortogonales. Esta capacidad permite a uno quantify la rigidez mecánica de un solo tejido a lo largo de dos direcciones perpendiculares durante el mismo experimento.
Es importante destacar que, en todas las configuraciones, las células o muestras de tejido de interés se mantienen siempre en un baño de temperatura controlada que es accesible para el usuario. Esta capacidad permite la introducción de agentes farmacológicos durante el estiramiento de la muestra con el fin de examinar la respuesta temporal de la muestra. Además, como el eje óptico del microscopio invertido permanece sin obstrucciones, todas las formas de microscopía están todavía disponibles para el usuario. Por último, como todos los cuatro motores de la plataforma BAXS son independientes, es posible aplicar campos de deformación altamente configurables para la muestra de interés. In vivo células y tejidos están expuestos a complejo y anisotrópico de estiramiento que puede ser imitado más apropiadamente en esta plataforma en oposición al tradicional estirado uniaxial 7,13,15,18,19 plataforma. Además, las características físicasdel campo de deformación se puede cambiar sobre la marcha durante un experimento. Estas capacidades permiten al usuario examinar la respuesta celular y el nivel de tejido a una amplia serie de altamente complejo, anisotrópico, temporalmente, y campos de deformación espacialmente diferentes. En este artículo se describen las ventajas y limitaciones de la plataforma BAXS así como su diseño, principios de funcionamiento, y los detalles experimentales para una sola célula y los experimentos de todo el tejido.

Figura 1. Visión general de la plataforma BAXS. A) Vista superior de la plataforma BAXS mostrando los cuatro motores de bobina de voz. B) Cuadro detallado del calentador de placa de Petri se utiliza para mantener las células y los tejidos a 37 º C. C) La plataforma se puede montar en un microscopio invertido para tocar en vivo- imágenes de células durante los experimentos de estiramiento.D) Cuadro detallado del motor de bobina de voz; la parte móvil de la plataforma. E) Cuadro detallado de la etapa de posicionamiento lineal que permite el desplazamiento vertical de los sistemas de sujeción. F) Cuadro detallado del codificador óptico que proporciona la posición en tiempo real del motor para el controlador de movimiento. G) Cuadro detallado del controlador de movimiento que muestra las cuatro entradas de encoder ópticos y salidas de potencia a los cuatro motores de bobina de voz.
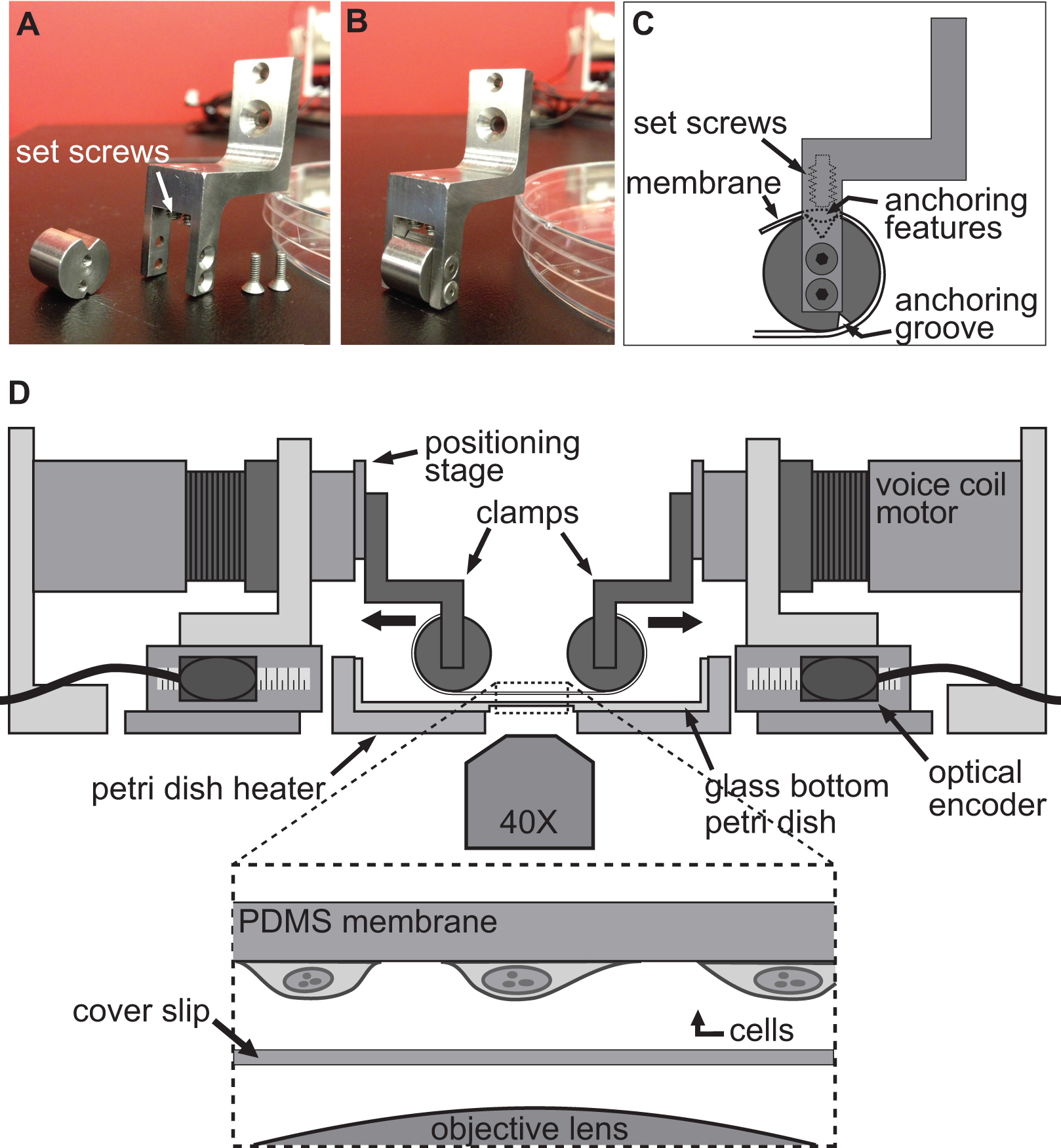
Figura 2. Sistema de sujeción para los experimentos de células de estiramiento. AB) imágenes que muestran los detalles de las abrazaderas utilizadas para unir el sustrato de PDMS a los motores de bobina de voz para el estiramiento. C) El sustrato se envuelve alrededor de la parte cilíndrica de la abrazadera con su Featur anclajees que se sienta en la ranura en la parte superior. A continuación, el sustrato se fija con los tornillos que empujan el sustrato / anclaje características en la ranura superior. D) Ilustración de la plataforma BAXS con las abrazaderas que sostiene el sustrato en su lugar. El recuadro muestra una vista detallada del sustrato con las células unidas a él sentado justo por encima de una hoja de cubierta y el objetivo del microscopio.
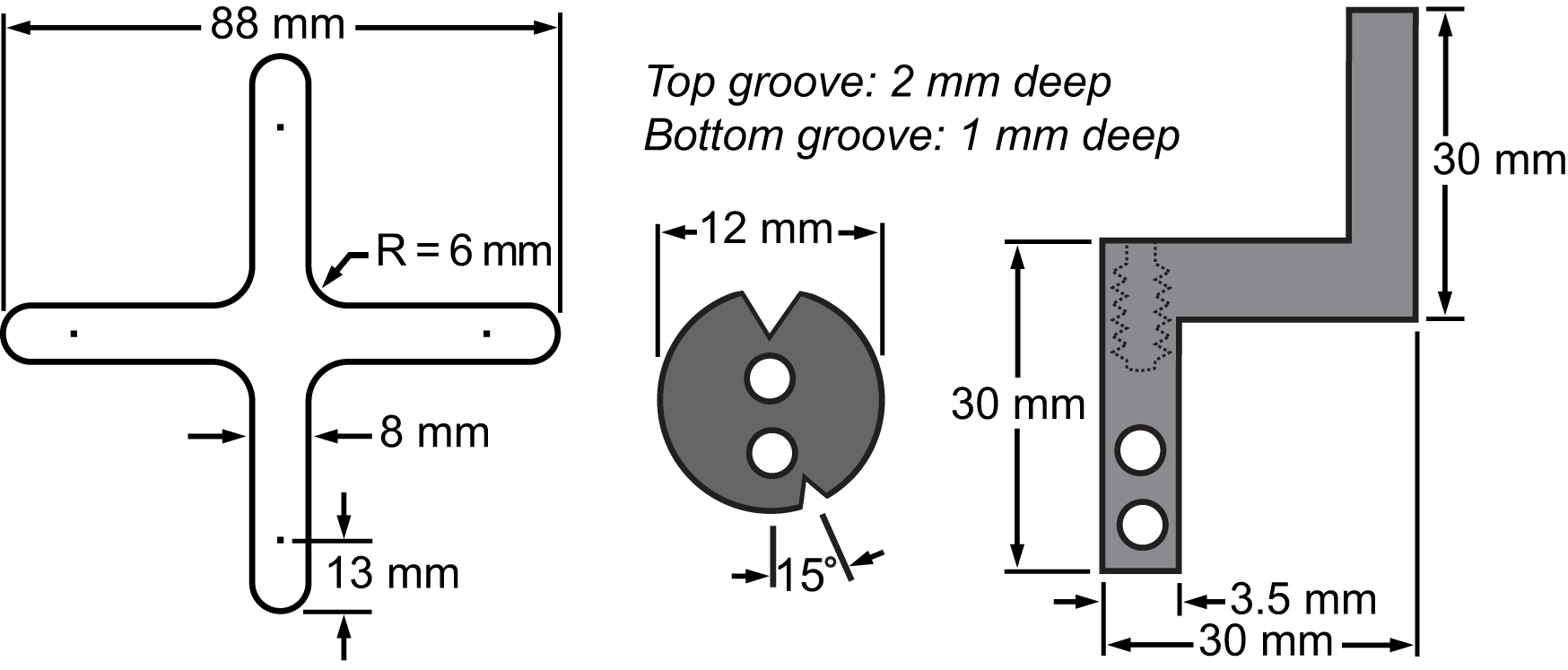
Figura 3. Lista de materiales de la membrana y su sistema de sujeción. Dibujos que muestran las dimensiones de las partes principales integrados a la plataforma de dos ejes para llevar a cabo experimentos de células de estiramiento.
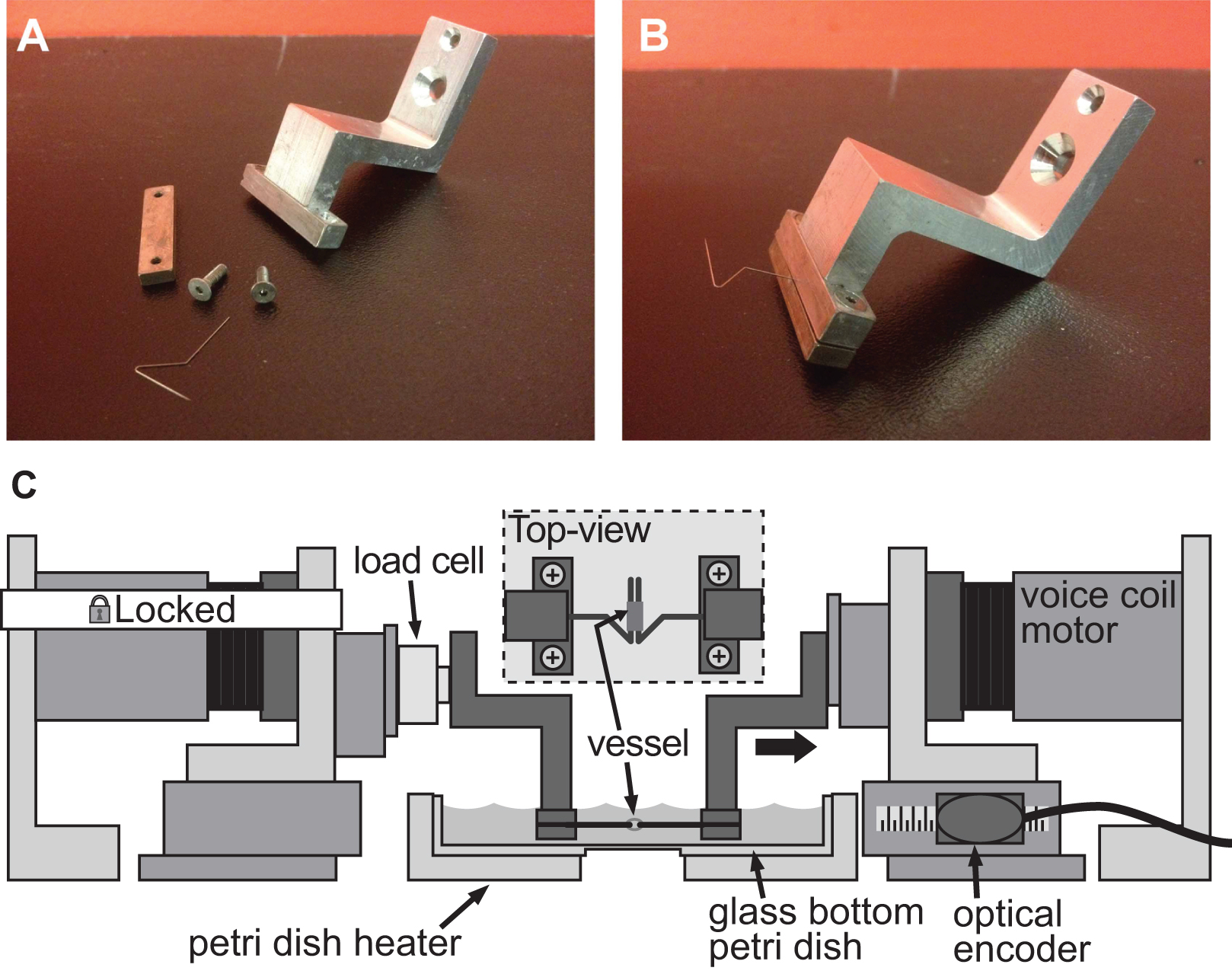
Figura 4. Explo de un sistema de sujeción para la evaluación de la rigidez de los vasos de pequeño calibre. AB) imágenes detalladas del sistema de sujeción se utiliza para inducir la deformación en un 1 mm de diámetro de la aorta del ratón. Pasadores de acero inoxidable fueron cuidadosamente en forma en triángulos abiertos para permitir que el buque se deslice en ambas clavijas. C) Ilustración de la plataforma BAXS con las abrazaderas de la celebración de la embarcación y una célula de carga conectada entre el motor fijo y la pinza izquierda. El recuadro muestra una vista superior detallada del buque montado en las patillas.
Protocol
Representative Results
Discussion
La plataforma BAXS presentado aquí facilita numerosos experimentos en el estudio de mecanobiología, de las investigaciones de las células individuales a los tejidos enteros. Además, la plataforma es altamente flexible y configurable, permitiendo numerosos experimentos de estimulación mecánicas y de ensayo de tracción multiaxial. La plataforma también permite el mantenimiento de células y tejidos en condiciones fisiológicas y permite para microscopía simultánea durante los experimentos de estiramiento. Los do…
Disclosures
The authors have nothing to disclose.
Acknowledgements
DT fue apoyado por una beca postdoctoral del Le Fonds de recherche du Québec-Nature et Tecnologías (FQRNT) y un Elevate Estratégico Fellowship MITACS. CMC fue apoyado por una beca postdoctoral de Le Fonds de Recherche en Santé du Québec (FRSQ) y el Ernest y Margaret Ford cardiología dotado beca de investigación de la Universidad de Ottawa Heart Institute. EOB fue apoyada por subvenciones de funcionamiento MOP80204 del Instituto Canadiense de Investigación en Salud (CIHR) y T6335 de la Heart and Stroke Foundation de Ontario. El CIHR y Medtronic proporcionan colectivamente EOB con una Cátedra de investigación revisada por pares (URC # 57093). AEP es financiada por las Ciencias Naturales e Ingeniería de Investigación (NSERC) Descubrimiento Grant, un Suplemento NSERC Discovery Accelerator y agradecidamente reconoce el apoyo de las Cátedras de Investigación de Canadá programa (CRC) y el Premio Investigador Temprana de la Provincia de Ontario.
Materials
| PDMS | Ellsworth Adhesives | 184 SIL ELAST KIT 0.5KG | The ratio base to cross-linker used in this protocol is 20:1. Mix in a laminar hood to keep dust from contamining your |
| FluoSpheres fluorescent microspheres | Invitrogen | F8810 | Keep away from light. |
| Linear voice coil | Moticont | LVCM-051-051-01 | The motro comes in two pieces (magnet and coil). It has to be mounted on a ball bearing sytem to be functional. |
| Ball bearing slide | Edmund Optics | NT37-360 | Miniature and Small Linear Motion Ball Bearing Slides |
| linear positioning stage | Edmund Optics | 38-960 | Center Drive 1.25" Square Linear Translation Stages |
| optical encoder | GSI microE systems | Mercury II 1600S – 0.5um resolution | reflective incremental encoder. |
| motion controller | Galil | DMC-2143(DIN)-DC48 with AMP-20440 | 4 axis controller with a 4 axis amplifier |
| load cell | Honeywell | 31 low | miniature load cell with a range of 0-150 g |
| Insect minutiens pins (0,20mm) | Pin Service Austerlitz Insect pins | Stainless steel pins that are bended in an opened triangle shape | |
| SU-8 2050 | Micro Chem | SU-8 2050 | Permanent epoxy negative photoresist. Keep away from heat and light |
| Air-plasma treatment system | Glowresearch | Autoglow Oxygen Plasma System | |
| Rat-tail collagen | Invitrogen | A10483-01 | Collagen I, Rat Tail 5mg/ml |
| Hoechst 33342 | Invitrogen | R37605 | DNA-specific fluorescent dye. Keep in the fridge. |
| Kapton (Polyimide Film) Insulated Flexible Heaters | omega.ca | KHLV-0504/(10)-P | 28V flexible heaters; can be supplied with a 24V |
| 1/16 DIN Autotune Temperature and Process Controllers | omega.ca | CN63200-R1-LV | Temperature controller; supply 24 V. |
| DMEM culture medium | Hyclone | SH3024301 | Dulbecco’s Modified 30 Eagle Medium. Keep at 4 C |
| Penicillin-Streptomycin | Hyclone | SV30010 | Keep stock frozen. Keep working solution at 4 C. |
| Fetal bovine serum (FBS) | Hyclone | SH3039603C | Keep frozen. |
| Trypsin 0,05% | Hyclone | SH30236,02 | Keep frozen. Digestion of cell attachement proteins for subcultivation |
| Hepes | Wisent Inc | 330-050-EL | HEPES-buffered salt solution |
| NaCl | Fisher Scientific | BP358-1 | HEPES-buffered salt solution / Krebs physiological solution |
| KCl | Fisher Scientific | BP366-500 | HEPES-buffered salt solution / Krebs physiological solution |
| MgSO4 | Fisher Scientific | M65-500 | HEPES-buffered salt solution / Krebs physiological solution |
| CaCl2 | Fisher Scientific | C614-500 | HEPES-buffered salt solution / Krebs physiological solution |
| Dextrose | Fisher Scientific | BP220-1 | HEPES-buffered salt solution / Krebs physiological solution |
| NaHCO3 | Fisher Scientific | BP328-1 | Krebs physiological solution |
| KH2PO4 | Fisher Scientific | BP362-500 | Krebs physiological solution |
| Carbogen 95% O2/ 5% CO2 | Lindle | DIN:02154749 | Krebs physiological solution oxygenation |
| Nocodazole | Sigma | M1404 | Microtubules depolymerization agent |
| Cytochalasin-D | Sigma | C8273 | Actin filaments depolymerization agent |
| Anti-α-SMA-FITC | Sigma | F3777 | Used to stain and quantify smooth muscle cells content |
| Picrosirius red stain | Fluka | 43665 | Used to stain and quantify collagen content |
References
- Yim, E. K., Sheetz, M. P. Force-dependent cell signaling in stem cell differentiation. Stem Cell Res Ther. 3, (2012).
- Vogel, V., Sheetz, M. Local force and geometry sensing regulate cell functions. Nat Rev Mol Cell Biol. 7, 265-275 (2006).
- Wang, N., Tytell, J. D., Ingber, D. E. Mechanotransduction at a distance: mechanically coupling the extracellular matrix with the nucleus. Nat Rev Mol Cell Biol. 10, 75-82 (2009).
- Ingber, D. E. Mechanobiology and diseases of mechanotransduction. Ann Med. 35, 564-577 (2003).
- Janmey, P. A., Miller, R. T. Mechanisms of mechanical signaling in development and disease. J Cell Sci. 124, 9-18 (2011).
- Bukoreshtliev, N. V., Haase, K., Pelling, A. E. Mechanical cues in cellular signalling and communication. Cell Tissue Res. 352, 77-94 (2013).
- Chen, Y., Pasapera, A. M., Koretsky, A. P., Waterman, C. M. Orientation-specific responses to sustained uniaxial stretching in focal adhesion growth and turnover. Proc Natl Acad Sci USA. 110, (2013).
- Rosenzweig, D. H., Matmati, M., Khayat, G., Chaudhry, S., Hinz, B., Quinn, T. M. Culture of Primary Bovine Chondrocytes on a Continuously Expanding Surface Inhibits Dedifferentiation. Tissue Eng Part A. 18, 2466-2476 (2012).
- Balachandran, K., et al. Cyclic strain induces dual-mode endothelial-mesenchymal transformation of the cardiac valve. Proc Natl Acad Sci USA. 108, 19943-19948 (1994).
- Steward, R., Cheng, C. M., Ye, J., Bellin, R., LeDuc, P. Mechanical stretch and shear flow induced reorganization and recruitment of fibronectin in fibroblasts. Sci Rep. 1, (2011).
- Wang, D., Xie, Y., Yuan, B., Xu, J., Gong, P., Jiang, X. A stretching device for imaging real-time molecular dynamics of live cells adhering to elastic membranes on inverted microscopes during the entire process of the stretch. Integr Biol (Camb). 2, 288-293 (2010).
- Haskett, D., Johnson, G., Zhou, A., Utzinger, U., Van de Geest, J. Microstructural and biomechanical alterations of the human aorta as a function of age and location. Biomech Model Mechanobiol. 9, 725-736 (2010).
- Duprey, A., Khanafer, K., Schlicht, M., Avril, S., Williams, D., Berguer, R. In vitro characterisation of physiological and maximum elastic modulus of ascending thoracic aortic aneurysms using uniaxial tensile testing. Eur J Vasc Endovasc Surg. 39, 700-707 (2010).
- Tremblay, D., et al. A comparison of mechanical properties of materials used in aortic arch reconstruction. Ann Thorac Surg. 88, 1484-1491 (2009).
- Khanafer, K., Duprey, A., Zainal, M., Schlicht, M., Williams, D., Berguer, R. Determination of the elastic modulus of ascending thoracic aortic aneurysm at different ranges of pressure using uniaxial tensile testing. The Journal of thoracic and cardiovascular surgery. 142, 682-686 (2011).
- Van de Geest, J. P., Sacks, M. S., Vorp, D. A. The effects of aneurysm on the biaxial mechanical behavior of human abdominal aorta. J Biomech. 39, 1324-1334 (2006).
- Guolla, L., Bertrand, M., Haase, K., Pelling, A. E. Force transduction and strain dynamics in actin stress fibres in response to nanonewton forces. J Cell Sci. 125, 603-613 (2012).
- Wang, J. H., Goldschmidt-Clermont, P., Wille, J., Yin, F. C. Specificity of endothelial cell reorientation in response to cyclic mechanical stretching. J Biomech. 34, 1563-1572 (2001).
- Jungbauer, S., Gao, H., Spatz, J. P., Kemkemer, R. Two characteristic regimes in frequency-dependent dynamic reorientation of fibroblasts on cyclically stretched substrates. Biophys J. 95, 3470-3478 (2008).
- Dahl, K. N., Ribeiro, A. J. S., Lammerding, J. Nuclear shape, mechanics, and mechanotransduction. Circ Res. 102, 1307-1318 (2008).
- Shivashankar, G. V. Mechanosignaling to the cell nucleus and gene regulation. Annu Rev Biophys. 40, 361-378 (2011).
- Chiquet, M., Gelman, L., Lutz, R., Maier, S. From mechanotransduction to extracellular matrix gene expression in fibroblasts. Biochim Biophys Acta. 1793, 911-920 (2009).
- Sullivan, T., et al. Loss of A-type lamin expression compromises nuclear envelope integrity leading to muscular dystrophy. J Cell Biol. 147, 913-920 (1999).
- Lammerding, J., et al. Lamin A/C deficiency causes defective nuclear mechanics and mechanotransduction. J Clin Invest. 113, 370-378 (2004).
- Tremblay, D., Andrzejewski, L., Leclerc, A., Pelling, A. E. Actin and microtubules play distinct roles in governing the anisotropic deformation of cell nuclei in response to substrate strain. Cytoskeleton. , (2013).
- Cuerrier, C. M., et al. Chronic over-expression of heat shock protein 27 attenuates atherogenesis and enhances plaque remodeling: a combined histological and mechanical assessment of aortic lesions. PLoS ONE. 8, (2013).
- Tremblay, D., Cartier, R., Mongrain, R., Leask, R. L. Regional dependency of the vascular smooth muscle cell contribution to the mechanical properties of the pig ascending aortic tissue. J Biomech. 43, 2448-2451 (2010).
- Barker, A. J., Lanning, C., Shandas, R. Quantification of hemodynamic wall shear stress in patients with bicuspid aortic valve using phase-contrast MRI. Ann Biomed Eng. 38, 788-800 (2010).
- Haga, J. H., Li, Y. S. J., Chien, S. Molecular basis of the effects of mechanical stretch on vascular smooth muscle cells. J Biomech. 40, 947-960 (2007).
- Frydrychowicz, A., et al. Time-resolved magnetic resonance angiography and flow-sensitive 4-dimensional magnetic resonance imaging at 3 Tesla for blood flow and wall shear stress analysis. The Journal of thoracic and cardiovascular surgery. 136, 400-407 (2008).
- Boccafoschi, F., Mosca, C., Bosetti, M., Cannas, M. The role of mechanical stretching in the activation and localization of adhesion proteins and related intracellular molecules. J Cell Biochem. 112, 1403-1409 (2011).
- Yang, G., Crawford, R. C., Wang, J. H. C. Proliferation and collagen production of human patellar tendon fibroblasts in response to cyclic uniaxial stretching in serum-free conditions. J Biomech. 37, 1543-1550 (2004).
- Goldyn, A. M., Rioja, B. A., Spatz, J. P., Ballestrem, C., Kemkemer, R. Force-induced cell polarisation is linked to RhoA-driven microtubule-independent focal-adhesion sliding. J Cell Sci. 122, 3644-3651 (2009).
- Heo, S. J., et al. Fiber stretch and reorientation modulates mesenchymal stem cell morphology and fibrous gene expression on oriented nanofibrous microenvironments. Ann Biomed Eng. 39, 2780-2790 (2011).
- Zdero, R., et al. Linear and torsional mechanical characteristics of intact and reconstructed scapholunate ligaments. J Biomech Eng. 131, (2009).

