세포와 조직 Mechanobiology의 응용 프로그램에 대한 새로운 스트레칭 플랫폼
Summary
우리는이 문서에서 복잡한 이방성 축 기계적 변형에 하나의 세포 반응을 조사하고 생체 조직의 기계적 특성을 정량화하는 데 사용할 수있는 새로운 스트레칭 플랫폼을 제시한다.
Abstract
세포와 조직에 기계적인 힘의 응용 프로그램이나 그 수있는 도구는 생물학적 조직의 기계적 특성이 기본 mechanobiology의 이해에 크게 기여 정량화 할 수 있습니다. 이 기술은 광범위하게 각종 질병의 발병과 진행이 크게 기계적 신호에 의해 영향을하는 방법을 설명하는 데 사용되었다. 이 문서는 기계적으로 하나의 세포를 자극하거나 조직의 기계적 강도를 정량화 할 수 있습니다 다기능 축 연신 (BAXS) 플랫폼을 제공합니다. BAXS 플랫폼은 독립적으로 제어 할 수있는 네 개의 보이스 코일 모터로 구성되어 있습니다. 단일 세포는 하나, 복잡한 동적 및 공간적 변화 스트레인 필드에 세포를 노출 할 수 있도록 모터에 부착 될 수있는 유연한 기판상에서 배양 될 수있다. 반대로, 로드셀을 통합하여, 하나는 이들이 변형 사이클에 노출 될 때 기본 조직의 기계적 특성을 정량화 할 수있다.두 경우 모두, 클램프의 적절한 세트를 설계해야하고 단단히 유연성 기판 또는 그 조직을 유지하기 위하여 BAXS 플랫폼 모터에 장착. BAXS 플랫폼은 연신 실험 동안 샘플의 구조적 또는 생화학 적 반응을 조사하기 위해 동시 투과광 및 / 또는 형광 이미징을 수행하는 도립 현미경에 장착 될 수있다. 이 문서에서는 BAXS 플랫폼의 디자인과 사용의 실험 세부 사항을 제공하고 단일 셀 및 전체 조직 연구에 대한 결과를 제시한다. BAXS 플랫폼은 기판 변형시키고 절연 쥐 대동맥의 강성을 측정하는 것에 응답하여 하나의 마우스 근원 세포 세포에서 핵의 변형을 측정 하였다. BAXS 플랫폼은 하위 세포, 세포 및 전체 조직 수준에서 신규 mechanobiological 통찰력을 제공하기 위해 다양한 광학 microscopies과 결합 될 수있는 다양한 도구이다.
Introduction
기계적인 미세 환경은 조직의 발달 및 항상성에 또한 질병 1-6에 지대한 영향을 미칠 예컨대 증식, 이동 및 분화와 같은 다양한 세포 기능에 중요한 역할을한다. 수년에 걸쳐, 실험의 여러 도구는 기계적으로 세포 나 조직을 자극하고 기본 mechanobiology에 대한 우리의 이해를 증가시키고 질병 6-17의 발병과 진행을 공부하는 것을 목표로 생물 조직의 기계적 특성을 측정하는 데 사용되었다. 그러나, 하나는 종종 특정 연구의 목적을 달성하기 위하여 여러 가지 실험 장치에 의존한다. 이 문서에서는 기계적 특성 및 기계적 힘이 전체 조직 저울의 길이에 하위 세포 생물학에서 재생하는 역할을 조사 연구를 허용하는 단일, 멀티 기능, 이축 연신 (BAXS) 플랫폼을 제공합니다. BAXS 플랫폼은 quantificatio 수 있습니다뿐만 아니라,또한 기계적 격리 조직의 특성 만의 N은 생체 내에서 발생하는 연신 그들의 응답을 이해하기 위해 살아있는 세포로, 간단한 복소 및 동적 스트레인 필드를 적용하는 능력을 용이하게한다. BAXS 플랫폼은 세포와 조직에 기계적인 테스트와 동요 동안 라이브 세포 현미경을 수행 할 수있는 능력을 유지합니다.
BAXS 플랫폼은 세포 수준에서, 기판 변형의 효과를 조사하여 생체 조직 (도 1a)에서 인장 시험을 수행하는 데 사용할 수있는 맞춤식 장치이다. 알루미늄 히터는 표준 10 cm 페트리 접시를 수용 및 온도 제어기와 캡톤 히터 (도 1b)를 사용하여 37 ° C에서 어떠한 생리적 용액을 유지하기 위해 제조 하였다. 이 BAXS 플랫폼은 반전 위상 콘트라스트 및 / 또는 형광 현미경에 통합 및 동시 영상 (그림 1C)을 허용 할 수 있습니다.요컨데, BAXS 플랫폼은 이동 부분이이 수직축 (도 1D)을 따라 배향 소형 선형 모션 볼 베어링 슬라이드 상에 장착되어있는 4 개의 선형 보이스 코일 모터로 구성된다. 선형 위치 결정 스테이지 (도 1E)를 사용한다 클램핑 시스템의 수직 운동을 허용하기 위해 4 개의 모터의 각각에 장착된다. 각 모터의 위치는 500 nm의 해상도 (그림 1 층)와 광 인코더에 의해 모니터링된다. 네 개의 모터가 독립적으로 동작 명령 (그림 1G)를 실행하기 위해 옵티컬 엔코더 피드백을 이용한 모션 컨트롤러로 제어된다. LabVIEW는 인터페이스는 세포 또는 조직 샘플의, 완전히, 사용자 정의 정적 및 동적 변형을 생성하기 위해 변위의 크기, 속도 및 각 모터의 가속을 완전히 제어 할 수 있습니다.
세포에서 변형을 유도하는 데 사용되는 기술은 단순히 allowin함으로써 달성된다g 세포 단단히 플렉시블 투명 기판에 부착하고 BAXS 플랫폼의 네 개의 모터를 사용하여이 기판을 연신한다. BAXS 플랫폼은 음성 코일 모터에 기판을 연결하는 클램프의 맞춤 설계 세트로 장착 할 수 있습니다. 이 목적을 위해, 우리는 폴리 디메틸 실록산 (PDMS)로 이루어지는 유연하며 투명 기판이, (도 2A-C 및도 3)에 접속 될 수있는 클램프 세트를 설계했다. 클램프 생리적 용액에 노출 될 수있는 바와 같이, 모든 부품은 멸균 수 있도록 스테인레스 스틸로 기계 가공 하였다. 이러한 클램프 정중 (도 2d)를 연신하는 동안 기판 상에 스트레스를 최소화하면서 이미지 품질을 향상시키기 위해 현미경 대물 최대한 가까운 기판을 가지고 고안되었다.
동일한 BAXS 플랫폼은 ADAP와 클램프 적절한 세트를 사용하여, 작은 조직 샘플의 강성을 정량화하는데 사용될 수있다테드 조직 샘플 및 힘을 감시하는 로드셀 지원한다. 여러 가지 방법이 BAXS 플랫폼 모터에 조직을 마운트 가지고 갈 수있다; 이 경우에는 스텐레스 곤충 minutiens 핀은 인장 시험 (도 4A-B)를 수행하기 위해 혈관 조직의 개구부를 통해 연결 할 수있다. 대안 적으로, 천연 열지 않고 두꺼운 조직에 대한 조직 가장자리 역시 보이스 코일 모터에 부착 또는 생물학적 접착제와 작은 유리 슬라이드에 접착 및 클램프 모터에 연결된 클램프 위치에 유지 될 수있다. 인장을 수행하기 위해 소형 로드셀이 요구되는 테스트 용이 BAXS 플랫폼 모터에 혼입 및 연신 사이클 (도 4C) 동안 조직에 작용하는 힘을 측정 할 수있다. BAXS 플랫폼은 네 개의 모터로 구성 될 때, 제 2로드 셀을 도입 한 두 개의 직교하는 방향을 따라 인장 시험을 수행 할 수있다. 이 기능은 하나의 quantif 할 수 있습니다Y 동일한 실험을하는 동안 두 개의 수직 방향에 따라 단일 조직의 기계적 강성.
중요한 사실은, 모든 구성에서, 셀 또는 또한 조직 샘플은 항상 사용자에게 액세스 온도 조절 욕에서 유지된다. 이 능력은 샘플의 시간 응답을 조사하기 위해서 샘플 연신 동안 약리 제제의 도입을 허용한다. 도립 현미경의 광축이 막히지 남아 또한, 현미경의 모든 형태는 여전히 사용자가 이용할 수있다. BAXS 플랫폼의 네 개의 모터가 독립적으로 작동 마지막으로, 그 샘플에 높은 구성 변형 필드를 적용하는 것이 가능하다. 생체 세포와 조직이 노출되는 복잡하고 반대하는이 플랫폼에보다 적절하게 모방 할 수있는 스트레칭 이방성 전통적인 축 연신 플랫폼 7,13,15,18,19합니다. 또한, 물리적 특성변형 필드의 실험 기간 동안 즉석에서 변경 될 수 있습니다. 이러한 능력은 사용자가 시간적으로 매우 복잡한 이방성의 다양한 수, 및 공간적으로 다양한 변형 필드 세포 및 조직 수준의 응답을 검사 할 수있다. 이 문서는 장점과 한계에 BAXS 플랫폼뿐만 아니라 디자인, 작동 원리, 그리고 단일 세포 및 전체 조직 실험에 대한 실험 내용을 설명합니다.

BAXS 플랫폼의 그림 1. 개요. 네 보이스 코일 모터 플랫폼 수행 라이브 거꾸로 현미경에 장착 할 수 있습니다) 37 ° C. C에서 세포와 조직을 유지하기 위해 사용되는 배양 접시 히터. B) 상세한 그림을 보여주는 BAXS 플랫폼의 윗면) 스트레칭 실험 도중 세포 이미징.D) 보이스 코일 모터의 상세한 그림; 클램핑 시스템 모션 컨트롤러. G) 상세 사진에 모터의 실시간 위치를 제공하는 광학 인코더의. F) 상세 사진의 수직 변위를 허용하는 선형 위치 결정 스테이지의 플랫폼의 이동 부분. E) 상세한 그림 네 개의 보이스 코일 모터로 네 광학 엔코더 입력과 전원 출력을 나타낸 모션 컨트롤러.
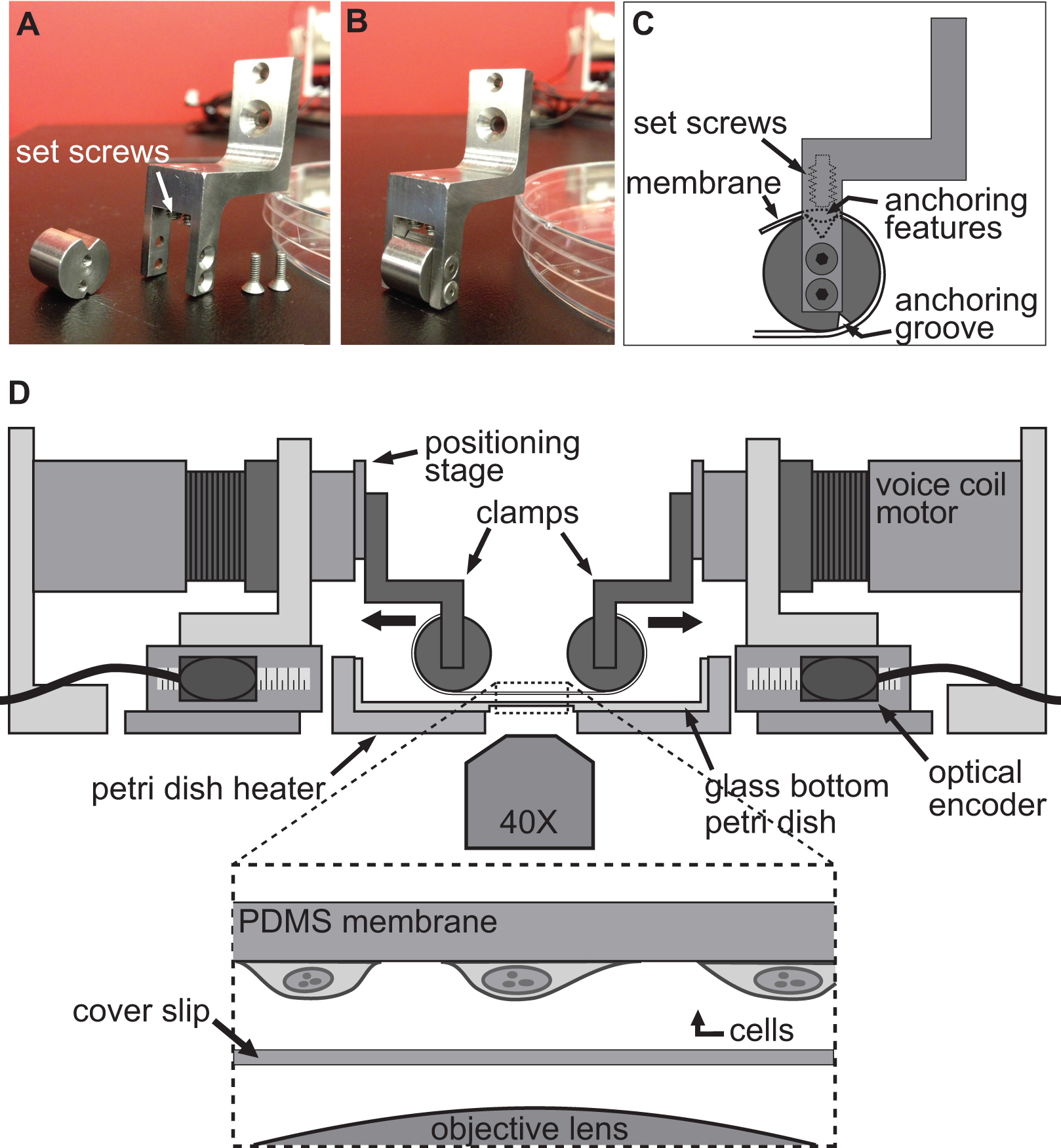
그림 2. 세포 스트레칭 실험 시스템을 클램핑. 기판은 그것의 앵커 featur와 클램프의 원통형 부분의 주위에 싸여있다. C)를 연신위한 보이스 코일 모터에 PDMS 기판을 연결하는 데 사용되는 클램프의 상세를 도시 AB) 이미지에스 상단에있는 홈에 앉아. 그런 다음, 기판 상단 홈에 기능을 고정 / 기판을 밀어 고정 나사를 사용하여 고정한다. 클램프 자리에 기판을 들고 BAXS 플랫폼의 D) 그림. 삽입물은 부착 세포는 단지 커버 슬립과 현미경 대물 위에 앉아있는 기판의 세부를 도시한다.
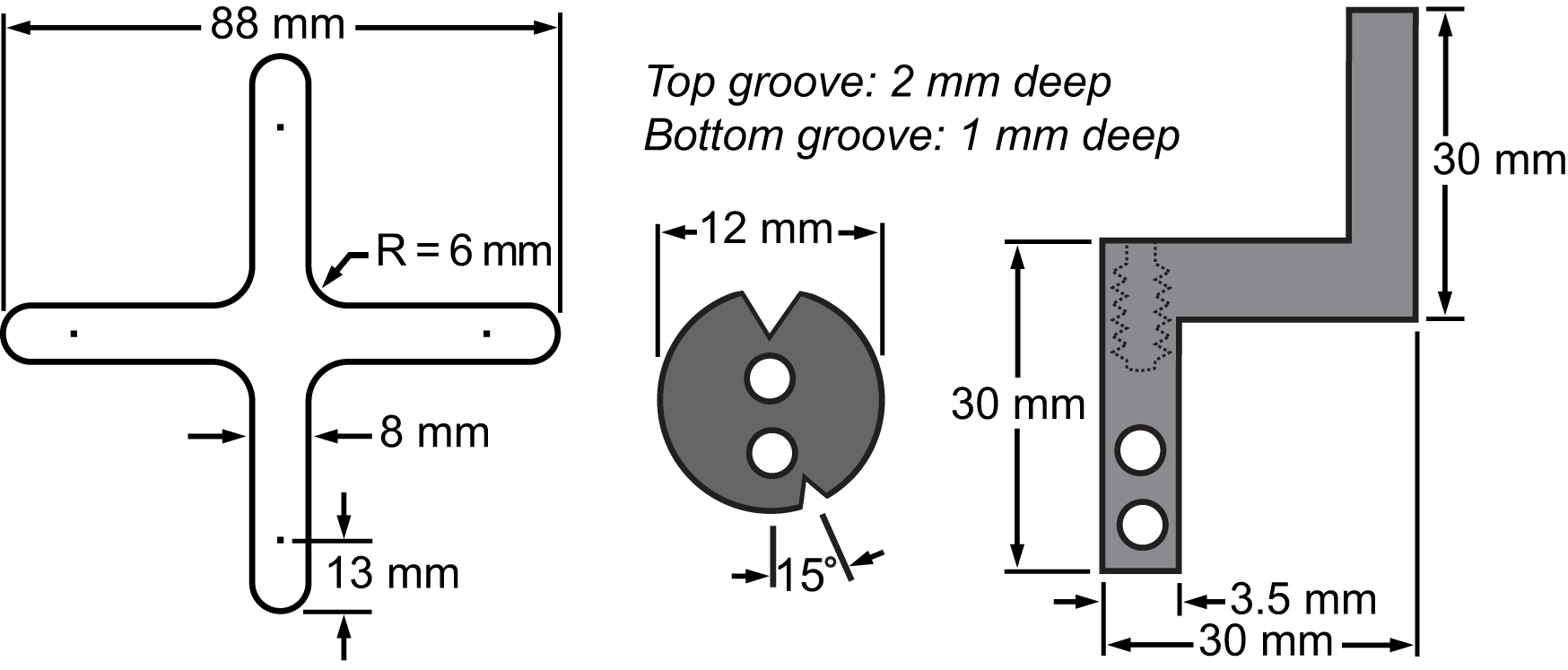
도 3. 막과 클램핑 시스템의 재료의 명세서. 주요부의 치수를 나타낸 도면 셀 연신 실험을 수행하기 위해 이축 플랫폼에 통합.
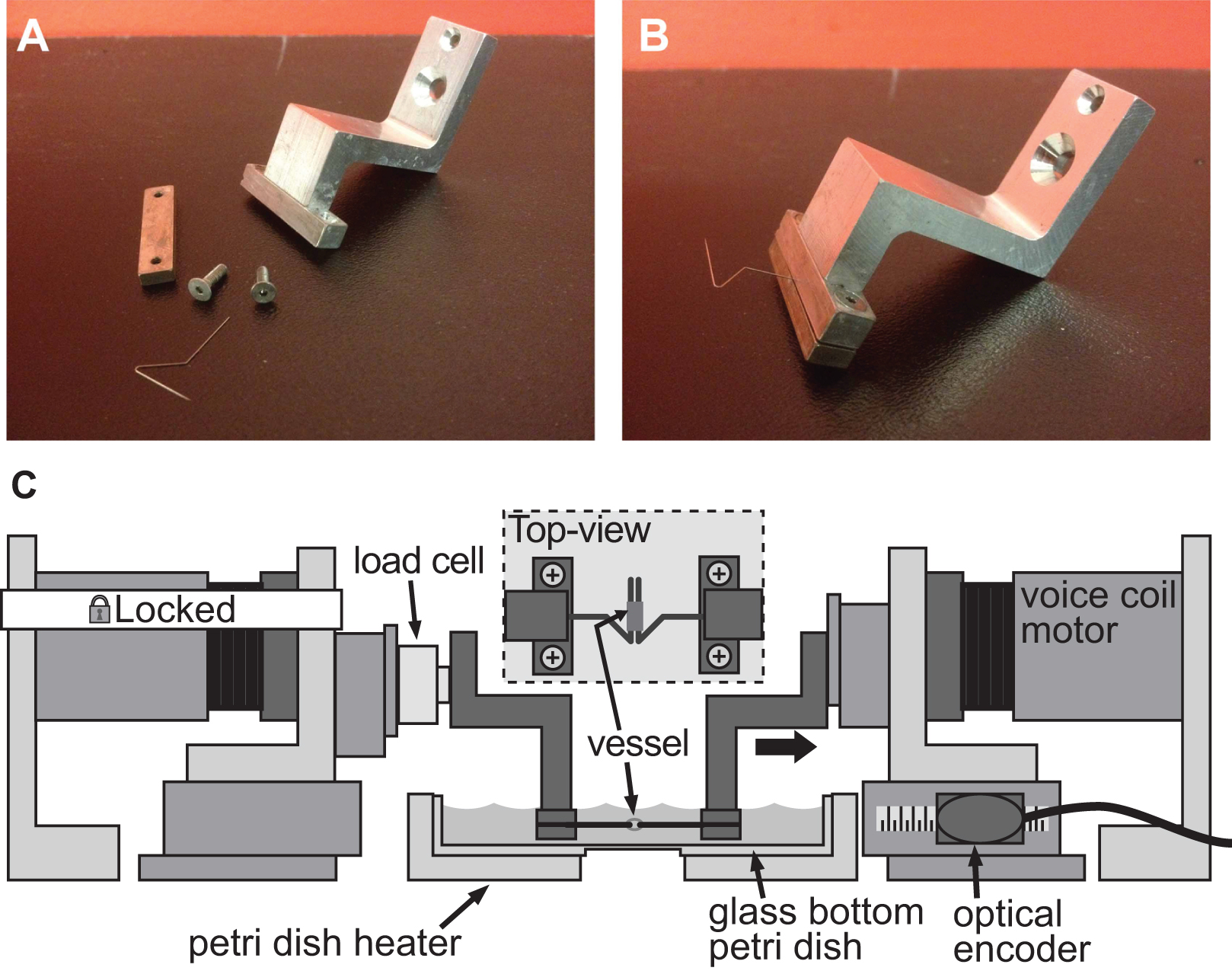
그림 4. 예소 구경 혈관의 강성 평가 1mm 직경 쥐 대동맥에서 변형을 유도하기 위해 사용되는 클램핑 시스템. AB) 상세한 그림 클램핑 시스템의 충분한. 스테인레스 스틸 핀은주의 깊게 선박이 두 핀에 클램프 선박 및 고정 모터와 왼쪽 클램프 사이에 부착 된 로드셀을 들고 BAXS 플랫폼. C) 그림을 슬라이드 할 수 있도록 열려있는 삼각형으로 형성되었다. 삽입 된 핀에 장착 된 용기에 대한 자세한 높은 전망을 보여줍니다.
Protocol
Representative Results
Discussion
여기에 제시된 BAXS 플랫폼은 단일 세포의 조사에서 전체 조직에, mechanobiology의 연구에서 많은 실험을 용이하게한다. 또한, 플랫폼은 다수의 기계적인 자극 실험 및 다축 인장 시험을 허용하고 매우 유연한 구성이다. 이 플랫폼은 또한 생리 학적 조건에서 세포와 조직의 유지를 가능하게하고 스트레칭 실험시 현미경을 동시에 할 수 있습니다. 설치 클램프의 적절한 세트를 사용할 때 이전 섹션에서…
Disclosures
The authors have nothing to disclose.
Acknowledgements
DT는 르 퐁 드 공들인 뒤 퀘벡 – 자연 등 기술 (FQRNT)와 MITACS 높이기 전략 원정대에서 박사 재학에 의해 지원되었다. CMC는 르 퐁 드 공들인 엉 상테 뒤 퀘벡 (FRSQ)와 어니스트 오타와 심장 연구소의 대학에서 마가렛 포드 심장 부여 연구 활동에서 박사 재학에 의해 지원되었다. EOB는 운영 보조금 건강 연구의 캐나다 연구소 (CIHR)에서 MOP80204과 마음에서 T6335과 온타리오의 뇌졸중 재단에 의해 지원되었다. CIHR과 메드 트로닉은 집단적으로 피어 리뷰 연구 의자 (URC # 57093)와 EOB를 제공합니다. AEP는 자연 과학 및 공학 연구위원회 (NSERC) 디스커버리 그랜트 NSERC 발견 가속기 보충에 의해 투자하고 감사 한 캐나다 연구 의자 (CRC) 프로그램 및 온타리오 주에서 조기 연구원 상의 지원을 인정한다.
Materials
| PDMS | Ellsworth Adhesives | 184 SIL ELAST KIT 0.5KG | The ratio base to cross-linker used in this protocol is 20:1. Mix in a laminar hood to keep dust from contamining your |
| FluoSpheres fluorescent microspheres | Invitrogen | F8810 | Keep away from light. |
| Linear voice coil | Moticont | LVCM-051-051-01 | The motro comes in two pieces (magnet and coil). It has to be mounted on a ball bearing sytem to be functional. |
| Ball bearing slide | Edmund Optics | NT37-360 | Miniature and Small Linear Motion Ball Bearing Slides |
| linear positioning stage | Edmund Optics | 38-960 | Center Drive 1.25" Square Linear Translation Stages |
| optical encoder | GSI microE systems | Mercury II 1600S – 0.5um resolution | reflective incremental encoder. |
| motion controller | Galil | DMC-2143(DIN)-DC48 with AMP-20440 | 4 axis controller with a 4 axis amplifier |
| load cell | Honeywell | 31 low | miniature load cell with a range of 0-150 g |
| Insect minutiens pins (0,20mm) | Pin Service Austerlitz Insect pins | Stainless steel pins that are bended in an opened triangle shape | |
| SU-8 2050 | Micro Chem | SU-8 2050 | Permanent epoxy negative photoresist. Keep away from heat and light |
| Air-plasma treatment system | Glowresearch | Autoglow Oxygen Plasma System | |
| Rat-tail collagen | Invitrogen | A10483-01 | Collagen I, Rat Tail 5mg/ml |
| Hoechst 33342 | Invitrogen | R37605 | DNA-specific fluorescent dye. Keep in the fridge. |
| Kapton (Polyimide Film) Insulated Flexible Heaters | omega.ca | KHLV-0504/(10)-P | 28V flexible heaters; can be supplied with a 24V |
| 1/16 DIN Autotune Temperature and Process Controllers | omega.ca | CN63200-R1-LV | Temperature controller; supply 24 V. |
| DMEM culture medium | Hyclone | SH3024301 | Dulbecco’s Modified 30 Eagle Medium. Keep at 4 C |
| Penicillin-Streptomycin | Hyclone | SV30010 | Keep stock frozen. Keep working solution at 4 C. |
| Fetal bovine serum (FBS) | Hyclone | SH3039603C | Keep frozen. |
| Trypsin 0,05% | Hyclone | SH30236,02 | Keep frozen. Digestion of cell attachement proteins for subcultivation |
| Hepes | Wisent Inc | 330-050-EL | HEPES-buffered salt solution |
| NaCl | Fisher Scientific | BP358-1 | HEPES-buffered salt solution / Krebs physiological solution |
| KCl | Fisher Scientific | BP366-500 | HEPES-buffered salt solution / Krebs physiological solution |
| MgSO4 | Fisher Scientific | M65-500 | HEPES-buffered salt solution / Krebs physiological solution |
| CaCl2 | Fisher Scientific | C614-500 | HEPES-buffered salt solution / Krebs physiological solution |
| Dextrose | Fisher Scientific | BP220-1 | HEPES-buffered salt solution / Krebs physiological solution |
| NaHCO3 | Fisher Scientific | BP328-1 | Krebs physiological solution |
| KH2PO4 | Fisher Scientific | BP362-500 | Krebs physiological solution |
| Carbogen 95% O2/ 5% CO2 | Lindle | DIN:02154749 | Krebs physiological solution oxygenation |
| Nocodazole | Sigma | M1404 | Microtubules depolymerization agent |
| Cytochalasin-D | Sigma | C8273 | Actin filaments depolymerization agent |
| Anti-α-SMA-FITC | Sigma | F3777 | Used to stain and quantify smooth muscle cells content |
| Picrosirius red stain | Fluka | 43665 | Used to stain and quantify collagen content |
References
- Yim, E. K., Sheetz, M. P. Force-dependent cell signaling in stem cell differentiation. Stem Cell Res Ther. 3, (2012).
- Vogel, V., Sheetz, M. Local force and geometry sensing regulate cell functions. Nat Rev Mol Cell Biol. 7, 265-275 (2006).
- Wang, N., Tytell, J. D., Ingber, D. E. Mechanotransduction at a distance: mechanically coupling the extracellular matrix with the nucleus. Nat Rev Mol Cell Biol. 10, 75-82 (2009).
- Ingber, D. E. Mechanobiology and diseases of mechanotransduction. Ann Med. 35, 564-577 (2003).
- Janmey, P. A., Miller, R. T. Mechanisms of mechanical signaling in development and disease. J Cell Sci. 124, 9-18 (2011).
- Bukoreshtliev, N. V., Haase, K., Pelling, A. E. Mechanical cues in cellular signalling and communication. Cell Tissue Res. 352, 77-94 (2013).
- Chen, Y., Pasapera, A. M., Koretsky, A. P., Waterman, C. M. Orientation-specific responses to sustained uniaxial stretching in focal adhesion growth and turnover. Proc Natl Acad Sci USA. 110, (2013).
- Rosenzweig, D. H., Matmati, M., Khayat, G., Chaudhry, S., Hinz, B., Quinn, T. M. Culture of Primary Bovine Chondrocytes on a Continuously Expanding Surface Inhibits Dedifferentiation. Tissue Eng Part A. 18, 2466-2476 (2012).
- Balachandran, K., et al. Cyclic strain induces dual-mode endothelial-mesenchymal transformation of the cardiac valve. Proc Natl Acad Sci USA. 108, 19943-19948 (1994).
- Steward, R., Cheng, C. M., Ye, J., Bellin, R., LeDuc, P. Mechanical stretch and shear flow induced reorganization and recruitment of fibronectin in fibroblasts. Sci Rep. 1, (2011).
- Wang, D., Xie, Y., Yuan, B., Xu, J., Gong, P., Jiang, X. A stretching device for imaging real-time molecular dynamics of live cells adhering to elastic membranes on inverted microscopes during the entire process of the stretch. Integr Biol (Camb). 2, 288-293 (2010).
- Haskett, D., Johnson, G., Zhou, A., Utzinger, U., Van de Geest, J. Microstructural and biomechanical alterations of the human aorta as a function of age and location. Biomech Model Mechanobiol. 9, 725-736 (2010).
- Duprey, A., Khanafer, K., Schlicht, M., Avril, S., Williams, D., Berguer, R. In vitro characterisation of physiological and maximum elastic modulus of ascending thoracic aortic aneurysms using uniaxial tensile testing. Eur J Vasc Endovasc Surg. 39, 700-707 (2010).
- Tremblay, D., et al. A comparison of mechanical properties of materials used in aortic arch reconstruction. Ann Thorac Surg. 88, 1484-1491 (2009).
- Khanafer, K., Duprey, A., Zainal, M., Schlicht, M., Williams, D., Berguer, R. Determination of the elastic modulus of ascending thoracic aortic aneurysm at different ranges of pressure using uniaxial tensile testing. The Journal of thoracic and cardiovascular surgery. 142, 682-686 (2011).
- Van de Geest, J. P., Sacks, M. S., Vorp, D. A. The effects of aneurysm on the biaxial mechanical behavior of human abdominal aorta. J Biomech. 39, 1324-1334 (2006).
- Guolla, L., Bertrand, M., Haase, K., Pelling, A. E. Force transduction and strain dynamics in actin stress fibres in response to nanonewton forces. J Cell Sci. 125, 603-613 (2012).
- Wang, J. H., Goldschmidt-Clermont, P., Wille, J., Yin, F. C. Specificity of endothelial cell reorientation in response to cyclic mechanical stretching. J Biomech. 34, 1563-1572 (2001).
- Jungbauer, S., Gao, H., Spatz, J. P., Kemkemer, R. Two characteristic regimes in frequency-dependent dynamic reorientation of fibroblasts on cyclically stretched substrates. Biophys J. 95, 3470-3478 (2008).
- Dahl, K. N., Ribeiro, A. J. S., Lammerding, J. Nuclear shape, mechanics, and mechanotransduction. Circ Res. 102, 1307-1318 (2008).
- Shivashankar, G. V. Mechanosignaling to the cell nucleus and gene regulation. Annu Rev Biophys. 40, 361-378 (2011).
- Chiquet, M., Gelman, L., Lutz, R., Maier, S. From mechanotransduction to extracellular matrix gene expression in fibroblasts. Biochim Biophys Acta. 1793, 911-920 (2009).
- Sullivan, T., et al. Loss of A-type lamin expression compromises nuclear envelope integrity leading to muscular dystrophy. J Cell Biol. 147, 913-920 (1999).
- Lammerding, J., et al. Lamin A/C deficiency causes defective nuclear mechanics and mechanotransduction. J Clin Invest. 113, 370-378 (2004).
- Tremblay, D., Andrzejewski, L., Leclerc, A., Pelling, A. E. Actin and microtubules play distinct roles in governing the anisotropic deformation of cell nuclei in response to substrate strain. Cytoskeleton. , (2013).
- Cuerrier, C. M., et al. Chronic over-expression of heat shock protein 27 attenuates atherogenesis and enhances plaque remodeling: a combined histological and mechanical assessment of aortic lesions. PLoS ONE. 8, (2013).
- Tremblay, D., Cartier, R., Mongrain, R., Leask, R. L. Regional dependency of the vascular smooth muscle cell contribution to the mechanical properties of the pig ascending aortic tissue. J Biomech. 43, 2448-2451 (2010).
- Barker, A. J., Lanning, C., Shandas, R. Quantification of hemodynamic wall shear stress in patients with bicuspid aortic valve using phase-contrast MRI. Ann Biomed Eng. 38, 788-800 (2010).
- Haga, J. H., Li, Y. S. J., Chien, S. Molecular basis of the effects of mechanical stretch on vascular smooth muscle cells. J Biomech. 40, 947-960 (2007).
- Frydrychowicz, A., et al. Time-resolved magnetic resonance angiography and flow-sensitive 4-dimensional magnetic resonance imaging at 3 Tesla for blood flow and wall shear stress analysis. The Journal of thoracic and cardiovascular surgery. 136, 400-407 (2008).
- Boccafoschi, F., Mosca, C., Bosetti, M., Cannas, M. The role of mechanical stretching in the activation and localization of adhesion proteins and related intracellular molecules. J Cell Biochem. 112, 1403-1409 (2011).
- Yang, G., Crawford, R. C., Wang, J. H. C. Proliferation and collagen production of human patellar tendon fibroblasts in response to cyclic uniaxial stretching in serum-free conditions. J Biomech. 37, 1543-1550 (2004).
- Goldyn, A. M., Rioja, B. A., Spatz, J. P., Ballestrem, C., Kemkemer, R. Force-induced cell polarisation is linked to RhoA-driven microtubule-independent focal-adhesion sliding. J Cell Sci. 122, 3644-3651 (2009).
- Heo, S. J., et al. Fiber stretch and reorientation modulates mesenchymal stem cell morphology and fibrous gene expression on oriented nanofibrous microenvironments. Ann Biomed Eng. 39, 2780-2790 (2011).
- Zdero, R., et al. Linear and torsional mechanical characteristics of intact and reconstructed scapholunate ligaments. J Biomech Eng. 131, (2009).

