A Novel Stretching-Plattform für Anwendungen in der Zell-und Gewebe Mechanobiologie
Summary
Wir stellen in diesem Artikel ein neues Streck Plattform, die verwendet werden können, um einzelne Zellantworten auf komplexe anisotropen biaxiale mechanische Verformung zu untersuchen und zu quantifizieren, die mechanischen Eigenschaften von biologischen Geweben.
Abstract
Werkzeuge, die die Anwendung von mechanischen Kräften, um Zellen und Gewebe oder die Quantifizierung zu ermöglichen kann die mechanischen Eigenschaften von biologischem Gewebe haben sich zum Verständnis der Grund Mechanobiologie beigetragen. Diese Techniken wurden intensiv genutzt, um zu zeigen, wie die Entstehung und Progression von verschiedenen Krankheiten sind stark von mechanischen Signale beeinflusst. Dieser Artikel stellt eine multifunktionale biaxiale Streckung (BAXS)-Plattform, die entweder mechanisch stimulieren können einzelne Zellen oder zu quantifizieren, die mechanische Steifigkeit des Gewebes. Die BAXS Plattform besteht aus vier Schwingspulenmotoren, die unabhängig voneinander gesteuert werden können. Einzelne Zellen können auf einem flexiblen Substrat, das an die Motoren so dass man die Zellen, um komplexe, dynamische und räumlich variierenden Dehnungsfeldern aus befestigt werden kann, kultiviert werden. Umgekehrt wird durch den Einbau eines Kraftlastzelle, kann man auch eine Quantifizierung der mechanischen Eigenschaften des Primärgeweben, wie sie Deformationszyklen ausgesetzt sind.In beiden Fällen muss eine richtige Satz von Klemmen entwickelt und montiert, um den Motoren BAXS Plattform, um fest zu halten das flexible Substrat oder das Gewebe von Interesse sein. Die BAXS Plattform auf einem inversen Mikroskop, um die gleichzeitige Durchlicht und / oder Fluoreszenzabbildung durchzuführen, um die strukturelle oder biochemische Reaktion der Probe während des Streckens Experimente untersuchen montiert werden. Dieser Artikel enthält experimentelle Details der Gestaltung und Nutzung des BAXS Plattform und präsentiert die Ergebnisse für einzelne Zelle und ganze Gewebestudien. Die BAXS Plattform wurde verwendet, um die Verformung der Kerne in Einzel Maus Myoblasten Zellen in Reaktion zu messen, um Stamm-Substrat und die Steifigkeit der isolierten Maus-Aorten messen. Die BAXS Plattform ist ein vielseitiges Werkzeug, mit verschiedenen optischen Mikroskopie, um neue Erkenntnisse zu den mechanobiological subzellulärer, Zell-und Gewebespiegel bieten ganze kombiniert werden können.
Introduction
Die mechanische Mikro spielt eine wichtige Rolle in vielen Zellfunktionen wie Proliferation, Migration und Differenzierung, die eine tiefgreifende Wirkung auf die Entwicklung und die Homöostase von Geweben und auch Krankheiten 1-6 haben. Im Laufe der Jahre eine Vielzahl von experimentellen Werkzeuge werden verwendet, um mechanisch zu stimulieren Zellen oder Geweben zu messen und mechanischen Eigenschaften von biologischem Gewebe mit dem Ziel der Erhöhung der unser Verständnis der Grund Mechanobiologie und Untersuchung der Entstehung und Progression von Krankheiten 6-17. Allerdings muss man oft auf verschiedenen experimentellen Vorrichtungen, um die Ziele einer bestimmten Untersuchung zu erreichen. Dieser Artikel stellt eine Einzel-, Multi-Funktions-, biaxiale Streckung (BAXS)-Plattform, die für die Studien, die die Rolle zu untersuchen, dass die mechanischen Eigenschaften und mechanische Kräfte spielen in der Biologie an der sub-zellulären, ganze Gewebelängenskalen erlaubt. Die BAXS Plattform ermöglicht nicht nur für die quantification der mechanischen Eigenschaften von Geweben isoliert, sondern erleichtert auch die Fähigkeit, einfache, komplexe und dynamische Spannungsfeldern auf lebende Zellen, um ihre Reaktion auf Strecken, die in vivo auftritt verstehen anzuwenden. Die Plattform BAXS behält auch die Fähigkeit lebender Zellen Mikroskopie bei der mechanischen Prüfung und Störungen auf Zellen und Gewebe durchzuführen.
Die BAXS Plattform ist ein custom-built Vorrichtung, die verwendet werden können, um die Wirkung der Substratdeformation auf zellulärer Ebene zu untersuchen und durchzuführen, Zugversuche an biologischen Geweben (Abb. 1A). Eine Aluminium Heizvorrichtung wurde hergestellt, um eine Standard-10-cm-Petrischale aufzunehmen und irgendwelche physiologischen Lösungen aufrechterhalten bei 37 ° C mit einem Temperaturregler und Kapton Heizer (Fig. 1B). Diese BAXS Plattform auf einem invertierten Phasenkontrast und / oder Fluoreszenzmikroskop integriert werden und ermöglicht die gleichzeitige Bildgebung (Fig. 1C).Kurz gesagt, die BAXS Plattform besteht aus vier linearen Schwingspulenmotoren, von denen die beweglichen Teile auf Miniatur-Linearbewegung-Kugellager gleitet entlang von zwei senkrechten Achsen (Fig. 1D) ausgerichtet montiert ist. Ein Linearstellstufe zu jeder der vier Motoren angebracht, um die vertikale Bewegung des Spannsystems, mit (1E) werden können. Die Position jedes Motors wird durch einen optischen Codierer mit einer Auflösung von 500 nm (Fig. 1F) überwacht. Alle vier Motoren sind unabhängig voneinander mit einer Bewegungssteuerung, die optische Encoder-Feedback, Bewegungsbefehle (1G) ausführen gesteuert. Ein LabVIEW-Schnittstelle bietet die volle Kontrolle über die Verschiebungsgröße, Geschwindigkeit und Beschleunigung jedes Motors, um vollständig anpassbar, statische und dynamische Verformung der Zellen oder Gewebeproben zu generieren.
Die Einrichtung zur Verformung in Zellen zu induzieren Technik wird erreicht, indem einfach allowing Zellen fest an einem flexiblen und transparenten Substrat zu haften und dann Strecken dieses Substrat mit den vier Motoren der BAXS Plattform. Die Plattform ermöglicht die Montage BAXS jeder maßgeschneiderten Satz von Klammern, um das Substrat auf den Schwingspulenmotoren befestigen. Zu diesem Zweck haben wir eine Reihe von Klemmen, um die ein flexibles und transparentes Substrat, Polydimethylsiloxan (PDMS) hergestellt ist, kann angebracht werden (Fig. 2A-C und Fig. 3). Da die Klemmen werden physiologischen Lösungen ausgesetzt werden, wurden alle Teile aus rostfreiem Stahl gefertigt, um für die Sterilisation zu ermöglichen. Diese Klemmen sind sorgfältig entworfen, um das Substrat so nahe wie möglich an dem Mikroskopobjektiv zu bringen, um die Bildqualität zu verbessern und gleichzeitig eine Minimierung der Belastung des Substrats während des Streckens (Fig. 2D).
Das gleiche BAXS Plattform kann auch verwendet werden, um die Steifheit der kleinen Gewebeproben zu quantifizieren, unter Verwendung eines geeigneten Satzes von Klemmen mit ADAPted Träger für die Gewebeproben und einer Lastzelle, um Kräfte zu überwachen. Verschiedene Ansätze werden können, um ein Gewebe zu den BAXS Plattform Motoren montieren; in diesem Fall werden die Edelstahl-Insekten minutiens Stifte durch die Öffnung des Gefäßgewebe um Zugversuche (Fig. 4A-B) führen zu haken. Alternativ für dicke Gewebe ohne eine natürliche Öffnung, Gewebekanten können entweder in der Position mit den Klemmen an den Schwingspulenmotoren angebracht oder mit kleinen Glasobjektträger mit biologischen Kleber verklebt und an die Motoren mit den Klemmen befestigt gehalten werden. Um Zug-Tests durchführen, ein Miniatur-Wägezelle ist erforderlich und kann leicht auf die Plattform BAXS Motoren eingebaut und verwendet, um die während einer Streckzyklus (4C) auf das Gewebe wirkenden Kraft zu messen. Da die BAXS Plattform von vier Motoren besteht, die Einführung einer zweiten Lastzelle erlaubt es, Zugprüfmaschine entlang zweier orthogonaler Richtungen durchzuführen. Diese Fähigkeit ermöglicht es, quantify die mechanische Steifigkeit eines einzelnen Gewebe entlang zwei senkrechten Richtungen im gleichen Experiment.
Wichtig ist, dass in allen Konfigurationen, die Zellen oder Gewebeproben von Interesse sind immer in einem temperaturkontrollierten Bad, das für den Benutzer zugänglich ist, gehalten. Diese Fähigkeit ermöglicht die Einführung von pharmakologischen Mitteln während der Proben Strecken, um die zeitliche Antwort der Probe zu untersuchen. Zusätzlich, da die optische Achse des umgekehrten Mikroskop unbehindert bleibt, sind immer noch alle Formen der Mikroskopie für den Benutzer verfügbar. Schließlich wird, wie alle vier Motoren der BAXS Plattform unabhängig ist es möglich, in hohem Maße konfigurierbar Spannungsfeldern auf die Probe von Interesse anzuwenden. In vivo Zellen und Gewebe ausgesetzt sind komplex und anisotrope Streckung, angemessener nachgeahmt in dieser Plattform gegen sein kann zu herkömmlichen einachsigen Dehnung Plattform 7,13,15,18,19. Darüber hinaus sind die physikalischen Eigenschaftender Dehnungsfeld kann dynamisch während eines Experiments geändert werden. Diese Fähigkeiten ermöglichen es dem Benutzer, den Zell-und Gewebeebene als Reaktion auf eine große Anzahl von komplexen, anisotropen, zeitlich und räumlich variierenden Spannungsfelder zu prüfen. Dieser Artikel beschreibt die Vorteile und Grenzen der BAXS Plattform sowie sein Design, Funktionsprinzipien und die experimentellen Details für einzelne Zelle und ganze Gewebe Experimenten.

Abbildung 1. Übersicht der BAXS-Plattform. A) Top Blick auf die BAXS Plattform, welche die vier Schwingspulenmotoren. B) Detailaufnahme der Petrischale Heizung Die Plattform kann auf einem inversen Mikroskop live-montiert werden verwendet, um Zellen und Gewebe bei 37 ° C C zu halten) Cell Imaging Experimente während der Dehnung.D) Detailaufnahme des Schwingspulenmotor; der bewegliche Teil der Plattform. E) Detaillierte Abbildung des linearen Positionierungsstufe ermöglicht vertikale Verschiebung der Spannsystemen. F) Detailaufnahme des optischen Encoder, der Echtzeit-Position des Motors bietet der Bewegungssteuerung. G) Detailaufnahme der Motion-Controller, der die vier optischen Encoder-Eingänge und Stromausgänge zu den vier Schwingspulenmotoren.
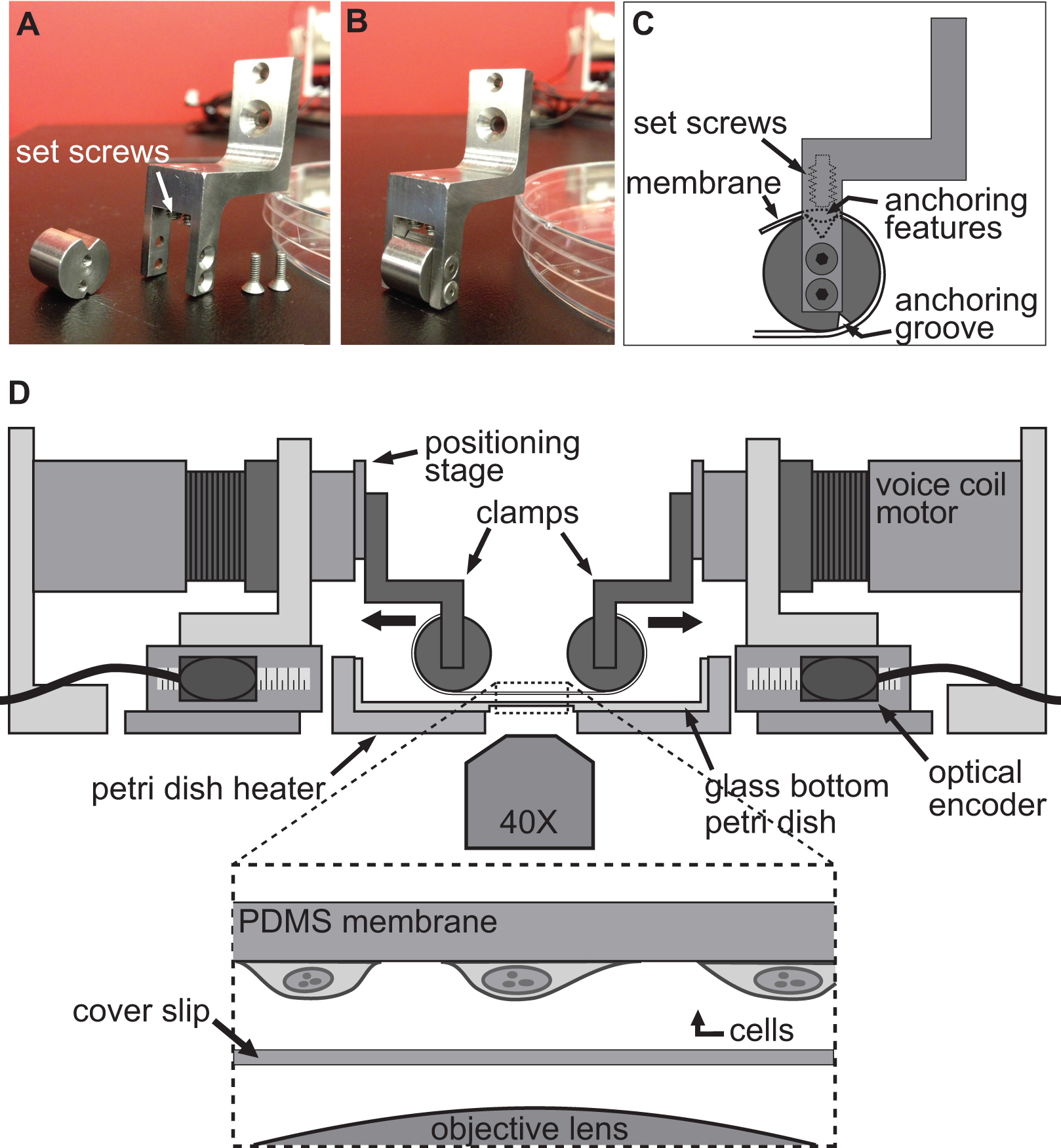
2. Spannsystem für Zellstreckexperimente. AB) Bilder, welche die Details der zur Herstellung der PDMS-Substrat zu den Schwingspulenmotoren für die Dehnung. C) Das Substrat wird um den zylindrischen Teil der Klemme mit seiner Verankerung featur gewickelt befestigen Schellenes sitzt in der Nut an der Spitze. Dann wird das Substrat mit den Stellschrauben, die das Substrat schieben / Verankerung Features in die obere Nut D) Illustration der BAXS Plattform mit die Klammern halten das Substrat an Ort und Stelle gesichert.. Der Einschub zeigt eine Detailansicht des Substrats mit Zellen daran befestigt sitzt direkt über einem Deckglas und dem Mikroskopobjektiv.
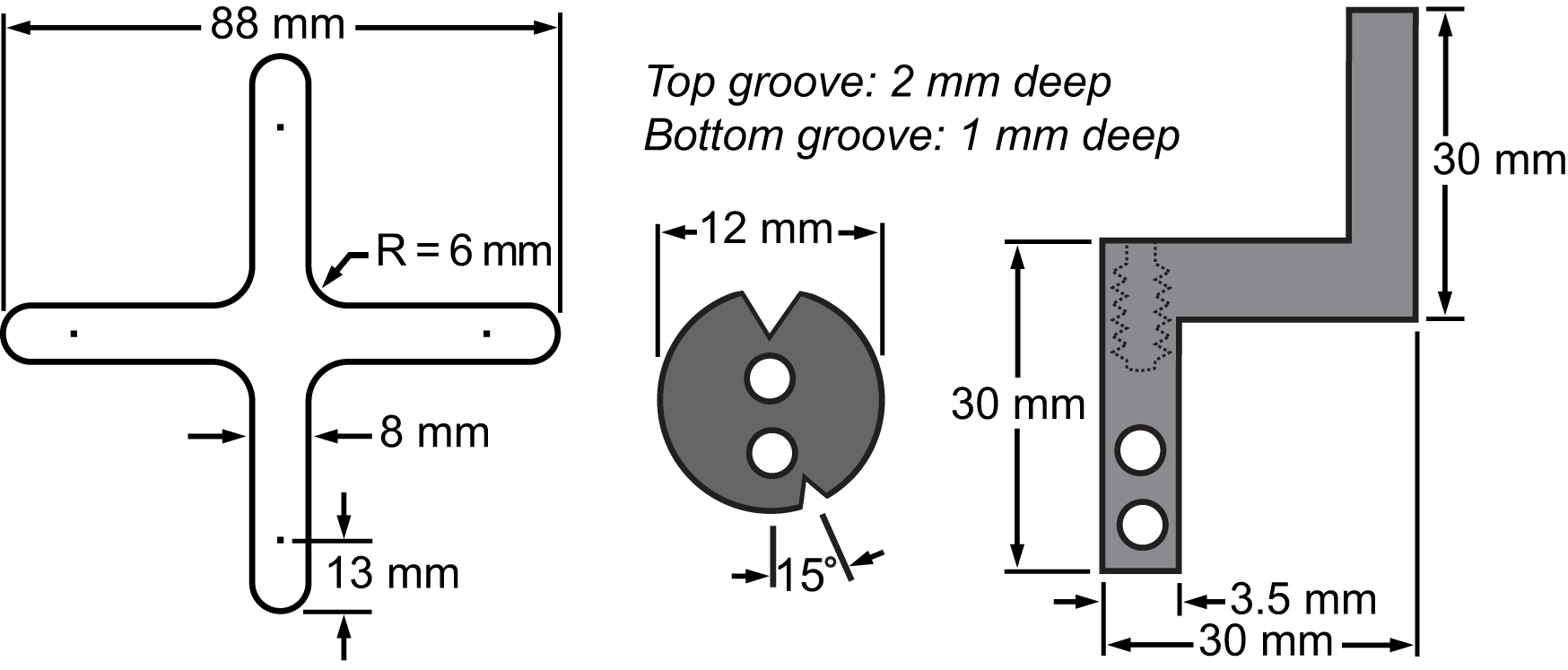
3. Stückmaterialien der Membran und ihre Spannsystem. Zeichnungen, die die Abmessungen der Hauptteile integriert werden, um die biaxiale Streckung Plattform Zellexperimente durchzuführen.
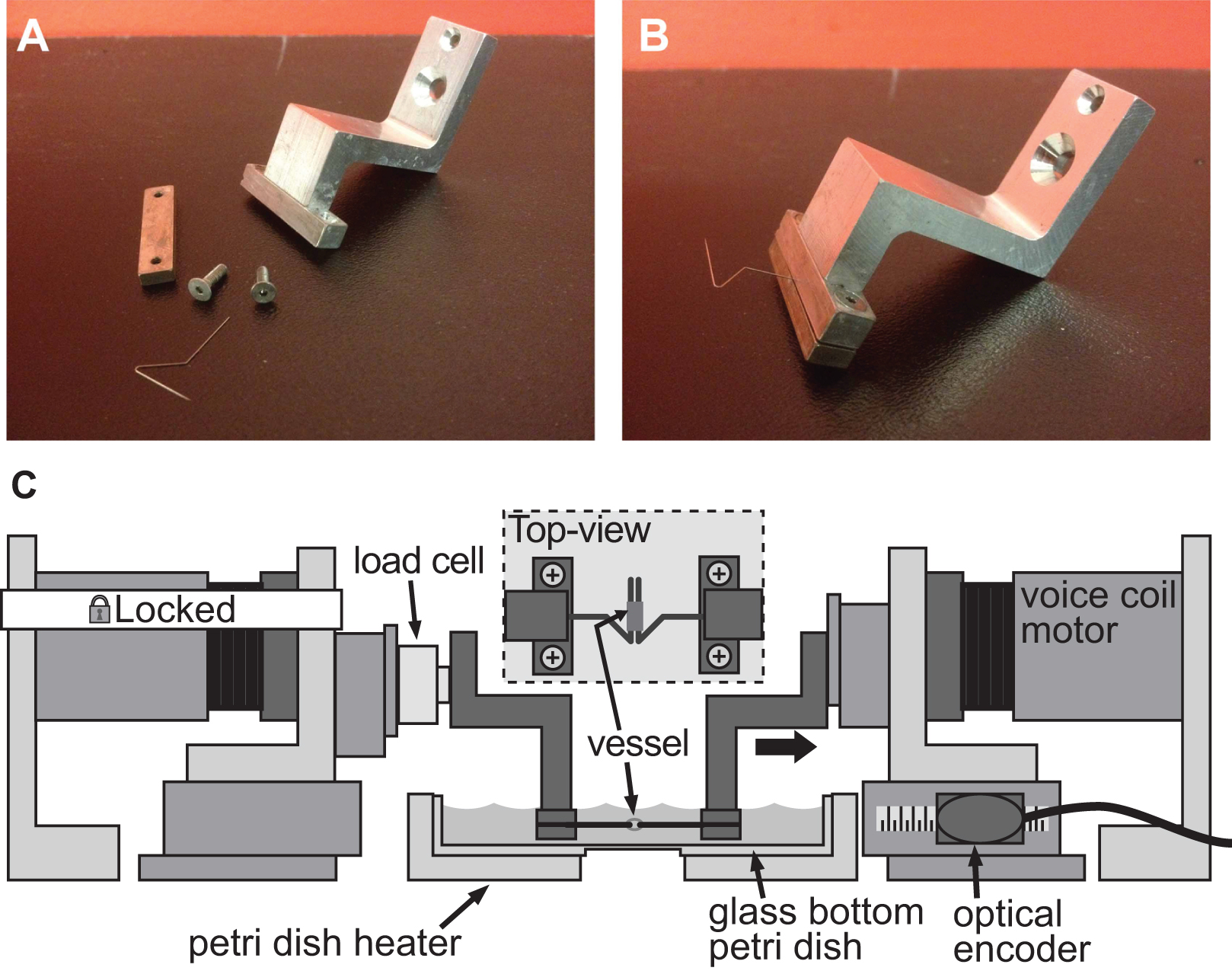
4. Exreichlich von einem Spannsystem für Steifigkeit Beurteilung der Kleinkalibergefäße. AB) Detailbilder des Spannsystems verwendet, um eine Verformung in einem 1 mm Durchmesser Maus Aorta zu induzieren. Edelstahl-Pins wurden sorgfältig in offene Dreiecke geformt, dass das Schiff auf beide Pins gleiten. C) Illustration der BAXS Plattform mit die Klammern halten das Schiff und eine Lastzelle zwischen der feststehenden Motor und der linken Klammer befestigt. Der Einschub zeigt eine detaillierte Draufsicht des auf den Stiften montiert Gefäß.
Protocol
Representative Results
Discussion
Die hier vorgestellten BAXS Plattform ermöglicht zahlreiche Experimente in der Studie von Mechanobiologie aus Untersuchungen von Einzelzellen zu ganzen Geweben. Außerdem ist die Plattform hoch flexibel und konfigurierbar, so dass für zahlreiche mechanische Stimulationsexperimente und multiaxiale Zugversuch. Die Plattform ermöglicht auch die Aufrechterhaltung von Zellen und Geweben unter physiologischen Bedingungen und ermöglicht die gleichzeitige Mikroskopie während des Streckens Experimenten. Die beiden in den vo…
Disclosures
The authors have nothing to disclose.
Acknowledgements
DT wurde von einem Postdoc-Stipendium von le Fonds de Recherche du Québec-Nature et Technologies (FQRNT) und eine MITACS Elevate Strategische Fellowship unterstützt. CMC wurde von einem Postdoc-Stipendium von le Fonds de Recherche en Santé du Québec (FRSQ) und Ernest und Margaret Ford Kardiologie dotierten Forschungsstipendium an der University of Ottawa Heart Institute unterstützt. EOB wurde durch Betriebskostenzuschüsse MOP80204 von der kanadischen Institut für Gesundheitsforschung (CIHR) und T6335 aus der Herz-und Schlaganfall-Stiftung von Ontario unterstützt. Die CIHR und Medtronic kollektiv EOB mit einem Peer-Review-Research Chair (URC # 57093). AEP wird durch die Natural Sciences and Engineering Research Council (NSERC) Entdeckung Grant, NSERC Discovery Accelerator Supplement finanziert und dankt der Unterstützung des Canada Research Chairs (CRC)-Programm und einer früh Researcher Award aus der Provinz Ontario.
Materials
| PDMS | Ellsworth Adhesives | 184 SIL ELAST KIT 0.5KG | The ratio base to cross-linker used in this protocol is 20:1. Mix in a laminar hood to keep dust from contamining your |
| FluoSpheres fluorescent microspheres | Invitrogen | F8810 | Keep away from light. |
| Linear voice coil | Moticont | LVCM-051-051-01 | The motro comes in two pieces (magnet and coil). It has to be mounted on a ball bearing sytem to be functional. |
| Ball bearing slide | Edmund Optics | NT37-360 | Miniature and Small Linear Motion Ball Bearing Slides |
| linear positioning stage | Edmund Optics | 38-960 | Center Drive 1.25" Square Linear Translation Stages |
| optical encoder | GSI microE systems | Mercury II 1600S – 0.5um resolution | reflective incremental encoder. |
| motion controller | Galil | DMC-2143(DIN)-DC48 with AMP-20440 | 4 axis controller with a 4 axis amplifier |
| load cell | Honeywell | 31 low | miniature load cell with a range of 0-150 g |
| Insect minutiens pins (0,20mm) | Pin Service Austerlitz Insect pins | Stainless steel pins that are bended in an opened triangle shape | |
| SU-8 2050 | Micro Chem | SU-8 2050 | Permanent epoxy negative photoresist. Keep away from heat and light |
| Air-plasma treatment system | Glowresearch | Autoglow Oxygen Plasma System | |
| Rat-tail collagen | Invitrogen | A10483-01 | Collagen I, Rat Tail 5mg/ml |
| Hoechst 33342 | Invitrogen | R37605 | DNA-specific fluorescent dye. Keep in the fridge. |
| Kapton (Polyimide Film) Insulated Flexible Heaters | omega.ca | KHLV-0504/(10)-P | 28V flexible heaters; can be supplied with a 24V |
| 1/16 DIN Autotune Temperature and Process Controllers | omega.ca | CN63200-R1-LV | Temperature controller; supply 24 V. |
| DMEM culture medium | Hyclone | SH3024301 | Dulbecco’s Modified 30 Eagle Medium. Keep at 4 C |
| Penicillin-Streptomycin | Hyclone | SV30010 | Keep stock frozen. Keep working solution at 4 C. |
| Fetal bovine serum (FBS) | Hyclone | SH3039603C | Keep frozen. |
| Trypsin 0,05% | Hyclone | SH30236,02 | Keep frozen. Digestion of cell attachement proteins for subcultivation |
| Hepes | Wisent Inc | 330-050-EL | HEPES-buffered salt solution |
| NaCl | Fisher Scientific | BP358-1 | HEPES-buffered salt solution / Krebs physiological solution |
| KCl | Fisher Scientific | BP366-500 | HEPES-buffered salt solution / Krebs physiological solution |
| MgSO4 | Fisher Scientific | M65-500 | HEPES-buffered salt solution / Krebs physiological solution |
| CaCl2 | Fisher Scientific | C614-500 | HEPES-buffered salt solution / Krebs physiological solution |
| Dextrose | Fisher Scientific | BP220-1 | HEPES-buffered salt solution / Krebs physiological solution |
| NaHCO3 | Fisher Scientific | BP328-1 | Krebs physiological solution |
| KH2PO4 | Fisher Scientific | BP362-500 | Krebs physiological solution |
| Carbogen 95% O2/ 5% CO2 | Lindle | DIN:02154749 | Krebs physiological solution oxygenation |
| Nocodazole | Sigma | M1404 | Microtubules depolymerization agent |
| Cytochalasin-D | Sigma | C8273 | Actin filaments depolymerization agent |
| Anti-α-SMA-FITC | Sigma | F3777 | Used to stain and quantify smooth muscle cells content |
| Picrosirius red stain | Fluka | 43665 | Used to stain and quantify collagen content |
References
- Yim, E. K., Sheetz, M. P. Force-dependent cell signaling in stem cell differentiation. Stem Cell Res Ther. 3, (2012).
- Vogel, V., Sheetz, M. Local force and geometry sensing regulate cell functions. Nat Rev Mol Cell Biol. 7, 265-275 (2006).
- Wang, N., Tytell, J. D., Ingber, D. E. Mechanotransduction at a distance: mechanically coupling the extracellular matrix with the nucleus. Nat Rev Mol Cell Biol. 10, 75-82 (2009).
- Ingber, D. E. Mechanobiology and diseases of mechanotransduction. Ann Med. 35, 564-577 (2003).
- Janmey, P. A., Miller, R. T. Mechanisms of mechanical signaling in development and disease. J Cell Sci. 124, 9-18 (2011).
- Bukoreshtliev, N. V., Haase, K., Pelling, A. E. Mechanical cues in cellular signalling and communication. Cell Tissue Res. 352, 77-94 (2013).
- Chen, Y., Pasapera, A. M., Koretsky, A. P., Waterman, C. M. Orientation-specific responses to sustained uniaxial stretching in focal adhesion growth and turnover. Proc Natl Acad Sci USA. 110, (2013).
- Rosenzweig, D. H., Matmati, M., Khayat, G., Chaudhry, S., Hinz, B., Quinn, T. M. Culture of Primary Bovine Chondrocytes on a Continuously Expanding Surface Inhibits Dedifferentiation. Tissue Eng Part A. 18, 2466-2476 (2012).
- Balachandran, K., et al. Cyclic strain induces dual-mode endothelial-mesenchymal transformation of the cardiac valve. Proc Natl Acad Sci USA. 108, 19943-19948 (1994).
- Steward, R., Cheng, C. M., Ye, J., Bellin, R., LeDuc, P. Mechanical stretch and shear flow induced reorganization and recruitment of fibronectin in fibroblasts. Sci Rep. 1, (2011).
- Wang, D., Xie, Y., Yuan, B., Xu, J., Gong, P., Jiang, X. A stretching device for imaging real-time molecular dynamics of live cells adhering to elastic membranes on inverted microscopes during the entire process of the stretch. Integr Biol (Camb). 2, 288-293 (2010).
- Haskett, D., Johnson, G., Zhou, A., Utzinger, U., Van de Geest, J. Microstructural and biomechanical alterations of the human aorta as a function of age and location. Biomech Model Mechanobiol. 9, 725-736 (2010).
- Duprey, A., Khanafer, K., Schlicht, M., Avril, S., Williams, D., Berguer, R. In vitro characterisation of physiological and maximum elastic modulus of ascending thoracic aortic aneurysms using uniaxial tensile testing. Eur J Vasc Endovasc Surg. 39, 700-707 (2010).
- Tremblay, D., et al. A comparison of mechanical properties of materials used in aortic arch reconstruction. Ann Thorac Surg. 88, 1484-1491 (2009).
- Khanafer, K., Duprey, A., Zainal, M., Schlicht, M., Williams, D., Berguer, R. Determination of the elastic modulus of ascending thoracic aortic aneurysm at different ranges of pressure using uniaxial tensile testing. The Journal of thoracic and cardiovascular surgery. 142, 682-686 (2011).
- Van de Geest, J. P., Sacks, M. S., Vorp, D. A. The effects of aneurysm on the biaxial mechanical behavior of human abdominal aorta. J Biomech. 39, 1324-1334 (2006).
- Guolla, L., Bertrand, M., Haase, K., Pelling, A. E. Force transduction and strain dynamics in actin stress fibres in response to nanonewton forces. J Cell Sci. 125, 603-613 (2012).
- Wang, J. H., Goldschmidt-Clermont, P., Wille, J., Yin, F. C. Specificity of endothelial cell reorientation in response to cyclic mechanical stretching. J Biomech. 34, 1563-1572 (2001).
- Jungbauer, S., Gao, H., Spatz, J. P., Kemkemer, R. Two characteristic regimes in frequency-dependent dynamic reorientation of fibroblasts on cyclically stretched substrates. Biophys J. 95, 3470-3478 (2008).
- Dahl, K. N., Ribeiro, A. J. S., Lammerding, J. Nuclear shape, mechanics, and mechanotransduction. Circ Res. 102, 1307-1318 (2008).
- Shivashankar, G. V. Mechanosignaling to the cell nucleus and gene regulation. Annu Rev Biophys. 40, 361-378 (2011).
- Chiquet, M., Gelman, L., Lutz, R., Maier, S. From mechanotransduction to extracellular matrix gene expression in fibroblasts. Biochim Biophys Acta. 1793, 911-920 (2009).
- Sullivan, T., et al. Loss of A-type lamin expression compromises nuclear envelope integrity leading to muscular dystrophy. J Cell Biol. 147, 913-920 (1999).
- Lammerding, J., et al. Lamin A/C deficiency causes defective nuclear mechanics and mechanotransduction. J Clin Invest. 113, 370-378 (2004).
- Tremblay, D., Andrzejewski, L., Leclerc, A., Pelling, A. E. Actin and microtubules play distinct roles in governing the anisotropic deformation of cell nuclei in response to substrate strain. Cytoskeleton. , (2013).
- Cuerrier, C. M., et al. Chronic over-expression of heat shock protein 27 attenuates atherogenesis and enhances plaque remodeling: a combined histological and mechanical assessment of aortic lesions. PLoS ONE. 8, (2013).
- Tremblay, D., Cartier, R., Mongrain, R., Leask, R. L. Regional dependency of the vascular smooth muscle cell contribution to the mechanical properties of the pig ascending aortic tissue. J Biomech. 43, 2448-2451 (2010).
- Barker, A. J., Lanning, C., Shandas, R. Quantification of hemodynamic wall shear stress in patients with bicuspid aortic valve using phase-contrast MRI. Ann Biomed Eng. 38, 788-800 (2010).
- Haga, J. H., Li, Y. S. J., Chien, S. Molecular basis of the effects of mechanical stretch on vascular smooth muscle cells. J Biomech. 40, 947-960 (2007).
- Frydrychowicz, A., et al. Time-resolved magnetic resonance angiography and flow-sensitive 4-dimensional magnetic resonance imaging at 3 Tesla for blood flow and wall shear stress analysis. The Journal of thoracic and cardiovascular surgery. 136, 400-407 (2008).
- Boccafoschi, F., Mosca, C., Bosetti, M., Cannas, M. The role of mechanical stretching in the activation and localization of adhesion proteins and related intracellular molecules. J Cell Biochem. 112, 1403-1409 (2011).
- Yang, G., Crawford, R. C., Wang, J. H. C. Proliferation and collagen production of human patellar tendon fibroblasts in response to cyclic uniaxial stretching in serum-free conditions. J Biomech. 37, 1543-1550 (2004).
- Goldyn, A. M., Rioja, B. A., Spatz, J. P., Ballestrem, C., Kemkemer, R. Force-induced cell polarisation is linked to RhoA-driven microtubule-independent focal-adhesion sliding. J Cell Sci. 122, 3644-3651 (2009).
- Heo, S. J., et al. Fiber stretch and reorientation modulates mesenchymal stem cell morphology and fibrous gene expression on oriented nanofibrous microenvironments. Ann Biomed Eng. 39, 2780-2790 (2011).
- Zdero, R., et al. Linear and torsional mechanical characteristics of intact and reconstructed scapholunate ligaments. J Biomech Eng. 131, (2009).

