荧光共振能量转移研究构象变化的膜蛋白在哺乳动物细胞中表达
Summary
我们在这里介绍了一种改进荧光共振能量转移(LRET)方法,在这里我们介绍的供体和受体荧光基团的站点之间的蛋白酶裂解位点。该变形使得我们能够获得来自感兴趣膜蛋白,使膜蛋白的无蛋白质纯化的研究中出现的具体LRET信号。
Abstract
发光共振能量转移,或LRET,是用来测量在10-100埃的距离范围内的蛋白质两个站点之间的距离的功能强大的技术。通过测量各个连接的情况下的距离,该蛋白质的构象变化可以很容易地进行评估。与LRET,镧系元素,最多螯合铽,用作供体荧光团,得到的优点,如更长的供体 – 仅发光寿命,使用多个受体荧光团的灵活性,并有机会检测致敏受体发射作为一种简单的方法测量不也检测供体只有信号的风险能量转移。在这里,我们描述了使用LRET上表达,并测定完整的哺乳动物细胞的表面上的膜蛋白的方法。我们介绍了荧光LRET对之间蛋白酶切割位点。获取原始LRET信号后,乳沟在该网站将删除的蛋白的特异性信号LRET息使我们能够定量地减去该保持切割后的背景信号。此方法允许更要作出生理学相关的测量,而不需要蛋白质的纯化。
Introduction
荧光共振能量转移(LRET)是著名的荧光共振能量转移(FRET)技术1的衍生物。到FRET相似,LRET可用于测量距离和附着在上的10-100埃1-3的范围内的感兴趣的蛋白的特定位点供体和受体荧光团之间的距离的变化。是LRET的原理也类似于在该共振能量转移到FRET发生2近侧的荧光团之间时,供体荧光团的发射光谱与受体荧光团的吸收光谱重叠。这个转移的效率有关,这两个荧光团由下面的等式之间的距离:
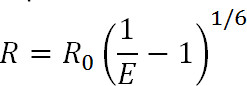 式。 1
式。 1
其中,R是两个荧光团之间的距离,E是连接的效率ERGY转移,且R 0,下面所讨论的,是福斯特半径为荧光团对, 即在其中传递的效率是半最大的距离。从这个等式中,可以看出,效率与上升到逆第六电源1的距离的大小。正是这种逆第六功率的依赖,允许FRET和LRET测量是连到小的距离的变化极其敏感,当FRET对的R 0附近。专门标记的蛋白质或其他大分子所需站点的能力允许我们利用这个敏感的优势,监控的构象变化。
时相比,荧光共振能量转移,其使用传统的有机染料分子,LRET提供了额外的优点。而不是使用有机染料作为供体荧光团,镧系阳离子,通常是铽或铕在LRET,用于1,4-6。那年秋天ü荧光升气管这一类, 如铽螯合物,也非常灵活的,因为它们可以具有广泛的受体荧光团的使用。这种灵活性是可能的,因为螯合的镧系元素的发射光谱包含多个尖锐的发射峰,允许一个单一物种供体荧光团能够与各种各样受体荧光团中的一个使用。因此,可以在没有任何担心从供体发射5污染泄流通过的被检测致敏的受体发射。实验者选择基于两个荧光团( 图1和表1)之间的期望距离的特定受体。在这些螯合的镧系元素的荧光团,该金属离子是由包含敏化的通常较差吸收的镧系元素的激发以及丰富的生物反应性官能团的系绳的离子对特定官能团的高分子1的天线组分子螯合, 5,6。 ONCê兴奋,镧系元素,通过光子带衰减率在毫秒范围内释放放宽到基态。由于衰变既不是单峰对单峰松弛也不三重态到单重态放松,光子的发射不能适当地被称为荧光或磷光,而是更恰当地称为发光1。稀土发光的长期衰退极大地有助于寿命测量。寿命的测量可以被用来确定通过下列关系效率:
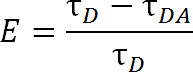 式。 2
式。 2
其中,E为转移的效率,τD是供体(螯合稀土)的时候不参与能量转移的寿命,τDA是供体的寿命与受体能量转移,当参与。随着LRET,τDA可以人所以被测量作为致敏受体发射的寿命,因为铽的寿命是这样比的有机受体荧光团大得多。具有相同的寿命作为其指使激发(供体的镧系元素)的受体发射,并从受自身的固有荧光寿命的寿命的任何贡献相对可以忽略不计。通过测定致敏发射,而不是供体发射,我们也无需确保标签在恰好为1:1的比例供体与受体。蛋白质可以改为同时与受体和供体荧光标记。 à不均匀标记人口造成的,但双供体标记的蛋白质将不会发出在接受波长和双受体标记的蛋白质将不激动。此外,荧光团之间的距离应该是相同的,而不管其中的半胱氨酸位点的特定荧光团附着,使用各向同性的镧系元素作为供体尤其是当,所以娘家姓d,来指定一个特定的网站分别接受供体或受体是不必要的。强度可能会受到与异质群体,但仍应该超过足以被检测到。
在规划的实验中,荧光团的选择应是R 0值的一对,以及预期的距离范围来规定被测量。在R 0的值被定义由下面的等式:
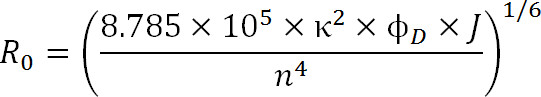 式。 3
式。 3
其中,R 0为福斯特半径埃,κ2是两种染料(通常假设为三分之二)之间的取向因子,φD为供体的量子产率,J为光谱重叠积分捐赠者的间发射光谱和受体的吸收光谱中的M – 1-1处4,且n是介质1的折射率。
我们的实验室已通过对蛋白质的供体和受体标记位点之间引入蛋白酶识别位点被探测添加修改常规LRET技术。该变形允许调查在未纯化系统,例如整个哺乳动物细胞7。使用半胱氨酸作为位点标记时,由于在与结合于半胱氨酸的巯基,其它蛋白质上具有半胱氨酸还标记了的细胞的马来酰亚胺共轭染料标记的过程中该技术是特别有用的。然而,通过包括对感兴趣的蛋白的蛋白酶裂解位点和之前和裂解后测量的寿命,实验者可以定量地减去从原始信号蛋白酶裂解后的背景信号。这个减法隔离感兴趣的蛋白质产生的特定信号( 图尤尔2)。使用上述的变形例中,LRET可用于测量铽螯合物供体和对蛋白质的受体探针之间的距离的变化,并由此监视未经纯化的要求,在蛋白质的接近生理状态的构象变化。
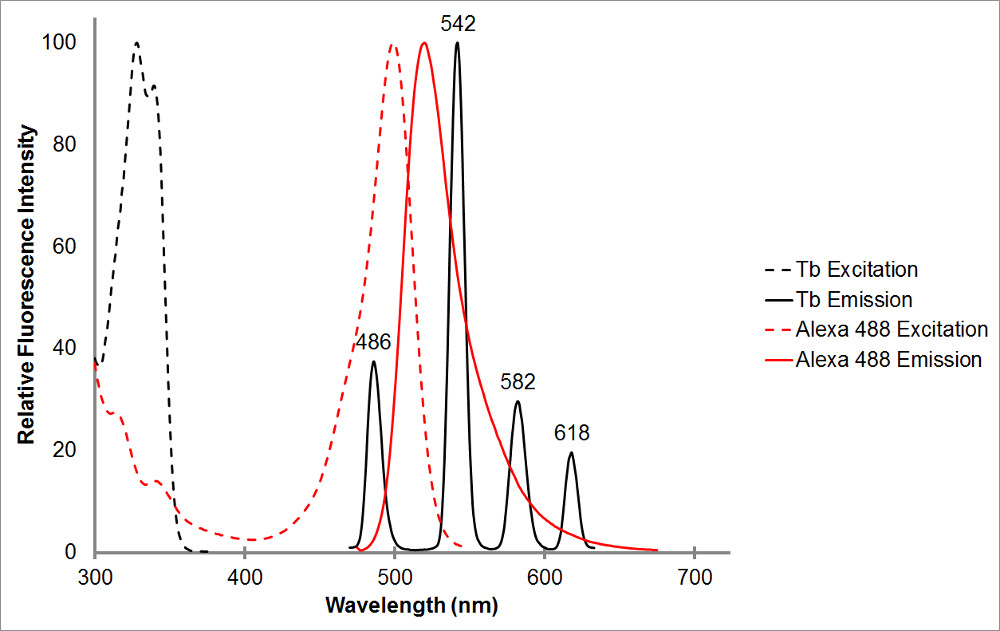
图1,吸收和螯合铽在黑,以及作为代表性受体的Alexa 488,在红色的发射光谱图。注意,多个发射峰和铽螯合物的各峰的尖锐,窄的发射范围。这种模式允许对与多种受体荧光团的用铽和便于这些范围,其中铽表明没有发射内致敏发射的测量。在486铽的发光峰值波长与A重叠相当不错的Alexa 488的bsorption峰,允许共振能量转移两个荧光团之间发生。 515nm的波长是一个很好的选择,检测致敏排放为这双,因为它是在铽发射峰之间的山谷中,相当接近520纳米的Alexa 488的发射峰。注意,被附近的受体峰,虽然理想的,则不需要-565(nm)是仍然能够检测到没有同时检测铽发射的Alexa 488发射。
| 受体荧光基团 | R 0() | 发射波长(nm) |
| 阿托465 | 36 | 3px的;“> 508|
| 荧光素 | 45 | 515 |
| Alexa的488 | 46 | 515 |
| Alexa的680 | 52 | 700 |
| Alexa的594 | 53 | 630 |
| Alexa的555 | 65 | 565 | Cy3标记 | 65 | 575 |
表1常用的受体荧光基团用铽螯合物作为捐助11 LRET列表。在R 0的值进行测定时,供体和受体被装AMPA受体的可溶性受体激动剂结合域。它是理想的,重新测量R 0值正在研究每一个新的系统。
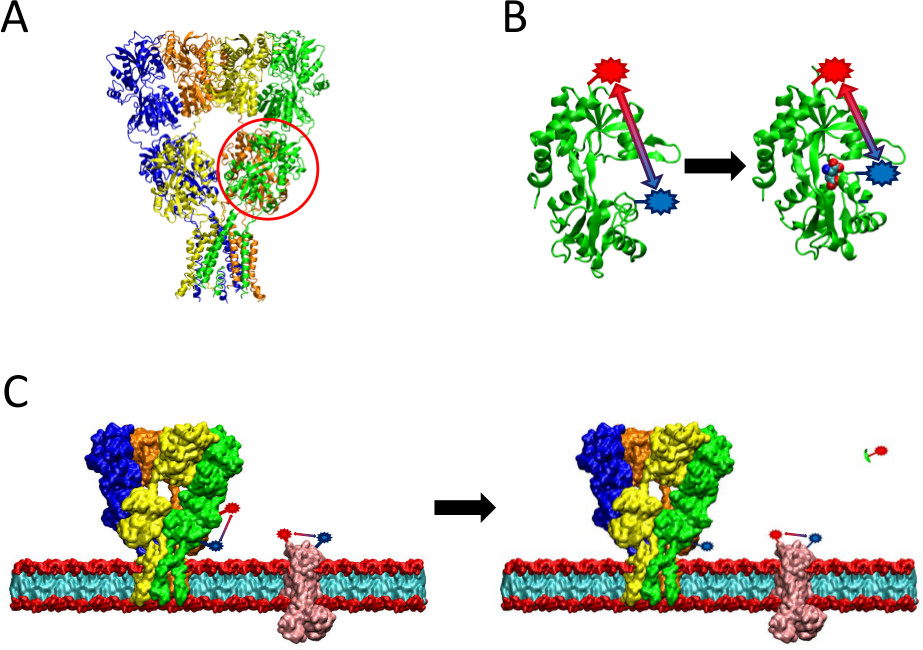
图2呈现的LRET方法的概述。(A)中的 AMPA受体是一种膜蛋白,其经历在配体结合构象变化。在翻盖型配体的双nding域在这里红色圆圈。 (B)存在于开放构象(左)AMPA的在未结合蛋白的配体结合结构域。当绑定到配体谷氨酸,在蛋白质周围的配体(右)关闭。通过将荧光团在证明的站点上的发光二极管,此构象变化的性质,可以被看作是荧光团的改变,这将影响随后的荧光寿命之间的距离。 (C)当标记的全细胞,可能会发生的利息两者蛋白质以及背景的膜蛋白的标记(左)。蛋白酶裂解后,从感兴趣的蛋白质LRET信号就会消失,由于可溶性片段的释放,而使背景信号完好(右)。此背景信号然后可减去从原始信号。
Protocol
Representative Results
Discussion
LRET是一种强大的技术,使科学家可以在一个单一的蛋白质,以及在多聚蛋白亚基之间测量域之间的距离。正因为如此,LRET是非常适合于研究的蛋白质或其他大分子的构象变化和动力学。上述协议应允许适当装备的实验室能够轻松地测试他们的假设;然而,也有错误的可能困扰新调查许多常见来源。如果很少或没有LRET信号看出,首先检查所用的波长设置。激励应铽(330-340纳米)的吸收范围。为施?…
Disclosures
The authors have nothing to disclose.
Acknowledgements
这项工作是由卫生部授予GM094246,美国心脏协会授予11GRNT7890004,以及美国国家科学基金会资助的MCB-1110501国家机构的支持。
Materials
| Name of Reagent/ Equipment | Company | Catalog Number | Comments/Description |
| LanthaScreen Thiol Reactive Tb Chelate | Life Technologies | PV3579 | |
| Acceptor fluorophore-Fluorescein-5-Maleimide | Life Technologies | F-150 | Choice of acceptor depends on the specific experiment |
| Acceptor fluorophore-Alexa Fluor 488 C5 Maleimide | Life Technologies | A-10254 | Choice of acceptor depends on the specific experiment |
| Acceptor fluorophore-Alexa Fluor 555 C2 Maleimide | Life Technologies | A-20346 | Choice of acceptor depends on the specific experiment |
| Acceptor fluorophore-Alexa Fluor 594 C5 Maleimide | Life Technologies | A-10256 | Choice of acceptor depends on the specific experiment |
| Acceptor fluorophore-Alexa Fluor 680 C2 Maleimide | Life Technologies | A-20344 | Choice of acceptor depends on the specific experiment |
| QuantaMaster 3-SS | Photon Technology International | Spectrofluorometer should have pulsed excitation with the ability to measure lifetimes in the ms range | |
| FluoreScan 2.0 | Photon Technology International | Data Acquisition Software used in manuscript. Software provided with fluorescence instrument. | |
| Origin 8.6 | OriginLab | Origin is the data analysis software used in protocol. Can use other similar data analysis software | |
| Quartz Cuvette | Starna Cells, Inc | 3-Q-10 | |
| Stir Bar | Bel-Art Products | F37119-0007 | Used in cuvette to keep cells in suspension. Can use any stir bar that fits the cuvette |
References
- Selvin, P. R. Principles and biophysical applications of lanthanide-based probes. Annual Review of Biophysics and Biomolecular Structure. 31, 275-302 (2002).
- Stryer, L., Haugland, R. P. Energy transfer: a spectroscopic ruler. Proceedings of the National Academy of Sciences of the United States of America. 58, 719-726 (1967).
- Stryer, L. Fluorescence energy transfer as a spectroscopic ruler. Annual Review of Biochemistry. 47, 819-846 (1978).
- Selvin, P. R., Hearst, J. E. Luminescence energy transfer using a terbium chelate: improvements on fluorescence energy transfer. Proceedings of the National Academy of Sciences of the United States of America. 91, 10024-10028 (1994).
- Chen, J., Selvin, P. R. Thiol-reactive luminescent chelates of terbium and europium. Bioconjugate Chemistry. 10, 311-315 (1999).
- Ge, P., Selvin, P. R. Thiol-reactive luminescent lanthanide chelates: part 2. Bioconjugate Chemistry. 14, 870-876 (2003).
- Gonzalez, J., Rambhadran, A., Du, M., Jayaraman, V. LRET investigations of conformational changes in the ligand binding domain of a functional AMPA receptor. Biochemistry. 47, 10027-10032 (2008).
- Ramaswamy, S. S., Maclean, D. M., Gorfe, A. A., Jayaraman, V. Proton mediated conformational changes in an Acid Sensing Ion Channel. J. Bio. Chem. 288, (2013).
- Rambhadran, A., Gonzalez, J., Jayaraman, V. Conformational changes at the agonist binding domain of the N-methyl-D-aspartic acid receptor. The Journal of Biological Chemistry. 286, 16953-16957 (2011).
- Rambhadran, A., Gonzalez, J., Jayaraman, V. Subunit arrangement in N-methyl-D-aspartate (NMDA) receptors. The Journal of Biological Chemistry. 285, 15296-15301 (2010).
- Kokko, T., Kokko, L., Soukka, T. Terbium(III) chelate as an efficient donor for multiple-wavelength fluorescent acceptors. Journal of Fluorescence. 19, 159-164 (2009).

