発光共鳴エネルギーは、哺乳動物細胞で発現膜タンパク質の立体構造変化を研究するために転送
Summary
ここでは私たちはドナーとアクセプターフルオロフォアサイト間のプロテアーゼ切断部位を導入する改良された発光共鳴エネルギー移動(LRET)方法を記載している。この修飾は、タンパク質精製せずに膜タンパク質の研究を可能にする、目的の膜タンパク質から生じる特定のLRET信号を得ることを可能にする。
Abstract
発光共鳴エネルギー移動、またはLRETは、10〜100オングストロームの距離範囲内のタンパク質内の2つのサイト間の距離を測定するために使用される強力な技術である。さまざまなライゲーション条件下での距離を測定することにより、タンパク質のコンホメーション変化を容易に評価することができる。 LRET、ランタニド、最も頻繁にキレート化テルビウムにより、そのような長いドナーのみの発光寿命は、複数のアクセプターフルオロフォアを使用するには、柔軟性、および簡単な方法として、感作されたアクセプター発光を検出するための機会としての利点を与える、ドナー蛍光体として使用されているまた、ドナーのみの信号を検出するリスクなしに、エネルギー移動を測定した。ここでは、インタクトな哺乳動物細胞の表面上で発現され、アッセイされた膜タンパク質にLRETを使用する方法を記載する。私たちは、LRET蛍光団ペア間のプロテアーゼ切断部位を導入する。元のLRET信号を取得した後、その部位での切断は、タンパク質の特定のLRET信号を除去私たちは、定量的に切断した後に残る背景信号を減算することを可能に関心。この方法は、タンパク質の精製を必要とせずに行うべき複数の生理学的に関連性の測定を可能にする。
Introduction
発光共鳴エネルギー移動(LRET)は、周知の蛍光共鳴エネルギー移動(FRET)技術1の誘導体である。 FRETと同様に、LRETは10〜100オングストローム〜3の範囲内で、目的のタンパク質上の特定の部位に結合したドナーとアクセプターフルオロフォア間の距離と距離の変化を測定するために使用することができる。 LRETの原理は、その共鳴エネルギー移動にFRETに類似しているドナーフルオロフォアの発光スペクトルがアクセプターフルオロフォアの吸収スペクトルと重なった場合2近位の蛍光団の間で起こる。この移動の効率は、次式による二フルオロフォア間の距離に関係する。
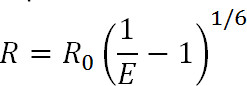 式1
式1
R二つのフルオロフォア間の距離であり、Eは、専用の効率である以下に説明ギー転送、およびR 0は 、転送の効率が最大半減する距離、すなわち 、フルオロフォアペアのフェルスター半径である。この式から、人はその効率は逆6乗1に上げ、距離の大きさに関係して見ることができます。これは、FRETとLRET測定があっても、FRET対のR 0に近い小さな距離の変化に絶妙に敏感であることが可能になり、この逆6乗依存性である。具体的にはタンパク質または他の巨大分子上の所望の部位を標識する能力は、一方が立体構造変化を監視するには、この感度を活用することができる。
従来の有機色素分子を使用して、FRET、と比較すると、LRETは追加の利点を提供しています。 LRETでは、代わりにドナーフルオロフォア、ランタニド系列の陽イオン、典 型的には、Tbの3+かのEu 3 +などの有機色素を使用するのではなく、1,4-6使用されている。 uの秋フルオロフォアそれらはアクセプターフルオロフォアの広い範囲で使用できるように、このカテゴリ、 例えば 、テルビウムキレートファインダーも非常に汎用性があります。キレート化ランタニドの発光スペクトルがアクセプターフルオロフォアの多種多様のいずれかで使用されるドナーフルオロフォアの単一種を可能にする、複数の鋭い発光ピークが含まれているので、この柔軟性が可能となる。このように、増感アクセプター発光はドナー発光5からのブリードスルーを汚染を恐れることなく検出することができる。実験者は、2つのフルオロフォア( 図1および表1)との間の予想される距離に基づいて、特定の受容体を選択する。これらのキレート化ランタニド蛍光団で、金属イオンが高分子1上の特定の官能基にイオンを係留するために生物反応性官能基と同様に励起するために、通常、難吸収性のランタニドを感作アンテナグループを含む分子によってキレート化され、 5,6。 ONC電子励起し、ランタニドは、ミリ秒の範囲の減衰率を持つ光子の放出を介して基底状態に緩和する。減衰は一重対一重緩和も三重項対一重緩和でもないので、光子の放出を適切に蛍光または燐光を呼び出すことはできませんが、より適切にルミネ1と呼ばれる。ランタニド発光の長い減衰が大幅に寿命測定に役立ちます。寿命測定は、以下の関係を介して効率を決定するために使用することができる。
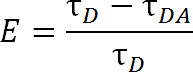 式2
式2
ここで、Eは、伝達の効率であり、τDは、エネルギー移動に関与していないドナー(キレート化ランタニド)の寿命であり、アクセプターとのエネルギー伝達に関与するときτDAは、ドナーの寿命である。 LRET付き、τDAがアル缶テルビウムの寿命はそんなに大きな有機アクセプターフルオロフォアよりもあるので、そのように感作されたアクセプター発光の寿命として測定する。アクセプターは、その扇動励起(ドナーランタニド)と同じ寿命で発光し、アクセプタ自身の固有の蛍光寿命から寿命への寄与は相対的に無視できる。アクセプター、ドナーの1の比率:むしろドナー発光よりも感作された放射を測定することにより、私たちも正確に1にラベル付けを確保する必要がなくなります。タンパク質の代わりに受容体および供与体フルオロフォアの両方で同時に標識することができる。不均一に標識人口はなりますが、二重ドナー標識タンパク質は、アクセプター波長で発光せず、二重受容体標識されたタンパク質は、励起されることはありません。さらに、フルオロフォアの間の距離は同じであるべきであるにかかわらず、どのシステイン部位の特定のフルオロフォアはドナーとしての等方性ランタニドを使用する場合は特に、に付着するので、旧姓ドナーまたはアクセプタのいずれかを受信するために特定のサイトを指定するには、dは不要です。強度が不均一な集団で影響を受ける可能性があるが、依然として検出されるのに十分すぎるほどであるべきである。
実験を計画する際には、フルオロフォアの選択は、一組のR 0の値だけでなく、測定中の予想される距離範囲によって決定されるべきである。 R 0値は、次式で定義される。
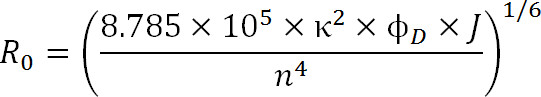 式3
式3
ここで、R 0はオングストロームでフェルスター半径、2κは(通常は3分の2であると仮定)は、2つの色素間の配向因子であり、φDは 、ドナーの量子収量であり、Jはドナーの間の積分スペクトルの重なりがある1 – Mにおける発光スペクトルとアクセプターの吸収スペクトル-1〜4nm であり、nは媒質1の屈折率である。
当研究室では、プローブさ、タンパク質上のドナーとアクセプターラベル部位の間にプロテアーゼ認識部位を導入することにより、従来のLRET手法への変更を追加しました。この変更は、全哺乳類の細胞7などの非精製されたシステムでの調査が可能になります。標識化のための部位としてシステインを使用する場合に、システインのスルフヒドリル基に結合したマレイミド共役色素で標識する過程で、システインを有する細胞上の他のタンパク質も標識されているので、この技術は、特に有用である。しかし、目的のタンパク質に対するプロテアーゼ切断部位を含む、および切断前後の寿命を測定することにより、実験者は、定量的に生の信号からプロテアーゼ切断後のバックグラウンドシグナルを差し引くことができる。この減算は、( 図興味のあるタンパク質から生じる特定の信号を分離するURE 2)。上記の変法を用いて、LRETは、タンパク質上のテルビウムキレートドナーおよびアクセプタープローブとの間の距離の変化を測定するため、精製を必要とせずに、タンパク質の近くの生理学的状態の立体配座の変化を監視するために使用することができる。
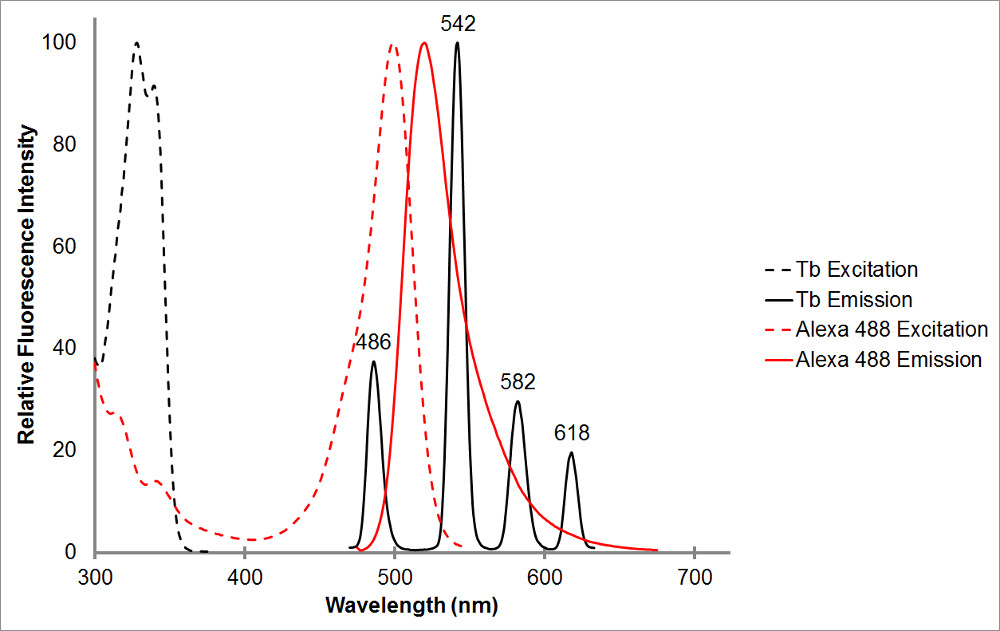
赤図1。吸収と発光スペクトル黒でキレート化テルビウムのと同様に、代表的なアクセプター、アレクサ488、。複数の発光ピークとテルビウムキレートの各ピークシャープ、狭い発光範囲を注目してください。このパターンは、テルビウムアクセプターフルオロフォアの多様で使用することが可能となり、テルビウムには発光を示していないこれらの範囲内で感作された放射の測定を容易にする。 Aで非常によく重なって波長486におけるテルビウムの発光ピーク 2のフルオロフォアの間で発生する共鳴エネルギー移動を可能にするアレクサ488のbsorptionピーク、。 515の波長は、テルビウムの発光ピークの間の谷にあり、非常に520ナノメートルのアレクサ488の発光ピークの近くに、このペアに対して感作された放射を検出するための優れた選択肢です。アクセプターピーク付近であることが望ましいものの、必要とされていない-565 nmは、まだまたテルビウム発光を検出することなく、アレクサ488放射を検出することが可能であることに注意してください。
| アクセプターフルオロフォア | R 0(Å) | 発光波長(nm) |
| アトー465 | 36 | 3px; "> 508|
| フルオレセイン | 45 | 515 |
| アレクサ488 | 46 | 515 |
| アレクサ680 | 52 | 700 |
| アレクサ594 | 53 | 630 |
| アレクサ555 | 65 | 565 | のCy3 | 65 | 575 |
表1 LRETドナー11としてテルビウムキレートを使用するための一般的に使用されるアクセプターフルオロフォアのリスト 。ドナーおよびアクセプターは、AMPA受容体の可溶性アゴニスト結合ドメインに結合させた場合には、R 0値を測定した。それは、それぞれの新しいシステムが研究されて、再びR 0の値を測定することが理想的である。
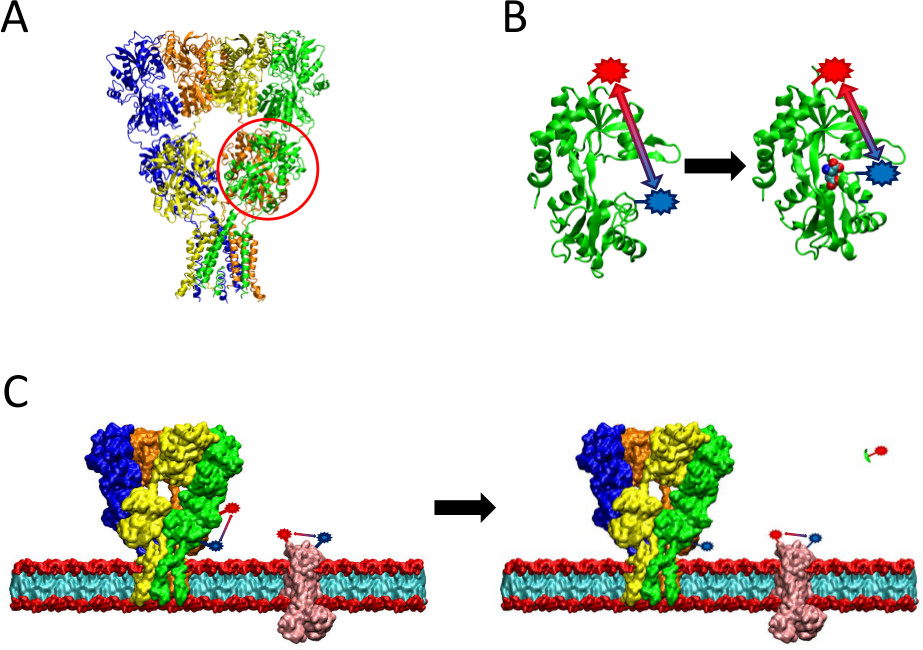
図2に示さLRET方法の概要。(A)AMPA受容体は、リガンド結合時にコンフォメーション変化を受ける膜タンパク質である。クラムシェル形のリガンド – ビndingドメインはここに赤で丸で囲まれている。 (B)タンパク質に結合していない、AMPAのリガンド結合ドメインは、オープン構造(左)に存在します。グルタミン酸をリガンドに結合すると、タンパク質は、そのリガンド(右)を中心に閉じます。 LBD上の証拠のサイトでフルオロフォアを確定すると、このコンフォメーション変化の性質は、その後、蛍光寿命に影響を与えるフルオロフォアの変化との間の距離として見ることができます。 (C)全細胞を標識する場合、目的のタンパク質と同様に、バックグラウンドの膜タンパク質の両方の標識(左)起こり得る。プロテアーゼ切断した後、目的のタンパク質からLRET信号はそのままバックグラウンド信号(右)を残し、原因可溶性フラグメントが放出されなくなります。このバックグラウンド信号は、原信号から減算することができる。
Protocol
Representative Results
Discussion
LRETは、科学者が単一のタンパク質内だけでなく、多量体タンパク質中のサブユニットの間のドメイン間の距離を測定することができる強力な手法です。このように、LRETは、タンパク質または他の巨大分子の立体構造変化とダイナミクスを調べることに適しています。上記のプロトコルは、簡単に自分の仮説をテストするために、適切に装備ラボを許可する必要があります。しかし、新しい?…
Disclosures
The authors have nothing to disclose.
Acknowledgements
この作品は、健康グラントGM094246、米国心臓協会グラント11GRNT7890004、国立科学財団助成MCB-1110501の国立研究所によってサポートされていました。
Materials
| Name of Reagent/ Equipment | Company | Catalog Number | Comments/Description |
| LanthaScreen Thiol Reactive Tb Chelate | Life Technologies | PV3579 | |
| Acceptor fluorophore-Fluorescein-5-Maleimide | Life Technologies | F-150 | Choice of acceptor depends on the specific experiment |
| Acceptor fluorophore-Alexa Fluor 488 C5 Maleimide | Life Technologies | A-10254 | Choice of acceptor depends on the specific experiment |
| Acceptor fluorophore-Alexa Fluor 555 C2 Maleimide | Life Technologies | A-20346 | Choice of acceptor depends on the specific experiment |
| Acceptor fluorophore-Alexa Fluor 594 C5 Maleimide | Life Technologies | A-10256 | Choice of acceptor depends on the specific experiment |
| Acceptor fluorophore-Alexa Fluor 680 C2 Maleimide | Life Technologies | A-20344 | Choice of acceptor depends on the specific experiment |
| QuantaMaster 3-SS | Photon Technology International | Spectrofluorometer should have pulsed excitation with the ability to measure lifetimes in the ms range | |
| FluoreScan 2.0 | Photon Technology International | Data Acquisition Software used in manuscript. Software provided with fluorescence instrument. | |
| Origin 8.6 | OriginLab | Origin is the data analysis software used in protocol. Can use other similar data analysis software | |
| Quartz Cuvette | Starna Cells, Inc | 3-Q-10 | |
| Stir Bar | Bel-Art Products | F37119-0007 | Used in cuvette to keep cells in suspension. Can use any stir bar that fits the cuvette |
References
- Selvin, P. R. Principles and biophysical applications of lanthanide-based probes. Annual Review of Biophysics and Biomolecular Structure. 31, 275-302 (2002).
- Stryer, L., Haugland, R. P. Energy transfer: a spectroscopic ruler. Proceedings of the National Academy of Sciences of the United States of America. 58, 719-726 (1967).
- Stryer, L. Fluorescence energy transfer as a spectroscopic ruler. Annual Review of Biochemistry. 47, 819-846 (1978).
- Selvin, P. R., Hearst, J. E. Luminescence energy transfer using a terbium chelate: improvements on fluorescence energy transfer. Proceedings of the National Academy of Sciences of the United States of America. 91, 10024-10028 (1994).
- Chen, J., Selvin, P. R. Thiol-reactive luminescent chelates of terbium and europium. Bioconjugate Chemistry. 10, 311-315 (1999).
- Ge, P., Selvin, P. R. Thiol-reactive luminescent lanthanide chelates: part 2. Bioconjugate Chemistry. 14, 870-876 (2003).
- Gonzalez, J., Rambhadran, A., Du, M., Jayaraman, V. LRET investigations of conformational changes in the ligand binding domain of a functional AMPA receptor. Biochemistry. 47, 10027-10032 (2008).
- Ramaswamy, S. S., Maclean, D. M., Gorfe, A. A., Jayaraman, V. Proton mediated conformational changes in an Acid Sensing Ion Channel. J. Bio. Chem. 288, (2013).
- Rambhadran, A., Gonzalez, J., Jayaraman, V. Conformational changes at the agonist binding domain of the N-methyl-D-aspartic acid receptor. The Journal of Biological Chemistry. 286, 16953-16957 (2011).
- Rambhadran, A., Gonzalez, J., Jayaraman, V. Subunit arrangement in N-methyl-D-aspartate (NMDA) receptors. The Journal of Biological Chemistry. 285, 15296-15301 (2010).
- Kokko, T., Kokko, L., Soukka, T. Terbium(III) chelate as an efficient donor for multiple-wavelength fluorescent acceptors. Journal of Fluorescence. 19, 159-164 (2009).

