Свечение резонанс переноса энергии по изучению конформационных изменений мембранных белков выражается в клетках млекопитающих
Summary
Мы описываем здесь метод улучшить перевод люминесценция резонансной энергии (LRET), где мы вводим сайт расщепления протеазой между донором и акцептором флуорофорных сайтов. Эта модификация позволяет получить конкретные LRET сигналы, связанные с мембранными белками интересов, что позволяет для изучения мембранных белков без очистки белка.
Abstract
Свечение Резонанс Передача энергии, или LRET, является мощным средством для измерения расстояния между двумя узлами в белках в диапазоне расстояний 10-100 Å. Измеряя расстояния при различных лигированных условиях, конформационные изменения белка можно легко оценить. С LRET, лантанида, чаще всего в хелатной тербия, используется в качестве доноров флуорофором, предоставляя преимущества, такие как более длительный срок службы донорами только эмиссии, гибкость в использовании нескольких флуорофоры акцепторные, и возможность выявления сенсибилизированную эмиссию акцепторный как легкий способ для измерения перенос энергии без риска также обнаружения доноров только сигнал. Здесь мы описываем способ, чтобы использовать LRET на мембранных белков, экспрессированных и анализировали на поверхности интактных клетках млекопитающих. Введем сайт расщепления протеазой между флуорофором пары LRET. После получения исходного сигнала LRET, расщепление в этом сайте удаляет конкретный LRET сигнал от белкаИнтерес позволяет нам количественно вычесть фоновый сигнал, который остается после расщепления. Этот способ позволяет более физиологически соответствующие измерения быть сделаны без необходимости очистки белка.
Introduction
Свечение Резонанс Передача энергии (LRET) является производным от известный флуоресцентного резонанса Передача энергии (FRET) техники 1. Похожие беспокоиться, LRET могут быть использованы для измерения расстояний и изменения расстояния между донором и акцептором флуорофорами прикрепленных к определенным сайтам на интересующего белка в диапазоне 10-100 Å 1-3. Принципы LRET также похожи на FRET в этом резонансный перенос энергии происходит между двумя проксимальных флуорофорами когда спектр излучения донора флуорофором перекрывает со спектром поглощения акцептора флуорофора. Эффективность этой передачи связано с расстоянием между двумя флуорофоров с помощью следующего уравнения:
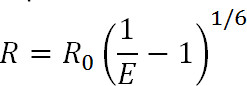 Уравнение. 1
Уравнение. 1
где R является расстояние между двумя флуорофорами, E является эффективность ангия передачи, и R 0, обсуждается ниже, радиус Ферстер для пары флуорофором, т.е. расстояние, на котором эффективность переноса является полумаксимальную. Из этого уравнения, можно видеть, что эффективность будет зависеть от величины расстояния возведенного в обратной шестой степени 1. Именно эта обратная шестой степенная зависимость, что позволяет рвать и измерений LRET быть чрезвычайно чувствительны даже к небольшим изменениям расстояния, когда рядом с R 0 пары FRET. Возможность специально маркировать нужные сайты на белков или других макромолекул позволяет воспользоваться этой чувствительности для контроля конформационные изменения.
По сравнению с FRET, который использует обычные молекул органических красителей, LRET предлагает дополнительные преимущества. В LRET, вместо использования органического красителя, как доноров флуорофором, лантаноид серии катиона, как правило, Tb 3 + или Eu 3 +, используется 1,4-6. Флуорофоры которые попадают UNDER этой категории, например, хелат тербия, также очень универсальным в том, что они могут быть использованы с широким диапазоном акцепторных флуорофоров. Эта гибкость стало возможным потому, что спектры излучения хелатных лантаноидов содержать несколько острых пиков выбросов, что позволяет в течение одного вида донора флуорофора, которые будут использоваться с одним из самых разнообразных акцепторных флуорофоров. Таким образом, сенсибилизированные выбросов акцептор может быть обнаружен, не опасаясь загрязнения проступание от излучения донора 5. Экспериментатор выбирает определенную акцептор на основе ожидаемого расстояния между двумя флуорофорами (рисунок 1 и таблица 1). В этих хелатных лантанидов флуорофоров, ион металла хелатные молекулой, которая содержит группу антенн, что повышает чувствительность обычно плохо поглощающие лантаноид возбуждению, а в качестве функциональной группы bioreactive троса ион с конкретной функциональной группы на макромолекулы 1, 5,6. Oncэ рады, лантаноиды расслабиться в основное состояние с помощью выпуска фотонов со скоростью распада в диапазоне миллисекунд. Потому что распад не является ни релаксации синглетного к-синглет, ни релаксации триплет-на-синглет, излучение фотонов может не правильнее было бы назвать флуоресценции или фосфоресценции, но более правильно называть свечение 1. Длинная распад лантаноида люминесценции сильно помогает в измерение времени жизни. Измерение времени жизни, то можно использовать для определения эффективности по следующим соотношением:
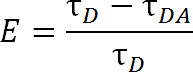 Уравнение. 2
Уравнение. 2
где, E является эффективность передачи, τ D является время жизни донора (хелатные лантанидов), когда не участвующем в передаче энергии, и τ DA время жизни донора при участии в передаче энергии с акцептором. С LRET, τ DA может альтак быть измерена как время жизни сенсибилизированной эмиссии акцепторной потому срок службы тербия является настолько больше органического акцептора флуорофора. Акцептор излучает с той же жизни, как ее разжигание возбуждения (донора лантаноидов), и любой вклад в жизни от собственной жизни собственной флуоресценции акцептора относительно незначительным. Измеряя сенсибилизированный излучению, а не излучения донора, мы также устранить необходимость обеспечения маркировки ровно в соотношении 1: 1 донора к акцептору. Белок может быть вместо этого помечены одновременно с обеих акцептора и доноров флуорофорами. Гетерогенно помечены населения приведет, но дважды доноры меченые белки не издаст в волны акцепторной и дважды акцепторные меченые белки не будут рады. Кроме того, расстояние между флуорофоров должны быть одинаковыми, независимо от цистеина-сайт с учетом флуорофор придает, особенно при использовании изотропные лантаноиды в качестве донора, так что урождённаяд указать данный сайт на получение либо донор или акцептор является необходимым. Интенсивность может повлиять с гетерогенной популяции, но по-прежнему должны быть более чем достаточными, чтобы быть обнаружены.
При планировании экспериментов, выбор флуорофоров должны быть продиктовано R 0 значением пары, а также ожидаемого диапазона расстояний измерения. Значение R 0, определяется следующим уравнением:
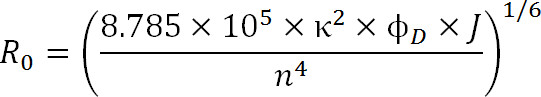 Уравнение. 3
Уравнение. 3
где, R 0 радиус Ферстер в ангстрем, κ 2 является фактором ориентации между двумя красителями (которые обычно считаются 2/3), φ D является квантовый выход донора, J является спектральный интеграл перекрытия между донора Спектр излучения и поглощения спектра акцептора в М – 1см -1 нм 4 и п-показатель преломления среды 1.
Наша лаборатория добавила модификацию традиционной методике LRET путем введения сайт узнавания протеазы между донором и акцептором этикеток сайтов белка зондируемой. Эта модификация позволяет расследования в неочищенные систем, таких как целых клеток млекопитающих 7. Этот метод особенно полезен при использовании цистеина в качестве участков для маркировки, так как в процессе маркировки с малеимид-конъюгированного красителей, которые связываются с цистеиновых сульфгидрильных групп, других белков в клетках, которые имеют цистеина также помечены. Тем не менее, в том числе с помощью протеазы сайтов расщепления на интересующего белка и измерения времени жизни до и после расщепления, экспериментатор может количественно вычесть фоновый сигнал после расщепления протеазой от исходного сигнала. Это вычитание изолирует определенный сигнал, возникающий от интересующего белка (рисЮр 2). Использование модификации описанного выше, LRET может быть использован для измерения изменения расстояния между тербия хелатного донором и акцептором зонда на белок, и, таким образом, контролировать конформационные изменения в ближайшем физиологического состояния белка без необходимости очистки.
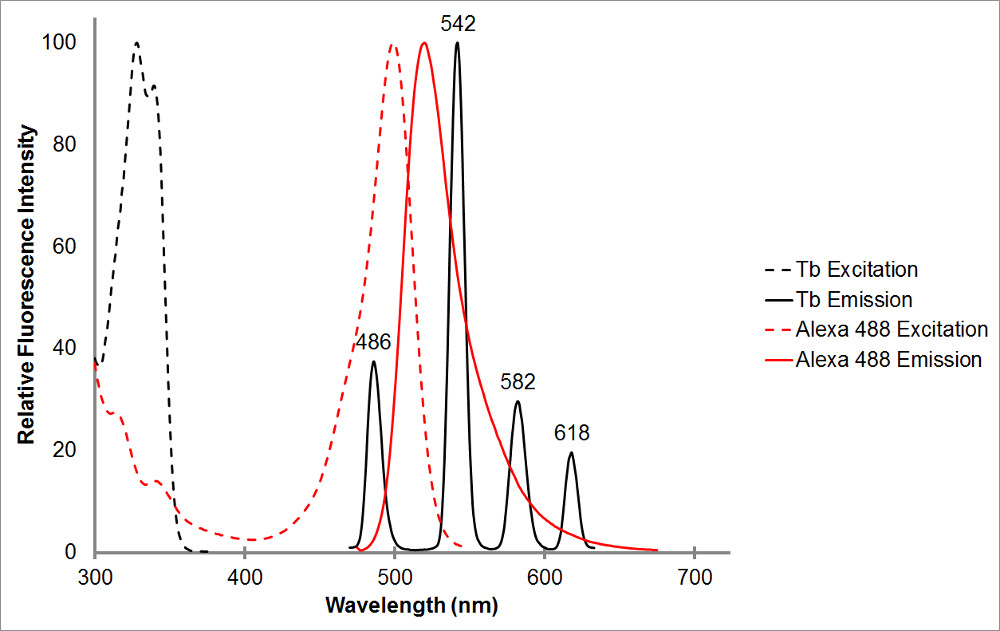
Рисунок 1.The поглощения и спектры излучения хелатированный тербия в черном, а также представительного акцептора, Alexa 488, в ред. Обратите внимание на несколько пиков выбросов и резкий, узкий диапазон излучения для каждого пика тербия хелат. Эта схема позволяет тербия, которые будут использоваться с различными акцепторными флуорофоров и облегчает измерение сенсибилизированной излучения в этих диапазонах, где тербия не показывает выброс. Пик излучения тербия по адресу 486 нм перекрывает достаточно хорошо с а bsorption пик Alexa 488, что позволяет резонансной передачи энергии происходят между двумя флуорофорами. Длина волны 515 нм является отличным выбором для обнаружения сенсибилизированную эмиссию для этой пары, как это находится в долине между пиками выбросов тербия, и совсем рядом Alexa 488 в пиком излучения 520 нм. Обратите внимание, что, будучи вблизи пика акцептора, при том, что желательно, не требуется-565 нм по-прежнему способен обнаружить Alexa 488 эмиссию без также обнаруживать излучение тербия.
| Acceptor флуорофором | R 0 (Å) | Длина волны излучения (нм) |
| Атто 465 | 36 | 3px; "> 508|
| Флуоресцеин | 45 | 515 |
| Alexa 488 | 46 | 515 |
| Alexa 680 | 52 | 700 |
| Alexa 594 | 53 | 630 |
| Alexa 555 | 65 | 565 | Cy3 | 65 | 575 |
Таблица 1 Перечень обычно используемых акцепторных флуорофорами для LRET помощью тербия хелат качестве донора 11. В R 0 значения были измерены, когда донор и акцептор, были присоединены к растворимым агониста связывающий домен АМРА-рецепторов. Он идеально подходит для измерения значения R 0 раз для каждой новой системы изучается.
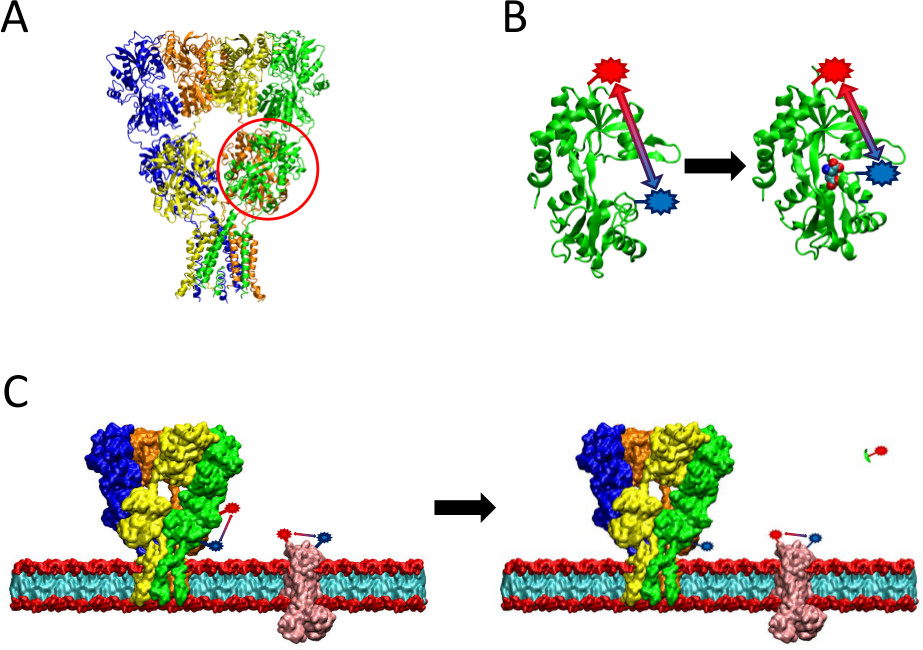
Рисунок 2 Обзор метода LRET представленной. (А) рецепторов АМРА является мембранный белок, который подвергается конформационные изменения при лигандсвязывающие. Раскладушка-образный лиганд-бинахождении домен кружил здесь красным цветом. (В) лиганд-связывающий домен АМРА, когда он не связан с белком существует в открытой конформации (слева). При связан с лигандом глутамат, белок закрывается вокруг его лигандом (справа). Размещая флуорофоров на доказательных сайтов в LBD, природа этого конформационных изменений можно рассматривать как расстояние между изменениями флуорофоров, которые затем будут влиять на время жизни флюоресценции. (С) при маркировке целые клетки, маркировка как интересующего белка, а также фоновых мембранных белков может произойти (слева). После расщепления протеазы, сигнал LRET от интересующего белка исчезнет в связи с выпуском растворимого фрагмента, оставив фоновый сигнал нетронутыми (справа). Это фоновый сигнал может быть вычтен из сырого сигнала.
Protocol
Representative Results
Discussion
LRET является мощным средством, что позволяет ученым измерять расстояния между доменами в пределах одного белка, а также между подразделениями в мультимерного белка. Таким образом, LRET хорошо подходит для изучения конформационных изменений и динамики белков или других макромолекул. Выш?…
Disclosures
The authors have nothing to disclose.
Acknowledgements
Работа выполнена при поддержке Национального института здравоохранения Грант GM094246, Американской ассоциации сердца Грант 11GRNT7890004, и Национальный Грант научный фонд MCB-1110501.
Materials
| Name of Reagent/ Equipment | Company | Catalog Number | Comments/Description |
| LanthaScreen Thiol Reactive Tb Chelate | Life Technologies | PV3579 | |
| Acceptor fluorophore-Fluorescein-5-Maleimide | Life Technologies | F-150 | Choice of acceptor depends on the specific experiment |
| Acceptor fluorophore-Alexa Fluor 488 C5 Maleimide | Life Technologies | A-10254 | Choice of acceptor depends on the specific experiment |
| Acceptor fluorophore-Alexa Fluor 555 C2 Maleimide | Life Technologies | A-20346 | Choice of acceptor depends on the specific experiment |
| Acceptor fluorophore-Alexa Fluor 594 C5 Maleimide | Life Technologies | A-10256 | Choice of acceptor depends on the specific experiment |
| Acceptor fluorophore-Alexa Fluor 680 C2 Maleimide | Life Technologies | A-20344 | Choice of acceptor depends on the specific experiment |
| QuantaMaster 3-SS | Photon Technology International | Spectrofluorometer should have pulsed excitation with the ability to measure lifetimes in the ms range | |
| FluoreScan 2.0 | Photon Technology International | Data Acquisition Software used in manuscript. Software provided with fluorescence instrument. | |
| Origin 8.6 | OriginLab | Origin is the data analysis software used in protocol. Can use other similar data analysis software | |
| Quartz Cuvette | Starna Cells, Inc | 3-Q-10 | |
| Stir Bar | Bel-Art Products | F37119-0007 | Used in cuvette to keep cells in suspension. Can use any stir bar that fits the cuvette |
References
- Selvin, P. R. Principles and biophysical applications of lanthanide-based probes. Annual Review of Biophysics and Biomolecular Structure. 31, 275-302 (2002).
- Stryer, L., Haugland, R. P. Energy transfer: a spectroscopic ruler. Proceedings of the National Academy of Sciences of the United States of America. 58, 719-726 (1967).
- Stryer, L. Fluorescence energy transfer as a spectroscopic ruler. Annual Review of Biochemistry. 47, 819-846 (1978).
- Selvin, P. R., Hearst, J. E. Luminescence energy transfer using a terbium chelate: improvements on fluorescence energy transfer. Proceedings of the National Academy of Sciences of the United States of America. 91, 10024-10028 (1994).
- Chen, J., Selvin, P. R. Thiol-reactive luminescent chelates of terbium and europium. Bioconjugate Chemistry. 10, 311-315 (1999).
- Ge, P., Selvin, P. R. Thiol-reactive luminescent lanthanide chelates: part 2. Bioconjugate Chemistry. 14, 870-876 (2003).
- Gonzalez, J., Rambhadran, A., Du, M., Jayaraman, V. LRET investigations of conformational changes in the ligand binding domain of a functional AMPA receptor. Biochemistry. 47, 10027-10032 (2008).
- Ramaswamy, S. S., Maclean, D. M., Gorfe, A. A., Jayaraman, V. Proton mediated conformational changes in an Acid Sensing Ion Channel. J. Bio. Chem. 288, (2013).
- Rambhadran, A., Gonzalez, J., Jayaraman, V. Conformational changes at the agonist binding domain of the N-methyl-D-aspartic acid receptor. The Journal of Biological Chemistry. 286, 16953-16957 (2011).
- Rambhadran, A., Gonzalez, J., Jayaraman, V. Subunit arrangement in N-methyl-D-aspartate (NMDA) receptors. The Journal of Biological Chemistry. 285, 15296-15301 (2010).
- Kokko, T., Kokko, L., Soukka, T. Terbium(III) chelate as an efficient donor for multiple-wavelength fluorescent acceptors. Journal of Fluorescence. 19, 159-164 (2009).

