Luminescence Resonance Energy Transfer pour étudier les changements conformationnels dans des protéines membranaires exprimés dans les cellules de mammifères
Summary
Nous décrivons ici une méthode améliorée Transfert Luminescence Resonance Energy (LRET) où nous introduisons un site de clivage de protéase entre les sites de fluorophores donneur et accepteur. Cette modification permet d'obtenir des signaux de LRET spécifiques découlant de protéines membranaires d'intérêt, ce qui permet l'étude de protéines de la membrane sans la purification des protéines.
Abstract
Transfert Luminescence Resonance Energy, ou LRET, est une technique puissante utilisée pour mesurer les distances entre deux sites dans les protéines dans la plage de distance de 10-100 Å. En mesurant les distances dans diverses conditions ligaturées, des changements conformationnels de la protéine peuvent être facilement évalués. Avec LRET, un lanthanide, le terbium plus souvent chélaté, est utilisé comme fluorophore donneur, offrant des avantages comme une durée de vie prolongée des donateurs seule émission, la possibilité d'utiliser plusieurs fluorophores accepteurs, et la possibilité de détecter sensibilisés émission accepteur comme un moyen facile pour mesurer le transfert d'énergie sans risque de détecter également le signal de donateurs seulement. Ici, nous décrivons une méthode pour utiliser LRET de protéines membranaires exprimés et testés sur la surface de cellules de mammifères intacts. Nous introduisons un site de clivage de protéase entre la paire de fluorophore LRET. Après l'obtention du signal d'origine LRET, le clivage en ce site élimine le signal de LRET spécifique de la protéine deintérêt qui nous permet de soustraire quantitativement le signal de fond qui reste après clivage. Cette méthode permet de plus physiologiquement mesures appropriées pour y être apportées sans la nécessité de purification de protéine.
Introduction
Transfert Luminescence Resonance Energy (LRET) est un dérivé de la technique 1 bien connu Fluorescence Resonance Energy Transfer (FRET). Similaires à FRET, LRET peut être utilisé pour mesurer les distances et les changements de distance entre les fluorophores donneur et accepteur attachés à des sites spécifiques sur la protéine d'intérêt dans la plage de 10 à 100 Å 3.1. Les principes de la LRET sont également similaires à FRET en ce que le transfert d'énergie de résonance se produit entre les deux fluorophores proximales quand le spectre d'émission du fluorophore donneur chevauche le spectre du fluorophore accepteur d'absorption. L'efficacité de ce transfert est liée à la distance entre les deux fluorophores par l'équation suivante:
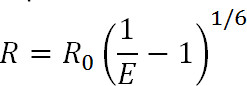 Eq. 1
Eq. 1
où R est la distance entre les deux fluorophores, E est l'efficacité de salleéner- transfert, et R 0, discuté ci-dessous, est le rayon de Förster pour la paire de fluorophore, c'est à dire la distance à laquelle l'efficacité de transfert est semi-maximale. A partir de cette équation, on peut voir que l'efficacité est liée à la grandeur de la distance élevée à la puissance six inverse 1. C'est cette sixième dépendance de la puissance inverse qui permet de FRET et les mesures de lRet être extrêmement sensible, même à de faibles variations de distance quand près de la R 0 de la paire FRET. La capacité d'étiqueter les sites désirés sur des protéines ou d'autres macromolécules permet de prendre avantage de cette sensibilité pour surveiller les changements de conformation.
Par rapport à FRET, qui utilise des molécules classiques de colorants organiques, LRET offre des avantages supplémentaires. Dans LRET, au lieu d'utiliser un colorant organique comme le fluorophore donneur, un cation de la série des lanthanides, typiquement Tb 3 + ou Eu 3 +, on utilise 1,4-6. Fluorophores u tombentelon cette catégorie, par exemple, un chelate de terbium, sont également très polyvalent en ce qu 'ils peuvent être utilisés avec une large gamme de fluorophores accepteurs. Cette flexibilité est rendue possible parce que les spectres d'émission des lanthanides chélatés contient de multiples pics d'émission tranchants, ce qui permet une seule espèce de fluorophore donneur pour être utilisé avec une grande variété de fluorophores accepteurs. Ainsi, l'émission de l'accepteur sensibilisés peut être détectée sans aucune crainte de contamination purge par du donneur émission 5. L'expérimentateur choisit l'accepteur spécifique sur la base de la distance attendue entre les deux fluorophores (Figure 1 et Tableau 1). Dans ces fluorophores lanthanides chélatés, l'ion métallique est chélaté par une molécule qui contient un groupe d'antennes qui sensibilise le lanthanide normalement peu absorbant à l'excitation ainsi qu'un groupe fonctionnel bioréactif pour attacher l'ion à un groupe fonctionnel spécifique de la macromolécule 1, 5,6. Once excité, lanthanides se détendre à l'état du sol par la libération de photons avec un taux de décroissance de l'ordre de la milliseconde. Parce que la décroissance n'est ni une relaxation singulet à singlet ni un triplet de détente à singulet, l'émission de photons peut pas correctement être appelé fluorescence ou phosphorescence, mais il est plus correct appelé luminescence 1. La longue décadence de lanthanides luminescence contribue grandement à des mesures de durée de vie. Les mesures de durée de vie peuvent ensuite être utilisées pour déterminer l'efficacité par la relation suivante:
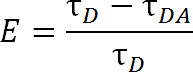 Eq. 2
Eq. 2
où E est l'efficacité du transfert, τ D est la durée de vie du donneur (lanthanide chélaté) lorsque ne participant pas au transfert d'énergie, et τ DA est la durée de vie du donneur en participant à un transfert d'énergie de l'accepteur. Avec LRET, τ DA peut aldonc être mesurée par la durée de vie de l'émission de l'accepteur sensibilisés parce que la durée de vie de terbium est d'autant plus grande qu'un fluorophore accepteur organique. L'accepteur émet avec la même durée de vie que son incitation excitation (donneur lanthanides), et une contribution à la vie de la propre vie de fluorescence intrinsèque de l'accepteur est relativement négligeable. En mesurant l'émission sensibilisés plutôt que l'émission des bailleurs de fonds, nous éliminons également la nécessité de garantir un étiquetage exactement un ratio de 1: 1 de donneur à accepteur. Les protéines peuvent être étiquetés au lieu simultanément avec les deux accepteur et fluorophores donneurs. Une population hétérogène marqué va entraîner, mais protéines marquées double donateurs n'émettra pas dans la longueur d'onde de l'accepteur et protéines marquées double-accepteur ne sera pas excité. En outre, la distance entre fluorophores devrait être la même, quelle que soit la cystéine place un fluorophore donné attache à, en particulier lors de l'utilisation des lanthanides isotropes comme un donneur, de sorte que le need pour spécifier un site donné pour recevoir soit le donneur ou accepteur est inutile. Intensité peut être affectée avec une population hétérogène, mais doit encore être plus que suffisant pour être détecté.
Lors de la planification d'expériences, le choix des fluorophores doit être dicté par la valeur de R 0 de la paire ainsi que la plage de distance étant mesurée attendue. La valeur de R 0 est défini par l'équation suivante:
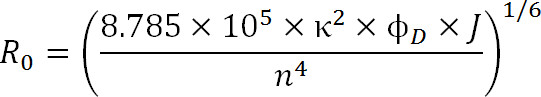 Eq. 3
Eq. 3
où, R 0 est le rayon de Förster en angströms, κ 2 est le facteur d'orientation entre les deux colorants (généralement supposés être 2/3), φ D est le rendement quantique du donneur, J est le chevauchement spectral intégrale entre le donateur spectre d'émission et le spectre d'absorption de l'accepteur à M – 1cm -1 nm 4, et n est l'indice de réfraction du milieu 1.
Notre laboratoire a ajouté une modification de la technique de la LRET classique par introduction d'un site de reconnaissance de protéase entre les sites donneurs et accepteurs d'étiquettes sur la protéine est sondé. Cette modification permet d'investigation dans les systèmes non purifiés tels que les cellules de mammifères entiers 7. Cette technique est particulièrement utile lors de l'utilisation en tant que sites cystéines pour l'étiquetage, étant donné que dans le procédé de marquage avec des colorants de maléimide conjugués qui se lient à des groupes sulfhydryle de cystéine, d'autres protéines sur les cellules qui possèdent des résidus cysteine sont aussi marquées. Toutefois, en incluant des sites de clivage de la protéase de la protéine d'intérêt et la mesure des durées de vie avant et après clivage, l'expérimentateur peut quantitativement soustraire le signal d'arrière-plan après le clivage de la protéase à partir du signal brut. Cette soustraction isole le signal spécifique découlant de la protéine d'intérêt (figureure 2). Utilisation de la modification décrite ci-dessus, LRET peut être utilisé pour mesurer les changements de distance entre le donneur de chélate de terbium, et la sonde à un accepteur de la protéine, et ainsi de surveiller les changements de conformation de l'état physiologique à proximité de la protéine sans la nécessité d'une purification.
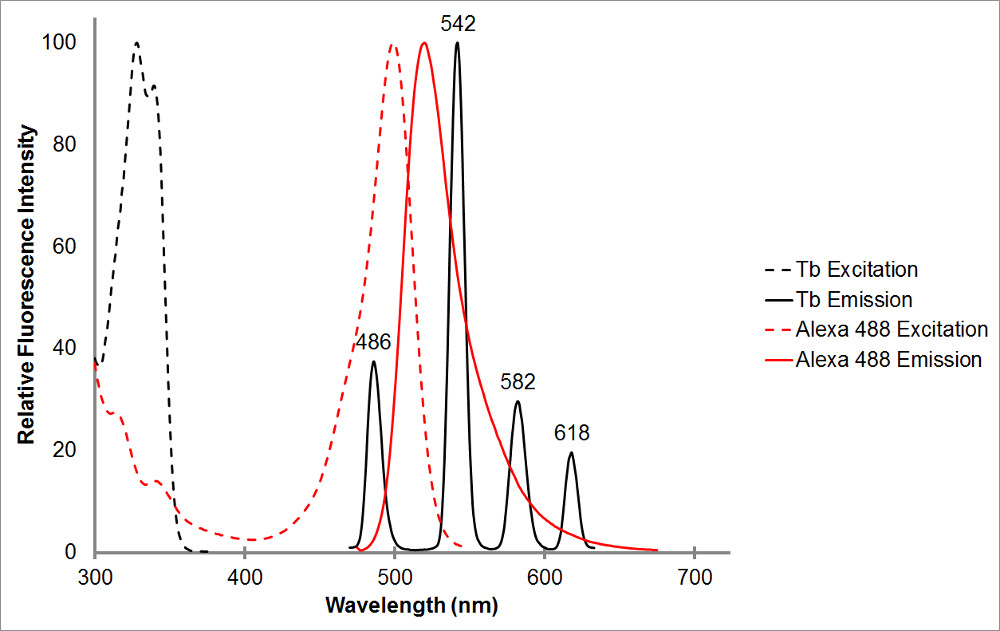
Figure 1.Le spectres d'absorption et d'émission de terbium chélaté en noir, ainsi que d'un accepteur représentant, Alexa 488, en rouge. Notez les multiples pics d'émission et la forte, la gamme d'émission étroit pour chaque pic de terbium chélate. Ce schéma permet de terbium à être utilisé avec une variété de fluorophores accepteurs et facilite la mesure de l'émission sensibilisée à l'intérieur de ces gammes, où le terbium montre pas d'émission. Le pic d'émission de terbium à 486 nm recouvre assez bien avec l'un bsorption pic de l'Alexa 488, ce qui permet un transfert d'énergie de résonance de se produire entre les deux fluorophores. Une longueur d'onde de 515 nm est un excellent choix pour détecter l'émission sensibilisée pour cette paire comme il est dans la vallée entre les pics d'émission de terbium, et tout près de Alexa 488 émissions pic de 520 nm. Notez que pour près de la pointe de l'accepteur, bien que souhaitable, n'est pas nécessaire-565 nm est encore capable de détecter Alexa 488 émissions sans détecter aussi terbium émission.
| Fluorophore accepteur | R 0 (Å) | longueur d'onde d'émission (nm) |
| Atto 465 | 36 | 3px; "> 508|
| Fluorescéine | 45 | 515 |
| Alexa 488 | 46 | 515 |
| Alexa 680 | 52 | 700 |
| Alexa 594 | 53 | 630 |
| Alexa 555 | 65 | 565 | Cy3 | 65 | 575 |
Tableau 1 La liste des fluorophores accepteurs couramment utilisés pour LRET utilisant terbium chélate comme donneur 11. Les valeurs de R 0 sont mesurées lorsque le donneur et accepteur sont liés au domaine de liaison de l'agoniste des récepteurs AMPA soluble. Il est idéal pour mesurer la valeur R 0 nouveau pour chaque nouveau système étudié.
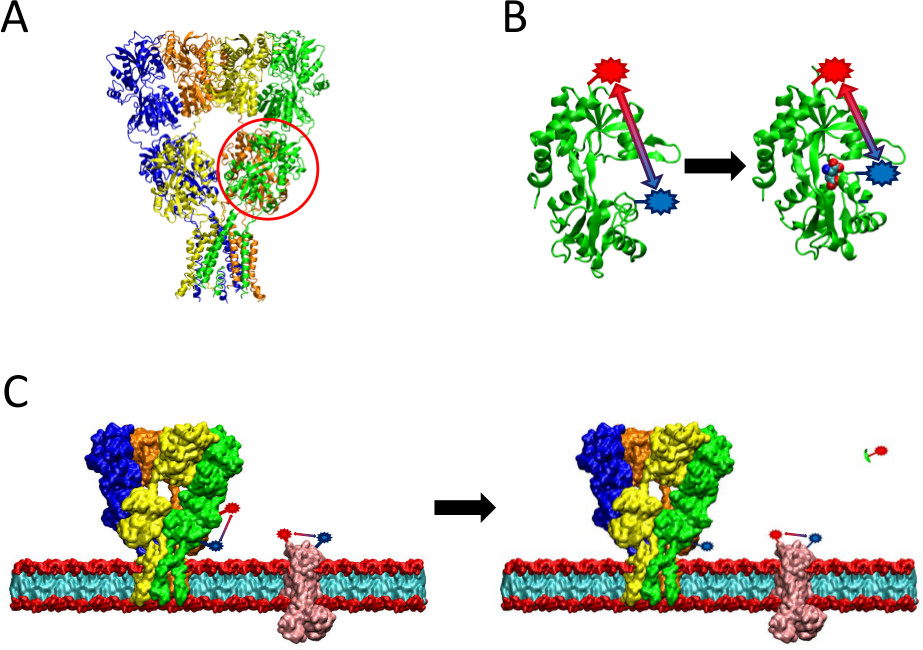
Figure 2: Une vue d'ensemble de la méthode de propagation à longue distance présenté. (A) Le récepteur AMPA est une protéine de membrane qui subit des changements conformationnels sur liaison de ligand. Le ligand bi-coque en forme dedomaine nding est entouré ici en rouge. (B) Le domaine de liaison au ligand de l'AMPA lorsqu'il n'est pas lié à la protéine existe dans une conformation ouverte (à gauche). Lorsqu'il est lié à un ligand glutamate, la protéine se ferme autour de son ligand (à droite). En plaçant des fluorophores dans les sites probants sur le LBD, la nature de ce changement de conformation peut être considérée comme la distance entre les fluorophores modifications, qui seront ensuite affecter la durée de vie de fluorescence. (C) Lorsque des cellules entières d'étiquetage, de marquage à la fois la protéine d'intérêt ainsi que les protéines de la membrane de fond peut se produire (à gauche). Après clivage de la protéase, le signal LRET de la protéine d'intérêt va disparaître en raison de la libération d'un fragment soluble, laissant intact le signal de fond (à droite). Ce signal d'arrière-plan peut alors être soustraite du signal brut.
Protocol
Representative Results
Discussion
LRET est une technique puissante qui permet aux scientifiques de mesurer des distances entre des domaines au sein d'une seule protéine, ainsi qu'entre les sous-unités d'une protéine multimérique. En tant que tel, LRET est bien adapté à l'examen des changements de conformation et la dynamique des protéines ou d'autres macromolécules. Le protocole ci-dessus devrait permettre au laboratoire bien équipé pour tester facilement leurs hypothèses; Cependant, il existe de nombreuses sources d'e…
Disclosures
The authors have nothing to disclose.
Acknowledgements
Ce travail a été financé par les Instituts nationaux de la santé Grant GM094246, l'American Heart Association Grant 11GRNT7890004, et la National Science Foundation Grant MCB-1110501.
Materials
| Name of Reagent/ Equipment | Company | Catalog Number | Comments/Description |
| LanthaScreen Thiol Reactive Tb Chelate | Life Technologies | PV3579 | |
| Acceptor fluorophore-Fluorescein-5-Maleimide | Life Technologies | F-150 | Choice of acceptor depends on the specific experiment |
| Acceptor fluorophore-Alexa Fluor 488 C5 Maleimide | Life Technologies | A-10254 | Choice of acceptor depends on the specific experiment |
| Acceptor fluorophore-Alexa Fluor 555 C2 Maleimide | Life Technologies | A-20346 | Choice of acceptor depends on the specific experiment |
| Acceptor fluorophore-Alexa Fluor 594 C5 Maleimide | Life Technologies | A-10256 | Choice of acceptor depends on the specific experiment |
| Acceptor fluorophore-Alexa Fluor 680 C2 Maleimide | Life Technologies | A-20344 | Choice of acceptor depends on the specific experiment |
| QuantaMaster 3-SS | Photon Technology International | Spectrofluorometer should have pulsed excitation with the ability to measure lifetimes in the ms range | |
| FluoreScan 2.0 | Photon Technology International | Data Acquisition Software used in manuscript. Software provided with fluorescence instrument. | |
| Origin 8.6 | OriginLab | Origin is the data analysis software used in protocol. Can use other similar data analysis software | |
| Quartz Cuvette | Starna Cells, Inc | 3-Q-10 | |
| Stir Bar | Bel-Art Products | F37119-0007 | Used in cuvette to keep cells in suspension. Can use any stir bar that fits the cuvette |
References
- Selvin, P. R. Principles and biophysical applications of lanthanide-based probes. Annual Review of Biophysics and Biomolecular Structure. 31, 275-302 (2002).
- Stryer, L., Haugland, R. P. Energy transfer: a spectroscopic ruler. Proceedings of the National Academy of Sciences of the United States of America. 58, 719-726 (1967).
- Stryer, L. Fluorescence energy transfer as a spectroscopic ruler. Annual Review of Biochemistry. 47, 819-846 (1978).
- Selvin, P. R., Hearst, J. E. Luminescence energy transfer using a terbium chelate: improvements on fluorescence energy transfer. Proceedings of the National Academy of Sciences of the United States of America. 91, 10024-10028 (1994).
- Chen, J., Selvin, P. R. Thiol-reactive luminescent chelates of terbium and europium. Bioconjugate Chemistry. 10, 311-315 (1999).
- Ge, P., Selvin, P. R. Thiol-reactive luminescent lanthanide chelates: part 2. Bioconjugate Chemistry. 14, 870-876 (2003).
- Gonzalez, J., Rambhadran, A., Du, M., Jayaraman, V. LRET investigations of conformational changes in the ligand binding domain of a functional AMPA receptor. Biochemistry. 47, 10027-10032 (2008).
- Ramaswamy, S. S., Maclean, D. M., Gorfe, A. A., Jayaraman, V. Proton mediated conformational changes in an Acid Sensing Ion Channel. J. Bio. Chem. 288, (2013).
- Rambhadran, A., Gonzalez, J., Jayaraman, V. Conformational changes at the agonist binding domain of the N-methyl-D-aspartic acid receptor. The Journal of Biological Chemistry. 286, 16953-16957 (2011).
- Rambhadran, A., Gonzalez, J., Jayaraman, V. Subunit arrangement in N-methyl-D-aspartate (NMDA) receptors. The Journal of Biological Chemistry. 285, 15296-15301 (2010).
- Kokko, T., Kokko, L., Soukka, T. Terbium(III) chelate as an efficient donor for multiple-wavelength fluorescent acceptors. Journal of Fluorescence. 19, 159-164 (2009).

