Luminescence resonansenergioverførsel at studere konformationsændringer i Membranproteiner udtrykkes i pattedyrceller
Summary
Vi beskriver her en forbedret Luminescence Resonance Energy Transfer (LRET) metode, hvor vi indfører en proteasespaltningssted mellem donor og acceptorfluoroforen websteder. Denne ændring giver os mulighed for at opnå konkrete LRET signaler, der stammer fra membranproteiner af interesse, der giver mulighed for studiet af membranproteiner uden proteinoprensning.
Abstract
Luminescence resonansenergioverførsel eller LRET, er en kraftfuld teknik, der anvendes til at måle afstande mellem to steder i proteiner inden for afstande fra 10-100 Å. Ved at måle afstandene under forskellige ligerede betingelser kan konformationelle ændringer i proteinet let vurderes. Med LRET, et lanthanid, oftest chelateret terbium, anvendes som donorfluoroforen, der giver fordele, såsom en længere donor kun emission levetid, fleksibilitet til at bruge flere acceptor fluoroforer, og mulighed for at opdage sensibiliseret acceptor emission som en nem måde at måle energioverførsel uden risiko for også at detektere donor kun signal. Her beskriver vi en metode til at bruge LRET om membranproteiner, der er udtrykt og analyseret på overfladen af intakte mammale celler. Vi introducerer en proteasespaltningssted mellem LRET fluoroforen par. Efter opnåelse af den oprindelige LRET signal spaltning på dette sted fjerner specifik LRET signal fra proteinet afinteresse tillader os at kvantitativt trække baggrunden signal, der er tilbage efter spaltning. Denne fremgangsmåde giver mulighed for mere fysiologisk relevante målinger skal foretages uden behov for oprensning af protein.
Introduction
Luminescence Resonance Energy Transfer (LRET) er et derivat af det velkendte fluorescensresonansenergioverførsel (FRET) teknik 1. Svarende til FRET kan LRET anvendes til at måle afstande og ændringer afstand mellem donor og acceptor fluoroforer bundet til specifikke steder på proteinet af interesse inden for området 10-100 Å 1-3. Principperne for LRET ligner også FRET i at resonansenergioverførsel forekommer mellem to proksimale fluorophorer når emissionsspektret for donorfluoroforen overlapper med absorptionsspektret af acceptor-fluorofor. Effektiviteten af denne overførsel er relateret til afstanden mellem de to fluoroforer ved følgende ligning:
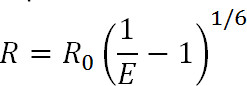 Lign. 1
Lign. 1
hvor R er afstanden mellem de to fluoroforer, E er effektiviteten af enEnergiministeriet overførsel, og R 0, diskuteres nedenfor, er Forster radius fluoroforen par, dvs den afstand, hvor effektiviteten af overførslen er halvmaksimal. Fra denne ligning kan man se, at effektiviteten er relateret til størrelsen af afstanden hævet til den inverse sjette strøm 1. Det er denne inverse sjette magt afhængighed, der giver mulighed for FRET og LRET målinger for at være udsøgt følsom for selv små ændringer i afstand, når nær R 0 i FRET-par. Evnen til specifikt mærke ønskede steder på proteiner eller andre makromolekyler gør det muligt at drage fordel af denne følsomhed til at overvåge konformationelle ændringer.
Sammenlignet at ærgre sig, som anvender konventionelle organiske farvestof molekyler, LRET byder på flere fordele. I LRET, i stedet for anvendelse af et organisk farvestof, som donorfluoroforen en lanthanidrækken kation, typisk Tb 3+ eller Eu3 +, anvendes 1,4-6. Fluoroforer, der falder under denne kategori, f.eks terbium-chelat, er også meget alsidige, idet de kan anvendes sammen med en lang række acceptor-fluoroforer. Denne fleksibilitet er muligt fordi emissionsspektret chelaterede lanthanider indeholde flere skarpe emissionstoppe, giver mulighed for en enkelt art af donorfluoroforen, der skal anvendes med en af en lang række acceptor-fluoroforer. Således kan lysfølsomme acceptor emission detekteres uden frygt for kontaminerende gennemblødning fra donor emission 5. Forsøgslederen vælger specifikke acceptor baseret på den forventede afstand mellem de to fluorophorer (Figur 1 og tabel 1). I disse chelaterede lanthanid fluoroforer er metalion chelateret med et molekyle, som indeholder en antenne gruppe, sensitizes normalt dårligt absorberende lanthanid til excitation samt en bioreaktive funktionel gruppe at binde ionen til en specifik funktionel gruppe på makromolekylet 1, 5,6. ONCe ophidset, lanthanider slappe af til grundtilstanden via frigivelse af fotoner med en henfaldshastighed i millisekunder. Fordi henfaldet er hverken et singlet-til-singlet afslapning eller en triplet-til-singlet afslapning, emission af fotoner kan ikke med rette kaldes fluorescens eller morild, men er mere korrekt betegnes luminescens 1. Den lange henfald af lanthanid luminescens høj grad hjælper i levetid målinger. Lifetime målinger kan derefter anvendes til at bestemme effektiviteten via følgende forhold:
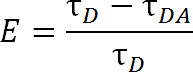 Lign. 2
Lign. 2
hvor E er effektiviteten af overførsel, τ D er levetiden af donor (chelateret lanthanide), når der ikke deltager i energioverførsel, og τ DA er levetiden af donoren, når de deltager i energioverførsel med acceptoren. Med LRET, τ OB kan alså måles som levetid sensibiliserede acceptor emissionen fordi terbium levetid er så meget større end en organisk acceptorfluoroforen. Acceptoren udsender med samme levetid som sin opfordring excitation (donor lanthanid), og ethvert bidrag til levetid fra acceptoren egen iboende fluorescens levetid er forholdsvis ubetydelig. Ved at måle den lysfølsomme emissionen end donor emission vi også eliminere behovet for at sikre mærkning på nøjagtigt en 1: 1-forhold mellem donor-acceptor. Protein kan i stedet mærkes samtidig med både acceptor og donor fluoroforer. Et heterogent mærket befolkning vil medføre, men dobbelt-donor-mærkede proteiner vil ikke udsende i acceptor bølgelængde og dobbelt-acceptor mærkede proteiner vil ikke være begejstret. Endvidere bør afstanden mellem fluoroforer være den samme, uanset hvilket cystein stedet en given fluorofor tillægger, især ved anvendelse af de isotrope lanthanider som en donor, så need for at angive et givet sted at modtage enten donoren eller acceptoren er unødvendig. Intensitet kan blive påvirket med en heterogen population, men bør stadig være mere end nok til at blive opdaget.
Når du planlægger eksperimenter, bør valget af fluoroforer være dikteret af R 0 værdien af parret såvel som den forventede afstand interval der måles. R 0-værdien er defineret ved følgende ligning:
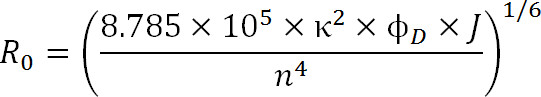 Lign. 3
Lign. 3
hvor R 0 er Förster radius i Ångstrøm, κ 2 er den orientering faktor mellem de to farvestoffer (normalt antages at være 2/3), φ D er kvantumsudbyttet donorens, J er den spektrale overlapning integreret mellem donorens emissionsspektrum og acceptorens absorbansspektrum i M – 1cm -1 nm 4, og n er brydningsindekset for mediet 1.
Vores laboratorium har tilføjet en modifikation til den konventionelle LRET teknik ved at indføre et proteasegenkendelsessted mellem donor og acceptor label sites på proteinet, som testes. Denne modifikation giver mulighed for undersøgelse i ikke-oprenset systemer såsom hele pattedyrceller 7. Denne teknik er især nyttig, når cysteiner som lokaliteter til mærkning, idet processen mærkning med maleimid-konjugeret farvestoffer, som binder til cystein sulfhydrylgrupper, andre proteiner på de celler, der har cysteiner er også mærket. Men ved herunder protease-spaltningssteder på proteinet af interesse og måling levetider før og efter spaltning forsøgslederen kan kvantitativt subtrahere baggrunden signal efter proteasespaltning fra råsignalet. Denne subtraktion isolerer specifikt signal hidrørende fra proteinet af interesse (figure 2). Brug modifikation beskrevet ovenfor kan LRET anvendes til at måle ændringer i afstanden mellem terbium-chelat donoren og acceptor-proben på et protein, og således overvåge konformationelle ændringer i proteinet nær fysiologiske tilstand uden kravet om oprensning.
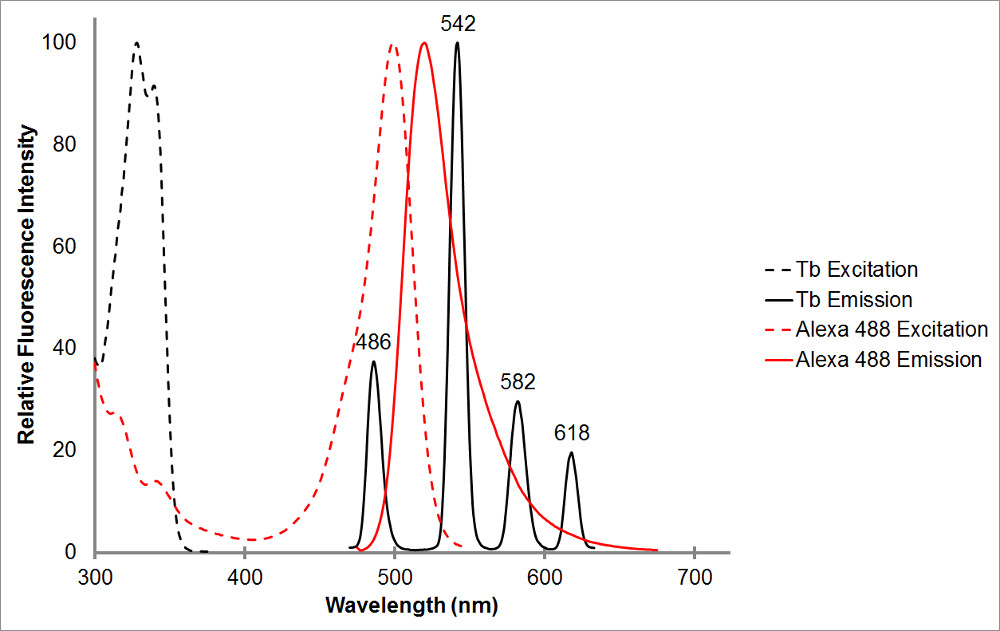
Figur 1.Den absorption og emission spektre af chelateret terbium i sort, samt en repræsentant acceptor, Alexa 488, i rødt. Bemærk de mange emissioner toppe og den skarpe, smalle emission interval for hver top af terbium chelat. Dette mønster tillader terbium, der skal anvendes med en række acceptor fluoroforer og letter målingen af sensibiliserede emission inden for disse intervaller, hvor terbium viser ingen emission. Terbium udledning top ved 486 nm overlapper ganske godt med en bsorption højdepunkt for Alexa 488, giver mulighed for resonansenergioverførsel forekommer mellem de to fluorophorer. En bølgelængde på 515 nm er et glimrende valg til at opdage sensibiliseret emissionen for dette par, da det er i dalen mellem emissionstoppe terbium, og ganske nær Alexa 488 emission højdepunkt på 520 nm. Bemærk, at det at være i nærheden af acceptor højdepunkt, selvom ønskelig, ikke er nødvendig-565 nm er stadig i stand til at detektere Alexa 488 emission, uden også at afsløre terbium emission.
| Acceptorfluoroforen | R 0 (a) | Emission bølgelængde (nm) |
| Atto 465 | 36 | 3px; "> 508|
| Fluorescein | 45 | 515 |
| Alexa 488 | 46 | 515 |
| Alexa 680 | 52 | 700 |
| Alexa 594 | 53 | 630 |
| Alexa 555 | 65 | 565 | Cy3 | 65 | 575 |
Tabel 1. En liste over almindeligt anvendte acceptor fluoroforer for LRET hjælp terbium chelat som donoren 11. R-0-værdier blev målt, når donoren og acceptoren var knyttet til den opløselige agonist bindingsdomæne af AMPA-receptorer. Det er ideelt at måle R 0 værdien igen for hvert nyt system, der undersøges.
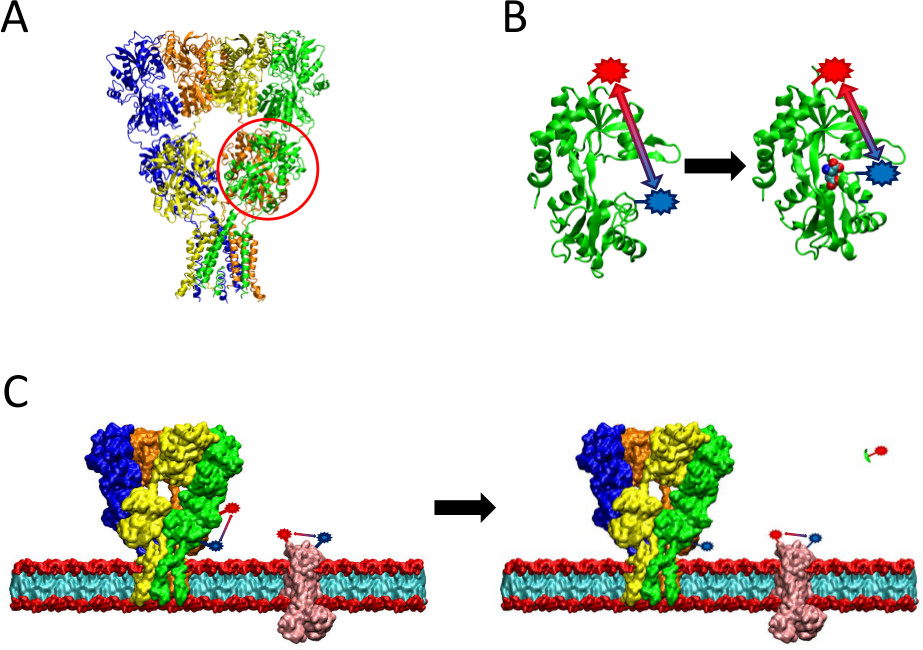
Figur 2. En oversigt over LRET metode præsenteres. (A) AMPA-receptoren er et membranprotein, som undergår konformationelle ændringer efter ligandbindende. Den clamshell-formede ligand-binde domæne er omgivet her i rødt. (B) Det ligandbindende domæne af AMPA, når den ikke er bundet til protein eksisterer i en åben konformation (venstre). Når de er bundet til ligand glutamat proteinet lukker omkring dets ligand (til højre). Ved at placere fluoroforer på overbevisende sites på LBD, kan arten af denne konformationsændring ses som afstanden mellem fluoroforer ændringer, som derefter vil påvirke fluorescenslevetid. (C) Ved mærkning af hele celler, kan forekomme mærkning af både proteinet af interesse samt membranproteiner baggrund (venstre). Efter proteasespaltning vil LRET signal fra proteinet af interesse forsvinde på grund af frigivelsen af et opløseligt fragment forlader baggrundssignal intakt (højre). Denne baggrund signal kan så trækkes fra det rå signal.
Protocol
Representative Results
Discussion
LRET er en kraftfuld teknik, der gør det muligt for forskere at måle afstande mellem domæner i et enkelt protein samt mellem underenheder i et multimert protein. Som sådan er LRET velegnet til at undersøge de konformationelle ændringer og dynamikken i proteiner eller andre makromolekyler. Ovennævnte protokol bør tillade ordentligt udstyret laboratorium til nemt at afprøve deres hypoteser; Men der er mange fælles fejlkilder, der kan plage den nye investigator. Hvis der kun lidt eller ingen LRET signal ses førs…
Disclosures
The authors have nothing to disclose.
Acknowledgements
Dette arbejde blev støttet af National Institutes of Health Grant GM094246, American Heart Association Grant 11GRNT7890004, og National Science Foundation Grant MCB-1110501.
Materials
| Name of Reagent/ Equipment | Company | Catalog Number | Comments/Description |
| LanthaScreen Thiol Reactive Tb Chelate | Life Technologies | PV3579 | |
| Acceptor fluorophore-Fluorescein-5-Maleimide | Life Technologies | F-150 | Choice of acceptor depends on the specific experiment |
| Acceptor fluorophore-Alexa Fluor 488 C5 Maleimide | Life Technologies | A-10254 | Choice of acceptor depends on the specific experiment |
| Acceptor fluorophore-Alexa Fluor 555 C2 Maleimide | Life Technologies | A-20346 | Choice of acceptor depends on the specific experiment |
| Acceptor fluorophore-Alexa Fluor 594 C5 Maleimide | Life Technologies | A-10256 | Choice of acceptor depends on the specific experiment |
| Acceptor fluorophore-Alexa Fluor 680 C2 Maleimide | Life Technologies | A-20344 | Choice of acceptor depends on the specific experiment |
| QuantaMaster 3-SS | Photon Technology International | Spectrofluorometer should have pulsed excitation with the ability to measure lifetimes in the ms range | |
| FluoreScan 2.0 | Photon Technology International | Data Acquisition Software used in manuscript. Software provided with fluorescence instrument. | |
| Origin 8.6 | OriginLab | Origin is the data analysis software used in protocol. Can use other similar data analysis software | |
| Quartz Cuvette | Starna Cells, Inc | 3-Q-10 | |
| Stir Bar | Bel-Art Products | F37119-0007 | Used in cuvette to keep cells in suspension. Can use any stir bar that fits the cuvette |
References
- Selvin, P. R. Principles and biophysical applications of lanthanide-based probes. Annual Review of Biophysics and Biomolecular Structure. 31, 275-302 (2002).
- Stryer, L., Haugland, R. P. Energy transfer: a spectroscopic ruler. Proceedings of the National Academy of Sciences of the United States of America. 58, 719-726 (1967).
- Stryer, L. Fluorescence energy transfer as a spectroscopic ruler. Annual Review of Biochemistry. 47, 819-846 (1978).
- Selvin, P. R., Hearst, J. E. Luminescence energy transfer using a terbium chelate: improvements on fluorescence energy transfer. Proceedings of the National Academy of Sciences of the United States of America. 91, 10024-10028 (1994).
- Chen, J., Selvin, P. R. Thiol-reactive luminescent chelates of terbium and europium. Bioconjugate Chemistry. 10, 311-315 (1999).
- Ge, P., Selvin, P. R. Thiol-reactive luminescent lanthanide chelates: part 2. Bioconjugate Chemistry. 14, 870-876 (2003).
- Gonzalez, J., Rambhadran, A., Du, M., Jayaraman, V. LRET investigations of conformational changes in the ligand binding domain of a functional AMPA receptor. Biochemistry. 47, 10027-10032 (2008).
- Ramaswamy, S. S., Maclean, D. M., Gorfe, A. A., Jayaraman, V. Proton mediated conformational changes in an Acid Sensing Ion Channel. J. Bio. Chem. 288, (2013).
- Rambhadran, A., Gonzalez, J., Jayaraman, V. Conformational changes at the agonist binding domain of the N-methyl-D-aspartic acid receptor. The Journal of Biological Chemistry. 286, 16953-16957 (2011).
- Rambhadran, A., Gonzalez, J., Jayaraman, V. Subunit arrangement in N-methyl-D-aspartate (NMDA) receptors. The Journal of Biological Chemistry. 285, 15296-15301 (2010).
- Kokko, T., Kokko, L., Soukka, T. Terbium(III) chelate as an efficient donor for multiple-wavelength fluorescent acceptors. Journal of Fluorescence. 19, 159-164 (2009).

