משטח משופר ראמאן ספקטרוסקופיה איתור של מולקולות ביולוגיות באמצעות EBL מצעי Nanostructured המפוברק
Summary
We describe the fabrication and characterization of nano-biological systems interfacing nanostructured substrates with immobilized proteins and aptamers. The relevant experimental steps involving lithographic fabrication of nanostructured substrates, bio-functionalization, and surface-enhanced Raman spectroscopy (SERS) characterization, are reported. SERS detection of surface-immobilized proteins, and probing of protein-ligand and aptamer-ligand binding is demonstrated.
Abstract
ייצור ואפיון של מערכות ננו-ביולוגי המצומד ממשק ננו המתכתי על תומך מוצק עם מולקולות ביולוגיות משותקות מדווח. הרצף השלם של צעדים ניסיוניים רלוונטיים מתואר, הכולל ייצור של מצעי nanostructured באמצעות יתוגרפיה אלומת אלקטרונים, חוסר תנועה של מולקולות ביולוגיות על מצעים, ואפיונם ניצול-ראמאן ספקטרוסקופיה משופר קרקע (SERS). שלושה עיצובים שונים של מערכות ננו-ביולוגי מועסקים, כוללים חלבון, חלבון קושר גלוקוז, וaptamer DNA דופמין מחייב. בשני המקרים האחרונים, הכריכה של ligands בהתאמה, D-גלוקוז ודופאמין, כלול גם. שלושה סוגים של מולקולות ביולוגיות הם משותקים על מצעי nanostructured בשיטות שונות, ואת התוצאות של ההדמיה SERS מדווחות. היכולות של SERS כדי לזהות מצבי רטט מחלבונים-משותק פני השטח, כמו גם כדי ללכוד את החלבון ליגנדaptamer ליגנד ד כריכה הם הפגינו. התוצאות גם להמחיש את ההשפעה של הגיאומטריה ננו-מבנה פני השטח, אסטרטגית קיבוע מולקולות ביולוגית, פעילות ראמאן של המולקולות ונוכחות או עדר של יגנד מחייב את ספקטרום SERS רכש.
Introduction
יכולות לפתח ולאפיין מערכות ננו-ביולוגי המצומד ממשק ננו מוצק ופולימרים ביולוגיים הופכות להיות חשובות יותר ויותר להתקדמות נוספת בטכנולוגיות של הדור הבא ביו-חישה וביו-actuation 1,2. זה כרוך לימודים רב-תחומיים על פני מספר תחומי מחקר, כגון הייצור של רכיבים רלוונטיים של מצב מוצק (אלקטרודות מיקרו או ננו, ציפוי ננו-הנדסה, ננו-חוטים, או חלקיקים) 2,3,4; חוסר תנועה של מולקולות ביולוגיות על המשטחים ליצור bioconjugates הרצוי 5,6,7; וניטור ממשקי ננו-ביולוגי 1. ברוב המקרים, את הבחירה של ייצור אופטימלי, ביו-functionalization, ושיטות אפיון היא בין-קשורה מאוד. ברור, הבחירה של טכניקות nanofabrication תהיה מונעת על ידי הדרישות של רכיבי מצב המוצק של המערכת, להיות תלוי במידה רבה בשיטת זיהוי, אשר בturn נקבע על ידי הטבע של biopolymers המעורב והמטרה של ניטור הממשק.
מתוך מגוון רחב של טכניקות מיושמות לאפיין מערכות bioconjugate 1,3, ספקטרוסקופיה המשטח המשופר ראמאן (SERS) התגלה כשיטת מבטיחה ביותר לגילוי של מינים כימיים וביולוגיים על משטחים 8,9,10,11. SERS מעסיק פיזור קשיח של אור מונוכרומטי על ידי מולקולות ביולוגיות-משותק פני השטח (איור 1) ומאפשרות את לכידתו של חתימות ייחודיות המתאימות לתנודות מולקולריות. יכולת זו כדי להבדיל בין מולקולות שונות מבלי לערב תוויות, כימיה מורכבת, או צעדים גוזלים זמן, עושה SERS שיטת פוטנציאל מאוד יעילה של ביו-זיהוי. יתרון חשוב נוסף של SERS הוא הרגישות הגבוהה שלו. העירור של plasmons משטח המקומי על ידי אור אינטראקציה עם ננו האצילי מתכת (מצעי SERS) מגדיל באופן דרמטי intensity של פיזור ראמאן ידי אנליטי, המאפשר זיהוי של כמויות קטנות מאוד של מולקולות, מmonolayers אל גבולו המולקולה בודדת 8,9,10,11. לבסוף, רוב המולקולות ביולוגיות דורשות תמיסות מימיות להיות יציב. בגלל מים לעתים קרובות יש פעילות ראמאן מוגבלת, אות רקע מדגימות מימיות ממוזערת 9. יישומים של SERS הציגו גידול מעריכי בעשור האחרון 10. עם זאת, אתגר הרבה דן בSERS הוא שהשיפור האלקטרומגנטי של פיזור ראמאן תלוי באופן קריטי על הגודל, צורה, והמרווח של ננו המתכת שבו גלי plasmonic מושרים 11,12,13. על מנת להשיג מדידות SERS יעיל לשחזור, שליטה על נדרשת הגיאומטריה המצע בממדים ננומטריים.
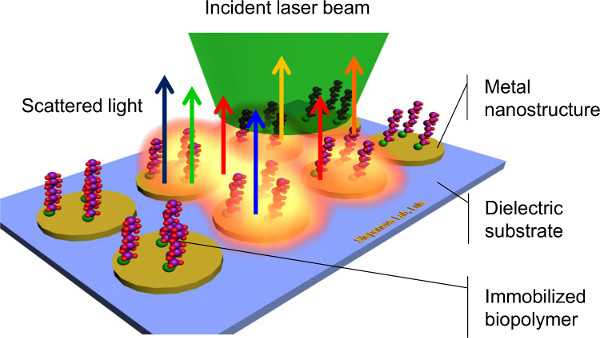
איור 1. Scheme של ספקטרוסקופיית ראמאן משופר פני השטח.
שיטות רבות המועסקות לפברק מצעי SERS 11,12,13 ניתן לסווג באופן גס לשיטות מלמטה למעלה ומלמעלה למטה. שיטות מהסוג הראשון להעסיק תהליכים שונים של הרכבה עצמית או סינתזה כימית מכוונת כדי לייצר ננו. לעתים קרובות התייחס דוגמאות כוללות קיבוע של חלקיקי monodisperse על תומך מוצק 11,12,13, תרמית, גמגום, או בתצהיר אלקטרוכימיים של סרטי מתכת מחוספסים 11,12, ושיטות סינתזה כימיות שונות 13. למרות טכניקות כגון נוטות להיות יחסית פשוט וזול, רובם מאותגרים על ידי חוסר שליטה על המיקום של המבנים, ושחזור מדגם למדגם מצומצם.
בניגוד לכך, טכניקות ליתוגרפיה מלמעלה למטה להעסיק מכשירי manipulable כגון קורות חלקיקים כדי ליצור דפוסים הרצויים על משטחים. אחד משמש לרובשיטות nanolithography, ליתוגרפיה אלומת אלקטרונים (EBL), מציעה שליטה נהדרת מעל כוללת עד מתחת ל -10 nm וגם גמישות כדי לאפשר לעיצובי מצע שונים על תומך מוצק 11,12. בEBL, אלומת אלקטרונים ממוקדת עד כדי נקודה של ננומטרים ספורים בסריקות קוטר פני שטח של חומר אלקטרונים רגיש (להתנגד) גורם לשינוי כימי באזורים חשופים. לטון חיובי מתנגד כגון polymethylmethacrylate (PMMA), תוצאות חשיפת קרן אלקטרונים בפרדה של שרשרות פולימר ההלחנה להתנגד, שמוביל למסיסות גדלה בממס מתאים (מפתח). התהליך ליתוגרפיה אלומת האלקטרונים כולל ספין ציפוי של שכבה אחידה של להתנגד על מצע; חשיפה של החומר להתנגד הממוקד בתא ואקום עם אלומת אלקטרונים; ופיתוח של המדגם כדי להסיר את האזורים המסיסים.
יש לי תומך דיאלקטרי מתחת ננו המתכתי, כגון סיליקה התמזגה, been מוצג להגדיל באופן משמעותי את העוצמות בSERS בשל לוקליזציה של גלי plasmonic בהשוואה לחומרים אחרים כגון סיליקון 14,15. עם זאת דפוסי EBL על מצעים דיאלקטרי, במיוחד בקנה המידה ננומטרי, כרוכים אתגרים משמעותיים בשל לחייב הצטברות במהלך חשיפה. בעבר, שהראינו 16,17 שניתן להתגבר על קשיים אלה על ידי הצבת שכבות פולימר מוליך מעל להתנגד. איור 2 מראה סכמטי של תהליך הייצור הכולל באמצעות חשיפת EBL ופיתוח ואחריו בתצהיר מתכת והמראה לייצר ננו המתכתי על התמזגו תומך סיליקה. אנא לחץ כאן כדי לצפות בגרסה גדולה יותר של דמות זו.

איור 2. תכנית של דוארlectron יתוגרפיה קרן, בתצהיר מתכת, ותהליך שיגור הצעדים המועסקים לפברק ננו המתכתי על מצעים דיאלקטרי 16-19. במאמר זה, אנו מציגים את כל הרצף של שלבי תהליך כרוכים בייצור מצעי SERS ידי EBL, ביו-functionalization של מצעים, ו אוסף של ספקטרום ראמאן. שלושה עיצובים חקרו בעבודות האחרונות שלנו 18,19 מופנים (ראה איורים 3 ו -4, וטבלה 1). בעיצוב 1, חלבון רקומביננטי הוא משותק על ננו Au-פונקציונליות ביו על תמיכת סיליקה התמזגה (FS) 18, וזיהוי SERS של החלבון בא לידי ביטוי. בעיצוב 2, רקומביננטי חלבון 21,26,27 עם ובלי יגנד (D-גלוקוז) מחייב גלוקוז הוא משותק באמצעות תגי היסטידין ברווחים בין ננו Ag על FS מצופה ניקל, ואת הכריכה של גלוקוז לחלבון הוא זוהה. בעיצוב 3, thiolated DN מחייב דופמיןAptamer 19,23 הוא משותק על ננו Au על FS, ואת הכריכה של דופאמין על ידי aptamer המשותק הוא הוכיח. כולל את כל שלבי הניסוי הרלוונטיים מהכנת מצע לרכישת ספקטרום ראמאן, ונציג של מולקולות ביולוגיות ואסטרטגיות של חוסר תנועה שונות, דוגמאות אלה הן שימושיות עבור מגוון רחב של יישומים, ממחקר חקר חקירת ממשקי ננו-ביולוגי על ידי SERS לפיתוח SERS חיישנים ביולוגיים של מולקולות קטנות המעסיקות חלבונים או aptamer ליגנד מחייב כשיטת הכרה. אנא לחץ כאן כדי לצפות בגרסה גדולה יותר של דמות זו.

איור 3. ערכות של שלושה עיצובי נציג באמצעות מולקולות ביולוגיות שונות, שיטות של immobilization, ומצע חומרים: (א) חלבון משותק על ננו-הנקודות אצילי מתכת פונקציונליות על ידי monolayer עצמי התאספו (SAM) של חומצת 11-mercaptodecanoic (mua) במי DI; חלבון מתויג היסטידין גלוקוז המחייב (GBP) ומורכב עם D-גלוקוז משותק על פני המצע בין ננו-נקודות מתכת האצילות (B); -הופסק תיאול (C) aptamer דופמין מחייב השלים עם דופמין (DBA) משותק על ננו-נקודות אצילות מתכת. ראה פירוט נוסף בלוח 1. בעיצוב 2 מאויר על ידי פנל (B), מדגם ללא יגנד המקביל היה גם מוכן להשוואה. אנא לחץ כאן כדי לצפות בגרסה גדולה יותר של דמות זו.

איור 4.מולקולות ביולוגיות המועסקות בשלושה עיצובים: (א) חלבון; חלבון (B) גלוקוז מחייב וD-גלוקוז; (C) דופמין מחייב aptamer DNA ודופאמין. המבנים שלישוני החלבון ב( א) ו- (ב) נלקחים מבנק חלבון נתונים, PDB מזהה 1BDD 20 ו2HPH 21, בהתאמה, ונמשך עם VMD לLINUXAMD64, גרסת 1.9.1 22. המבנה משני aptamer ב( ג) הוא ניבא מהרצף 23 באמצעות ValFold 24 תוכנה ונמשך עם 3.0 PseudoViewer 25. מכתבי G, A, T, C ומתאים לגואנין, אדנין, תימין, ציטוזין ונוקלאוטידים, בהתאמה. אנא לחץ כאן כדי לצפות בגרסה גדולה יותר של דמות זו.
| עיצוב 1 </td> | עיצוב 2 | עיצוב 3 | |
| Biopolymer | חלבון | חלבון קושר גלוקוז (GBP) | aptamer דופמין המחייב (DBA) |
| בינדר | חומצת 11-Mercaptoundecanoic (mua) monolayer עצמי התאספו (SAM) | תגי היסטידין | linkers תיאול |
| ליגנד | אף אחד | D-גלוקוז | דופמין |
| פתרון | Deionized מים (DI) | חיץ פוספט אשלגן | טריס (hydroxymethyl) aminomethane (טריס) וחומצת ethylenediaminetetraacetic חיץ (EDTA); נאגר מלוח פוספט (PBS) |
| מצע | מבני Au על FS | מבני Ag על FS מצופה ניקל | מבני Au על FS |
| ar בדוגמתea | 4 מיקרומטר x 10 מיקרומטר | 4 מיקרומטר x 8 מיקרומטר | 4 מיקרומטר x 10 מיקרומטר |
| דפוס | נקודות Au, 50 ננומטר המגרש | נקודות Ag, 40 ננומטר המגרש | משושים Au, המגרש 200 ננומטר |
| משושים Ag, המגרש 200 ננומטר | רפידות לא מובנים Au | ||
| רפידות לא מובנים Ag | |||
| מינוני חשיפת EBL | נקודות: | נקודות: 105 μC / 2 סנטימטר | משושים: 180 μC / 2 סנטימטר |
| מערכי 120 μC / 2 סנטימטר | משושים: 170 μC / 2 סנטימטר | ||
| מערך השני 96 μC / 2 סנטימטר | |||
| מערך III 72μC / 2 סנטימטר | |||
| גל עירור לייזר | 532 nm | 532 nm | 780 nm |
טבלת 1. שלושה פרויקטי מערכות ננו-ביולוגי.
Protocol
Representative Results
Discussion
SERS צובר הכרה כטכניקה בעלת עוצמה אדירה של ביו-זיהוי המציעה יתרונות ייחודיים רבים. הקשר עם תנודות מולקולריות מאפשר זיהוי באופן סלקטיבי "טביעות אצבע" של analytes הספציפי מספקטרום SERS, ואילו הרגישות הגבוהה במיוחד מאפשרת איתור כמויות קטנות מאוד של אנליטי 9,10,11,35. יתר על כן, SERS הוא טכניקה הורסות שהוא גם רגיש יחסית למים, ובכך שהוא מתאים היטב לחיטוט חומרים ביולוגיים בסביבה המימית הטבעית שלהם 9. התוצאות שהוצגו להדגיש יתרונות אלה, כמו גם נוספים להפגין פוטנציאל חזק של SERS כטכניקה ללא תווית מאוד גמישה ביו-זיהוי. בשלושת עיצובי העסקת monolayers של מולקולות ביולוגיות-משותק מצע שונים, מצבי ראמאן כבר זיהו כי ניתן לייחס בביטחון לanalytes המסוים. כי זיהוי של מולקולות ביולוגיות אלה, or ligands שלהם, כבר הוכיח העסקת משטחים מישוריים של סיליקה התמזגה כתמיכה במצעי SERS, הופך את העיצובים תואמים עם אלקטרוניקה נוכחית והגדרות מיקרופלואידיקה, מבטיח יישומים רבים ביחס עם ארכיטקטורות המתעוררים ביו-אלקטרוני ממשק חומרים ביולוגיים עם משטחים של אלקטרוני והתקני אלקטרו-כימיים 2,3. חשוב לציין, בשתיים משלושה עיצובי זיהוי SERS הודגם עבור מחייב ספציפי של מולקולות קטנות, כגון גלוקוז ודופמין, המעסיק monolayers של החלבון-משותק פני השטח וaptamer, בהתאמה, כאלמנטי הכרה.
עם זאת, יש לקחת כמה היבטי טיפול של על מנת להשיג ביו-זיהוי SERS יעיל בהגדרה "על השבב". קודם כל, אתגר ידוע שהוא משותף לרוב המולקולות ביולוגיות הוא הנטייה שלהם כדי לבזות, במיוחד כאשר הם נחשפים לתנאים שאינם טבעיים כגון envi היבשronment או אור הלייזר אינטנסיבי. לאורך כל הפרוטוקול, שהדגשנו את החשיבות של שמירה על הדגימות תמיד פונקציונליות ביו השקוע בפתרונות מתאימים במהלך הניסוי כולו, מהכנת הדגימות לרכישת ספקטרום ראמאן. באפשרות השנייה, תא אטום למים מותאמים אישית תוכנן (איור 7), כדי למנוע אידוי של הנוזל במהלך חשיפות לייזר. גם משך החשיפה ועוצמת לייזר צריך להיות מוגבל כמתואר בשלב 5.3 של הפרוטוקול, כדי למנוע נזק של הדגימות.
התוצאות של זיהוי SERS נמצאות רגישות לגיאומטריה של המצע המועסק, ובמיוחד את ההפרדה בין התכונה של ננו המתכתי. כפי שעולה מנתוני 8 ו -9, עוצמת SERS של דגימות 1 עיצוב תלוי במידה רבה ברוחב של הפערים בין ננו-נקודות Au על סיליקה התמזגה. מתוך שלושה מערכים של nanodots Au נבדקו in עיצוב זה (איור 8), עוצמת ראמאן הגבוהה ביותר שהושג עם מערכי, שבו יש פערים הצרים בין תכונות Au ולכן הוא מספק שיפור שדה האלקטרומגנטי יעיל יותר. כאיור 9 ממחיש, נדרשת שליטה בהפרדות בין-תכונה ברמה של 10-20 ננומטר או פחות. העסקת EBL עבור בודה מצעי SERS, כפי שהודגם כאן, מספק רזולוציה יעילה במיוחד לשליטה ברוחב של פערים בין-תכונה. עם EBL חיובי טון להתנגד כגון PMMA, בגודל של חורים במסכות PMMA יכול להיות מגוון, פשוט על ידי שינוי מינון החשיפה. לאחר המראה זה תוצאות בגדלים שונים של נקודות מתכת מפוברקות, והרוחב של פערים בין הנקודות עשוי להיות מכוון כרצוי על ידי בחירת חשיפת EBL נכונה מינוני 18.
האתגר השני הוא אופטימיזציה של גיאומטריה מצע SERS ליישום ביו-זיהוי ספציפי. למרות שאני השפעת השיפורncreases עם ירידה של הפערים בין-התכונה, הגודל גדול יחסית של מולקולות ביולוגיות מטיל מגבלות על אופן צר הפערים יכולים להיות. הדבר ניכר מן התוצאות עבור עיצוב 2, שבו שיטת הקיבוע היא כזה שהחלבון ביעילות נקשר רק על פני השטח בין נקודות מתכת אצילות, אך לא לעצמם נקודות (ראה איור 3). כפי שעולה מתרשים 10, ספקטרום SERS לרפידות Ag לא מובנים לא מראה שום להקות מאנליטי. למרות הרפידות להציג מבנה ננו-גבישים עם פערים בין-אי דקים מאוד (ראה איור 6F) פערים אלה הם צרים מלהכיל את מולקולת חלבון. עם זאת, ממד נוסף של מורכבות מתווסף כאשר יש חלבון ליגנד המחייב כדי להתגלות. באיור 10, להקות SERS CH הן בולטות יותר בספקטרום מGBP-מחויב ליגנד מאשר באחד ללא יגנד, אשר עשויים להיות מוסבר באופן היפותטי על ידי שינוי בקונפורמציה GBPעל כריכה של D-גלוקוז 2 7,27, וכתוצאה מכך מבנה נוקשה יותר עם פעילות ראמאן מוגברת. אם משווה את שני מצעי nanostructured, להקת CH מחלבון ללא יגנד הוא חזק יותר בספקטרום SERS שהושג עם מצע ננו-נקודות, ואילו שתי להקות החלבון וCH הגלוקוז מהחלבון קשור ליגנד הן בולטות יותר עם ננו-המשושים מצע. שני גורמים צפויים לגרום להבדלים אלה, על זמינותו של מרחב שבין Ag תכונות שבו GBP יכול להיקשר לNi, ואת הרגישות של החלבון-מחויב ליגנד ויגנד חופשי לשיפור האלקטרומגנטי של פיזור ראמאן ב" נקודות חמות " בין תכונות אלה. מצד אחד, דפוס ננו-נקודות מציע אזור בין-תכונה גדולה יחסית שבו ציפוי ניקל זמין לחלבון להיקשר, מה שעשוי להסביר להקת CH בולטת יותר נצפתה עבור GBP ללא גלוקוז במצע ננו-נקודות Ag. מצד השני, בשל struc לא האחיד שלהם ture (ראה איור 6 ד), ננו-משושים Ag יכול להיות נוטים להראות שיפור אלקטרומגנטית חזק יותר בפערים צרים בין איי Ag בתוך ננו-משושים וכתוצאה מלהקות רטט CH חזקות מGBP-מחויב גלוקוז במצע ננו-המשושים. פרטי חלק ממשחק גומלין זה דורשים אימות נוספת, ואופטימיזציה של מצעי SERS לanalytes המורכב של חלבונים גדולים כמו GBP עדיין בצנרת.
ברור, זיהוי SERS של יגנד מחייב העסקת מולקולות הביולוגיות משותקות כאלמנט הכרה הוא הקל כאשר רק יגנד הוא ראמאן הפעיל באזור שנבחר, ואילו הרכיבים האחרים אינם. זהו המקרה של 3 עיצוב, שבו להקות SERS הבולט של דופמין קשור aptamer מתקבלות (איור 11). זוג aptamer-דופמין מציג סגוליות מצוינת וספקטרום SERS כולל להקות בולטות ללא כל אות רקע משמעותית.
<p class="jove_content"> מראש עתיד של טכנולוגית SERS תווית-תשלום יהיה כרוך בבדיקות נרחבות של שיפור אות SERS 'המולקולות הביולוגיות עם מגוון רחב של עיצובי ננו-מבנה פני השטח שונים. השימוש ביתוגרפיה אלומת אלקטרונים ישיר לכתוב לפברק ננו השונים עם רמה מעולה של שליטה על גודל, צורה, והפרדה בין תכונה, בשילוב עם מדגם פרוטוקולי ההכנה שהוצגו כאן, יאפשר להשיג השוואה ואימות צולבת של התוצאות על ידי קבוצות מחקר שונות. זה היה מענה לאתגר הגדול של שחזור כאשר מצעי SERS מיוצרים ההעסקה חלופית "מלמטה למעלה" שיטות 11,12,13, המאפשר לשליטה טובה יותר בגודל של ננו-מבנה המתכת ועמדה כלפי זיהוי אמין של עיצוב מצע אופטימלי למגוון רחב של יישומים. יכולת הרחבה של טכניקות אלה יכול לאחר מכן ניתן לשפר על ידי שילוב של EBL עם שיטות nanolithography משלים כגון ננוליתוגרפיה חותם 19 לכיוון ייצור המוני עתיד של עיצובים בקנה מידה ננומטרי אופטימיזציה שימוש בטכניקות EBL מתכונן.Disclosures
The authors have nothing to disclose.
Acknowledgements
The authors would like to thank: David Wishart, Valentyna Semenchenko, Mark McDermott, Michael Woodside, and Albert Cao for their help in developing and preparing the protein conjugates as well as the DNA aptamer; T. M. Fahim Amin, Mosa Sharmin Aktar, and Trevor Olsen for their assistance in the sample preparation, Jonathan Mane for his assistance in generating images of the molecular structures; and the funding sources including the National Research Council of Canada – National Institute for Nanotechnology (NRC-NINT), Natural Sciences and Engineering Research Council of Canada (NSERC), and the University of Alberta for supporting the work.
Materials
| 11-Mercaptoundecanoic acid (MUA) | Sigma Aldrich (www.sigmaalrich.com) |
450561 ALDRICH | Used for surface functionalization in Design 1 |
| Conductive polymer | Mitsubishi Rayon (www.mrc.co.jp) |
aquaSAVE-57xs | A 70 nm thick layer is used as anti-charging coating for EBL exposures |
| D-glucose | Collaborator Lab. | Ligand in Design 2 | |
| Dopamine | Collaborator Lab. | Ligand in Design 3 | |
| Dopamine binding aptamer (DBA) | Integrated DNA Technologies Inc. (www.idtdna.com) |
5'- /Thiol Modifier C6 S-S/ AAAAAAAAAA GTCTCTGTGT GCGCCAGAGA ACACTGGGGC AGATATGGGC CAGCACAGAA TGAGGCCC-3' | Biopolymer in Design 3 |
| Fused silica wafers | Mark Optics www.markoptics.com |
||
| Glucose binding protein (GBP) | Collaborator Lab. (www.ncbi.nlm.nih.gov/protein/gi|145579532) |
PDB ID 2HPH | Biopolymer in Design 2 |
| High vacuum grease | Dow Corning (www.dowcorning.com) |
Used to seal water-proof chamber, step 5.1 | |
| Hydrogen Peroxide 30%, H2O2 | J.T. Baker | Used for pirahna solution, step 1.2 | |
| N-ethyl-N'-(3-(dimethylamino) propyl) carbodiimide (EDC) | Sigma Aldrich www.sigmaaldrich.com |
03450 FLUKA | Used for immobilization of biopolymer in Design 1 |
| N-Hydroxysuccinimide (NHS) | Sigma Aldrich (www.sigmaaldrich.com) |
130672 ALDRICH | Used for immobilization of biopolymer in Design 1 |
| Potassium phosphate buffer | Collaborator Lab. | Buffer used in Raman sampling | |
| Phosphate buffered | Collaborator Lab. | Solvent in Design 3 | |
| saline (PBS) | |||
| Polymethylmethacrylate (PMMA) 950 A2 | MicroChem (www.microchem.com) |
A 90 nm thick layer is used as EBL positive tone resist | |
| Recombinant protein A | Protein Mods Inc (www.proteinmods.com) |
PDB ID 1BDD (www.rcsb.org/pdb/explore/explore.do?structureId=1bdd) |
Biopolymer in Design 1 |
| Sulfuric acid 96%, H2SO4 | J.T. Baker | Used for pirahna solution, step 1.2 | |
| Tris(hydroxymethyl)aminomethane (TRIS) and ethylenediaminetetraacetic acid (EDTA) buffer | Sigma Aldrich (www.sigmaaldrich.com) |
T9285 SIGMA | Buffer in Design 3 |
| Dicing saw | Diamond Touch Technology Inc. | Used to cut FS wafer, step 1.1 | |
| (17301 W Colfax Ave # 152, Golden, CO) | |||
| Electron beam evaporator | Kurt J. Lesker (www.lesker.com) |
Used for Au and Ag evaporation | |
| Electron beam evaporator | Johnsen Ultravac (JUV) (www.ultrahivac.com) |
JuV E-gun | Used for Ni evaporation |
| Microscope cover slips (25 mm) | Fisher Scientific (www.fishersci.ca) |
12-545-102 | Used in water-proof chamber, step 5.1 |
| Microscope slides (3×1 in.) | Fisher Scientific (www.fishersci.ca) |
Used in water-proof chamber, step 5.1 | |
| Raith 150TWO EBL exposure system | Raith Inc. (www.raith.com) |
Raith 150TWO system | Used for EBL exposures, step 2.2 |
| Raman microscope | Thermo Scientific (www.thermoscientific.com) |
Nicolet Almega XR | Used for Raman spectroscopy, step 5.3 |
| Sonicator system | Branson (www.bransonic.com) |
Used for liftoff and solutions mixing | |
| Spinner | Brewer Spinner and Hotplate (www.brewerscience.com) |
Cee 200X and Cee 1300X | Used to spin-coat PMMA and conductive polymer, step 2.1 |
References
- Sapsford, K. E., Tyner, K. M., Dair, B. J., Deschamps, J. R., Medlintz, I. L. Analyzing Nanomaterial Bioconjugates: A Review of Current and Emerging Purification and Characterization Techniques. Anal. Chem. 83, 4453-4488 (2011).
- Walcarius, A., Minteer, S. h. D., Wang, J., Yu, L., Merkoçi, A. Nanomaterials for Bio-Functionalized Electrodes: Recent Trends. J. Mater. Chem. B. 1, 4878-4908 (2013).
- Kim, J., et al. Applications, Techniques, and Microfluidic Interfacing for Nanoscale Biosensing. Microfluid. Nanofluid. 7, 149-167 (2009).
- Rassaei, L., Singh, P. S., Lemay, S. G. Lithography-Based Nanoelectrochemistry. Anal. Chem. 83, 3974-3980 (2011).
- Wong, L. S., Khan, F., Micklefield, J. Selective Covalent Protein Immobilization: Strategies and Applications. Chem. Rev. 109, 4025-4053 (2009).
- Ley, C., Holtmann, D., Mangold, K. -. M., Schrader, J. Immobilization of Histidine-Tagged Proteins on Electrodes. Colloids and Surfaces B: Biointerfaces. 88, 539-551 (2011).
- Kim, D., Herr, A. E. Protein Immobilization Techniques for Microfluidic Assays. Biomicrofluidics. 7, 041501 (2013).
- Anker, J. N., Hall, W. P., Lyandres, O., Shah, N. C., Xhao, J., Van Duyne, R. P. Biosensing with Plasmonic Nanosensors. Nature Materials. 7, 442-453 (2008).
- Bantz, K. C., et al. Recent Progress in SERS Biosensing. Phys.Chem. 13, 11551-11567 (2011).
- Sharma, B., Frontiera, R. R., Henry, A. -. I., Ringe, E., Van Duyne, R. P. SERS: Materials, Applications, and the Future. Mater. Today. 15, 16-25 (2012).
- Kleinman, S. L., Frontiera, R. R., Henry, A. -. I., Dieringer, J. A., Van Duyne, R. P. Creating, Characterizing, and Controlling Chemistry with SERS Hot Spots. Phys.Chem.Chem.Phys. 15, 21-36 (2013).
- Fan, M., Andrade, F. S., Brolo, A. G. A Review on the Fabrication of Substrates for Surface Enhanced Raman Spectroscopy and their Applications in Analytical Chemistry. Anal. Chim. Acta. 693, 7-25 (2011).
- Cao, Y., Li, D., Jiang, F., Yang, Y., Zh, H. Engineering Metal Nanostructure for SERS Application. J. Nanomater. 123812, 1-12 (2013).
- Glembocki, O., Rendell, R., Alexson, D., Prokes, S., Fu, A., Mastro, M. Dielectric-Substrate-Induced Surface-Enhanced Raman Scattering. Phys. Rev. B. 80, 085416 (2009).
- Merlen, A., et al. Surface Enhanced Spectroscopy with Gold Nanostructures on Silicon and Glass Substrates. Surf. Sci. 605, 1214-1218 (2011).
- Muhammad, M., Buswell, S. C., Dew, S. K., Stepanova, M. Nanopatterning of PMMA on Insulating Surfaces with Various Anticharging Schemes Using 30 keV Electron Beam Lithography. J. Vac. Sci. Technol. B. 29, 06F304 (2011).
- Peters, R., Fito, T., Gutierrez-Rivera, L., Dew, S. K., Stepanova, M. Study of Multilayer Systems in Electron Beam Lithography. J. Vac. Sci. Technol. B. 31, 06F407 (2013).
- Gutierrez-Rivera, L., Peters, R., Dew, S., Stepanova, M. Application of EBL Fabricated Nanostrucutred Substrates for SERS Detection of Protein A in Aqueous Solution. J. Vac. Sci. Technol.B. 31, (2013).
- Gutierrez-Rivera, L., Peters, R., Dew, S., Stepanova, M. Surface-Enhanced Raman Spectroscopy Detection of Protein-Ligand Binding Using D-glucose and Glucose Binding Protein on Nanostructured Plasmonic Substrates. , (2014).
- Peters, R. . Fabrication and Testing of Surface-Enhanced Raman Spectroscopy Substrates for the Detection of Biomolecules [MSc Thesis]. , (2014).
- Gouda, H., Torigoe, H., Saito, A., Sato, M., Arata, Y., Shimada, I. Three-Dmensional Solution Structure of the B Domain of Staphylococcal Protein A: Comparisons of the Solution and Crystal Structures. Biochemistry. 31, 9665-9672 (1992).
- Cuneo, M. J., Johnson, S. J., Beese, L. S., Hellinga, H. W. High Resolution Structure of E. Coli Glucose/Galactose Binding Protein Bound with Glucose. Research Collaboratory for Structural Bioinformatics (RCSB) Protein Data Bank. , (2009).
- Humphrey, W., Dalke, A., Schulten, K. VMD – Visual Molecular Dynamics. J. Molec. Graphics. 14, 33-38 (1996).
- Walsh, R., DeRosa, M. C. Retention of Function in the DNA Homolog of the RNA Dopamine Aptamer. Biochem. Biophys. Res. Comm. 388, 732-735 (2009).
- Akitomi, J., Kato, S., Yoshida, Y., Horii, K., Furuich, M., Waga, I. ValFold: Program for the Aptamer Truncation Process. Biomed. Inf. 7, 38-40 (2011).
- Han, K., Lee, Y., Kim, W. PseudoViewer: Automatic Visualization of RNA Pseudoknots. Bioinformatics. 18, S321-S327 (2002).
- Dwyer, M. A., Hellinga, H. W. Periplasmic Binding Proteins: a Versatile Superfamily for Protein Engineering. Curr. Opin. Struct. Biol. 14, 495-504 (2004).
- Benson, D. E., Conrad, D. W. Design of Bioelectronic Interfaces by Exploiting Hinge-Bending Motions in Proteins. Science. 293, 1641-1644 (2001).
- Bozic, S., Chorzempa, J. . Pirahna Cleaning. , (2011).
- Mohammad, M. A. Raith 150TWO SOP. , (2011).
- Schmidt, M. W., et al. General Atomic and Molecular Electronic Structure System. J. Comput. Chem. 14, 1347-1363 (1993).
- Bode, B. M., Gordon, M. S. MacMolPlt: a Graphical User Interface for GAMESS. J. of Mol. Graph. Mod. 16, 133-138 (1998).
- Bright, A., Devi, T. S. R., Gunasekaran, S. Spectroscopical Vibrational Band Assignment and Qualitative Analysis of Biomedical Compounds with Cardiovascular Activity. Int. J. Chem. Tech. Res. 2, 379-388 (2010).
- Bandekar, J. Amide Modes and Protein Conformation. Biochim. Biophys. Acta. 1120, 123-243 (1992).
- Barth, A., Zscherp, C. What Vibrations Tell About Proteins. Quarterly Reviews of Biophysics. 35, 369-340 (2002).
- Chrimes, A. F., Khoshmanesh, K. h., Stoddart, P. R. M. i. t. c. h. e. l. l. A., Kalantar-Zadeh, K. Microfluidics and Raman Microscopy: Current Applications and Future Challenges. Chem. Soc. Rev. 42, 5880-5906 (2013).
- Park, S. -. K., Lee, N. -. S., Lee, S. -. H. Vibrational Analysis of Dopamine Neutral Base based on Density Functional Force Field. Bull.-Korean Chem. Soc. 21, 959-968 (2000).
- Briand, E., Salmain, M., Compère, C., Pradier, C. M. Immobilization of Protein A on SAMs for the elaboration of immunosensors. Coll. Surf. B: Biointerfaces. 53, 215-224 (2006).
- Lakowicz, L. R., et al. Radiative decay engineering: 2. Effects of Silver Island Films on Fluorescence Intensity, Lifetimes, and Resonance Energy Transfer. Analytical biochemistry. 301, 261-277 (2002).

