Поверхность Enhanced спектроскопии комбинационного рассеяния света обнаружения биомолекул Использование EBL, изготовленных наноструктурированных Субстраты
Summary
We describe the fabrication and characterization of nano-biological systems interfacing nanostructured substrates with immobilized proteins and aptamers. The relevant experimental steps involving lithographic fabrication of nanostructured substrates, bio-functionalization, and surface-enhanced Raman spectroscopy (SERS) characterization, are reported. SERS detection of surface-immobilized proteins, and probing of protein-ligand and aptamer-ligand binding is demonstrated.
Abstract
Изготовление и характеристика сопряженных нано-биологических систем, взаимодействующими металлические наноструктуры на твердых носителях с иммобилизованными биомолекул сообщается. Вся последовательность соответствующих экспериментальных этапов описан, включая изготовление наноструктурных подложках с использованием электронной лучевой литографии, иммобилизации биомолекул на подложках, и их характеристики, используя поверхность с повышенной спектроскопия комбинационного рассеяния (SERS). Используются три различных конструкций нано-биологических систем, в том числе белка А, глюкоза-связывающего белка, и связывание дофамина аптамера ДНК. В двух последних случаях, связывание соответствующих лигандов, D-глюкозы и допамина, также включены. Три вида биомолекул иммобилизуют на субстратах наноструктурных различными методами, и результаты съемки SERS сообщается. Возможности SERS для обнаружения колебательных мод от поверхности с иммобилизованным белков, а также захватить белок-лиганд ANсвязывание d аптамер-лиганд продемонстрировали. Результаты также показывают влияние геометрии поверхности наноструктур, биомолекул стратегии иммобилизации комбинационного активности молекул и наличия или отсутствия связывания лиганда на спектры SERS приобретенного.
Introduction
Возможности по разработке и характеризующие сопряженных нано-биологических систем сопряжения твердотельных наноструктур и биологических полимеров становится все более важным дальнейшего прогресса в области следующего поколения био-зондирования и био-исполнительных технологий в 1,2 раза. Это включает в себя междисциплинарные исследования в целом ряде научных направлений, таких как изготовление соответствующих твердотельных компонентов (микро-или нано-электродов, нано-покрытий, нанопроволоки, или наночастиц) 2,3,4; иммобилизация биомолекул на поверхности, чтобы создать нужные Биоконъюгаты 5,6,7; и мониторинга нано-биологических интерфейсы 1. В большинстве случаев, выбор оптимального производства, био-функционализации и методов характеризации сильно взаимосвязаны. Очевидно, что выбор методов нанофабрикации будет определяться требованиями твердотельных компонентов системы, будучи в значительной степени зависит от метода обнаружения, который в Тун определяется природой биополимеров, участвующих и с целью мониторинга интерфейс.
Из широкого разнообразия методик, применяемых для характеристики биоконъюгата системы 1,3, поверхность повышается спектроскопии комбинационного рассеяния света (ГКР) стала весьма перспективным методом для обнаружения химических и биологических видов на поверхностях 8,9,10,11. ГКР работает неупругое рассеяние монохроматического света на поверхностных иммобилизованных биомолекул (рис 1), что позволяет захвата уникальных подписей, соответствующих молекулярных колебаний. Эта возможность выделить среди различных молекул, не привлекая этикетки, сложные химии, или времени действия, делает ГКР потенциально очень эффективный метод био-обнаружения. Еще одним важным преимуществом ГКР является его высокая чувствительность. Возбуждение локализованных поверхностных плазмонов светом, взаимодействуя с благородных металлов наноструктур (SERS субстраты) резко увеличивает Intensity комбинационного рассеяния аналита, позволяя обнаруживать очень малых количеств молекул, из монослоев до предела в одиночных молекул 8,9,10,11. Наконец, большинство биомолекулы водные растворы требуют, чтобы быть стабильной. Поскольку вода часто имеет ограниченную комбинационного деятельность, фоновый сигнал из водных образцов минимизируется 9. Применение ГКР выставлен экспоненциальный рост в течение последнего десятилетия 10. Тем не менее, много говорили задача ГКР является то, что электромагнитное усиление комбинационного рассеяния в решающей степени зависит от размера, формы и расстояния между металлическими наноструктур, где плазмонных волн индуцированной 11,12,13. Для того, чтобы достичь эффективного и воспроизводимые SERS измерений, контролировать геометрию подложки требуется на наноуровне размеров.
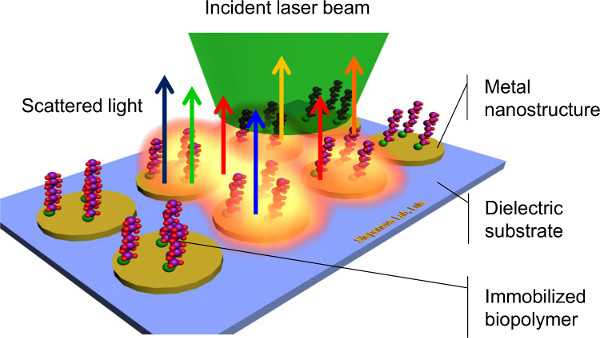
Рисунок 1. Scгема поверхности с повышенной спектроскопии комбинационного рассеяния.
Многочисленные методы, используемые для изготовления ГКР субстраты 11,12,13 условно можно разделить на снизу вверх и сверху вниз методов. Методы первого типа используют различные процессы самосборки или направленного химического синтеза для получения наноструктур. Часто имя примеры включают иммобилизации монодисперсных наночастиц на твердых подложках 11,12,13, тепловой, распыления или электрохимического осаждения шероховатых металлических пленок 11,12, и различных химических методов синтеза 13. Хотя такие методы, как правило, относительно простой и недорогой, большинство из них сталкиваются с проблемой отсутствия контроля над расположения сооружений, и ограниченная воспроизводимости образца к образцу.
В отличие от этого, методы сверху вниз литографии использовать манипулировать инструментов, таких как пучки частиц, чтобы создать нужные узоры на поверхности. Один из наиболее часто используемыхметоды нанолитографии, электронно-лучевой литографии (EBL), предлагает превосходный контроль над услугам вниз до уровня ниже 10 нм, а также гибкость, позволяющую различных конструкций подложки, на твердых носителях 11,12. В ЭВН, пучок электронов фокусировался в пятно в несколько нанометров, сканирования диаметра по всей поверхности чувствительной электронной материала (сопротивляться), вызывающим химические изменения в открытых районах. Для положительного тона сопротивляется, такие как полиметилметакрилат (ПММА), электронных результатов воздействия света в разрыва полимерных цепей, составляющих сопротивления, что приводит к повышенной растворимости в соответствующем растворителе (разработчик). Процесс электронно-лучевой литографии включает спин-покрытие равномерным слоем резиста на подложке; облучение целевой резиста материала в вакуумной камере с электронным пучком; и развитие образца, чтобы удалить растворимые участки.
Диэлектрические опоры В нижней металлических наноструктур, таких, как плавленого кварца, имеют Bееп значительно повышают интенсивность в ГКР из-за локализации плазмонов волн по сравнению с другими материалами, такими как кремний 14,15. Однако ЭВН рисунка на диэлектрической подложке, особенно на наноуровне, включает в себя существенные проблемы, связанными с перезарядкой наращивание во время экспозиции. Ранее мы показали, 16,17, что эти трудности могут быть преодолены путем размещения проводящих слоев полимера выше сопротивляться. Рисунок 2 показана схема общего процесса изготовления с помощью EBL экспозиции и развития с последующим развитием осаждения металла и старта для производства металлических наноструктур на плавленый кремния опоры. Пожалуйста, нажмите здесь, чтобы увидеть увеличенную версию этой цифры.

Рисунок 2. Схема еLectron лучевой литографии, осаждения металлов и старта этапов процесса, используемых для изготовления металлических наноструктур на диэлектрических подложках 16-19. В данной статье мы представляем всю последовательность шагов процесса, включающих SERS субстратов изготовление по ЭВН, био-функционализации субстратов, и Коллекция спектров комбинационного рассеяния. Три конструкции, изученные в наших последних работ 18,19 решаются (см рис 3 и 4, а в таблице 1). В Design 1, рекомбинантный белок иммобилизуют на био-функционализированные Au наноструктур на плавленый кварц (FS) поддержки 18, и обнаружение SERS белка показано. В конструкции 2, рекомбинантный глюкозо-связывающий белок 21,26,27 с и без лиганда (D-глюкозы) иммобилизуют посредством гистидина тегов в промежутках между Ag наноструктур на FS никелевым покрытием, а связывание глюкозы с белком обнаружено. В конструкции 3, тиолированного допамина связывания DNАптамер 19,23 обездвижен на Au наноструктур на FS, и связывание дофамина с иммобилизованным аптамера демонстрируется. С учетом всех соответствующих экспериментальных шагах от подготовки основания до комбинационного приобретения спектров и представителя различных биомолекул и стратегий иммобилизации, эти примеры являются полезными для широкого круга применений, от поисково-разведочные работы допроса нано-биологических интерфейсы по ГКР в развитие ГКР биосенсоры малых молекул, использующих белково или аптамера-лиганд-связывающий как метод распознавания. Пожалуйста, нажмите здесь, чтобы увидеть увеличенную версию этой цифры.

Рисунок 3. Схемы трех представительных образцов, используя различные биомолекулы, методы immobilizaции, и материалы подложки: (A) белок, иммобилизованный на благородного металла нано-точек функционализированных посредством самоорганизующейся монослоя (SAM) из 11-mercaptodecanoic кислоты (почтовый клиент) в деионизированной воде; (В) гистидин-меченый глюкозы связывающий белок (GBP) в комплексе с D-глюкозы, иммобилизованным на поверхности подложки между благородных металлов нано-точек; (C) тиольное концевыми дофамина связывания аптамер укомплектованный дофамина (DBA), иммобилизованного на благородных металлов нано-точек. Более подробно см в таблице 1. В конструкции 2, показанном на панели (В), образец без соответствующего лиганда был также подготовлен для сравнения. Пожалуйста, нажмите здесь, чтобы увидеть увеличенную версию этой цифры.

Рисунок 4.Биомолекулы, используемые в трех конструкций: (A) белка А; (В) белок, связывающий глюкозы и D-глюкозы; (С) допамина связывания аптамер ДНК и допамин. Белковые третичные структуры в (а) и (б) взяты из белка банке данных, PDB ID 1BDD 20 и 2HPH 21, соответственно, и обращается с VMD для LINUXAMD64, версия 1.9.1 22. Аптамер вторичная структура в (С) предсказал из последовательности 23, используя ValFold 24 программное обеспечение и обращается с PseudoViewer 3,0 25. Буквы G, A, T, и C соответствуют гуанин, аденин, тимин и цитозин нуклеотидов, соответственно. Пожалуйста, нажмите здесь, чтобы увидеть увеличенную версию этой цифры.
| Дизайн 1 </TD> | Дизайн 2 | Дизайн 3 | |
| Биополимер | Протеин А | Глюкоза связывающий белок (GBP) | Допамин связывания аптамер (DBA) |
| Связующее вещество | 11-меркаптоундекановой кислоты (MUA) самоорганизующихся монослоя (SAM) | Гистидин теги | Тиоловые Линкеры |
| Лиганд | Ни один | D-глюкозы | Допамин |
| Решение | Деионизированная (DI) воды | Калий фосфатном буфере | Трис (гидроксиметил) (ТРИС) и этилендиаминтетрауксусной кислоты (ЭДТА) буфере; Забуференный фосфатом физиологический раствор (PBS) |
| Подложка | Au структуры на FS | Ag структуры на FS никелевым покрытием | Au структуры на FS |
| Узорчатое AREA | 4 мкм х 10 мкм | 4 мкм х 8 мкм | 4 мкм х 10 мкм |
| Шаблон | Au точки, 50 нм шаг | Ag точки, 40 нм шаг | Au шестиугольники, шаг 200 нм |
| Ag шестиугольники, шаг 200 нм | Au неструктурированные колодки | ||
| Ag неструктурированные колодки | |||
| ЭЛП дозы облучения | Точки: | Точки: 105 мкКл / см 2 | Шестигранники: 180 мкКл / см 2 |
| Массив I 120 мкКл / см 2 | Шестигранники: 170 мкКл / см 2 | ||
| Массив II 96 мкКл / см 2 | |||
| Массив III 72мкКл / см 2 | |||
| Длина волны лазерного возбуждения | 532 нм | 532 нм | 780 нм |
Таблица 1. Три конструкции нано-биологических систем.
Protocol
Representative Results
Discussion
ГКР набирает признание как чрезвычайно мощной техники био-обнаружения, предлагая множество уникальных преимуществ. Соотношение с молекулярных колебаний позволяет избирательно идентификации "отпечатки пальцев" конкретных аналитов из спектров SERS, в то время как чрезвычайно высокая чувствительность позволяет обнаруживать очень малые количества аналита 9,10,11,35. Кроме того, SERS является неразрушающим методом, который также относительно нечувствительны к воде, и тем самым он очень хорошо подходит для исследований биологических материалов в их естественном водной среде 9. Результаты, представленные подчеркнуть эти преимущества, а также дополнительно демонстрируют мощный потенциал ГКР как очень гибкой этикетки без технике био-обнаружения. В трех конструкций с применением различных монослоев подложки с иммобилизованными биомолекулами, рамановские режимы были обнаружены, которые могут быть с уверенностью отнесены к конкретным аналитов. Это обнаружение этих биомолекул, ØR их соответствующие лиганды, были продемонстрированы с использованием плоских поверхностей из плавленого кварца в качестве поддержки для ГКР субстратов, делает дизайн совместим с существующими электроники и настройки микрофлюидики, обещая многочисленные приложения в связи с появление био-электронные архитектуры сопряжения биологических материалов с поверхностей электронный и электрохимические устройства 2,3. Важно отметить, что в двух из трех образцов Обнаружение SERS была продемонстрирована для специфического связывания малых молекул, таких как глюкоза и дофамина, с использованием монослоев на поверхности с иммобилизованным белком и аптамера, соответственно, в качестве элементов распознавания.
Однако некоторые аспекты должны быть учтены в целях достижения эффективного ГКР био-обнаружения в настройках "на-чипе". Прежде всего, хорошо известно, что задача является общей для большинства биомолекул является их склонность к ухудшению, особенно при контакте с не-природных условий, таких как сухой окружасреды или интенсивного лазерного света. На протяжении протокола, мы подчеркивали важность всегда держать био-функционализирован образцы, погруженные в соответствующих решений в течение всего эксперимента, начиная с подготовки образцов к приобретению спектров комбинационного рассеяния. Для последнего, пользовательские водонепроницаемый камера была разработана (рис 7), чтобы избежать испарения жидкости при лазерном воздействии. Продолжительность воздействия и интенсивности лазерного также должно быть ограничено, как описано в шаге 5.3 протокола, чтобы избежать повреждения образцов.
Результаты обнаружения SERS найдены чувствительны к геометрии подложки, используемой, в частности, и разделение между особенностью металлических наноструктур. Как следует из фиг.8 и 9, интенсивность SERS из дизайн 1 образцов сильно зависит от ширины зазоров между Au нано-точек на кварцевом стекле. Из трех массивов Au наноточек испытания IN Эта конструкция (рис 8), высокая интенсивность комбинационного рассеяния достигается с массивом I, который имеет узкие зазоры между функциями Аи и поэтому обеспечивает более эффективное электромагнитное усиление поля. Как показано на рисунке 9 показана, контроль между удобства разделения на уровне 10-20 нм или менее требуется. Используя ЭВН для изготовления ГКР субстраты, как показано здесь, обеспечивает эффективное решение специально для управления шириной между художественных пробелов. С положительным тона EBL противостоять такие как ПММА, размер отверстий в ПММА масок можно варьировать путем простого изменения дозы облучения. После отрыва это приводит к различным размерам готовых металлических точек, а ширина зазоров между точками может быть настроен по желанию, выбрав правильное EBL доз облучения 18.
Другой проблемой является оптимизация геометрии ГКР подложки для конкретного применения био-обнаружения. Хотя эффект усиления Increases с уменьшением зазоров между художественных, относительно большой размер биологических молекул накладывает ограничения на как сократить разрыв может быть. Это видно из результатов для проектирования 2, где метод иммобилизации такова, что белок эффективно связывается только с поверхности между точками благородных металлов, но не самих точек (см фиг.3В). Как следует из рис 10, спектры ГКР для неструктурированных колодок Ag не показывают какие-нибудь группы из анализируемого вещества. Несмотря на то, колодки обладают нано-кристаллическую структуру с очень тонкими межостровных пробелов (рис 6F) эти пробелы являются слишком узкими, чтобы вместить молекулу белка. Еще один аспект сложности добавляют при белок-лиганд связывания должен быть обнаружен. На фиг.10, полосы SERS CH более выражены в спектрах от лиганд-связанным GBP, чем в свободной лиганда один, который может быть гипотетически объяснить изменением конформации GBPпри связывании D-глюкозы 2 7,27, что приводит к более жесткой структуры с повышенной активностью комбинационного рассеяния. Если сравнить два наноструктурированных подложек, СН-группа из лиганда без белка сильнее в спектрах ГКР, полученные с нано-точек подложки, в то время как оба белка и CH глюкозы группы из лиганд-связанного белка более выражены с нано-шестиугольников Подложка. Два фактора, как ожидается, приведет к этим различиям, наличие пространства между Ag есть где GBP может связываться с Ni, и восприимчивость лиганд-связанных и лиганда бесплатно белка электромагнитного повышения комбинационного рассеяния в "горячие точки" между этими функциями. С одной стороны, нано-точек шаблон предлагает относительно большую площадь между функции, где Ni покрытия для белок для связывания, который может объяснить более выраженный CH группу наблюдаемое для глюкозы, свободных GBP на Ag нано-точек подложки. С другой стороны, из-за их неравномерного струкры (рис 6D), Ag нано-шестиугольники может быть подвержен показать сильное электромагнитное усиление в узких промежутках между Ag островов в пределах нано-шестиугольников, в результате сильных полос CH вибрация от глюкозы связаны GBP на нано-шестиугольников подложки. Некоторые детали этого взаимодействия требует дальнейшей проверки и оптимизации ГКР подложек для сложных анализируемых с участием крупных белков, таких как GBP все еще находится в стадии разработки.
Очевидно, что определение SERS связывания лиганда с использованием иммобилизованных молекул, в качестве элемента распознавания облегчается, если только лиганд комбинационного активность в выбранной области, в то время как другие компоненты нет. Это случай Design 3, где получают выраженные SERS полосы аптамера переплете дофамина (рисунок 11). Пара аптамер-дофамин проявляет отличную специфичность и спектре ГКР включает выраженные полосы без каких-либо значительных фонового сигнала.
<p class="jove_content"> Будущее продвижение технологии ГКР этикеткой плата будет включать обширные испытания ГКР усиление сигнала биомолекул с широким кругом различных конструкций поверхности наноструктур. Использование прямого записи электронно-лучевой литографии для изготовления различных наноструктур с превосходным уровнем контроля над размером, формой и разделения между функций, в сочетании с протоколами пробоподготовки, представленные здесь, будет способствовать сравнение и кросс-валидация полученных результатов различных исследовательских групп. Это будет касаться основных проблем воспроизводимости при SERS субстраты изготавливаются с использованием альтернативных "снизу вверх" методы 11,12,13, что позволяет лучше контролировать металл размер наноструктуры и позиции в отношении надежного определения оптимальной конструкции подложки для широкого разнообразия приложений. Масштабируемость из этих методов может впоследствии быть улучшено путем объединения EBL с дополнительными методами нанолитографии, таких как наноВыходные данные литографии 19 к будущему массового производства наноразмерных конструкций оптимизированной используя настраиваемые EBL методы.Disclosures
The authors have nothing to disclose.
Acknowledgements
The authors would like to thank: David Wishart, Valentyna Semenchenko, Mark McDermott, Michael Woodside, and Albert Cao for their help in developing and preparing the protein conjugates as well as the DNA aptamer; T. M. Fahim Amin, Mosa Sharmin Aktar, and Trevor Olsen for their assistance in the sample preparation, Jonathan Mane for his assistance in generating images of the molecular structures; and the funding sources including the National Research Council of Canada – National Institute for Nanotechnology (NRC-NINT), Natural Sciences and Engineering Research Council of Canada (NSERC), and the University of Alberta for supporting the work.
Materials
| 11-Mercaptoundecanoic acid (MUA) | Sigma Aldrich (www.sigmaalrich.com) |
450561 ALDRICH | Used for surface functionalization in Design 1 |
| Conductive polymer | Mitsubishi Rayon (www.mrc.co.jp) |
aquaSAVE-57xs | A 70 nm thick layer is used as anti-charging coating for EBL exposures |
| D-glucose | Collaborator Lab. | Ligand in Design 2 | |
| Dopamine | Collaborator Lab. | Ligand in Design 3 | |
| Dopamine binding aptamer (DBA) | Integrated DNA Technologies Inc. (www.idtdna.com) |
5'- /Thiol Modifier C6 S-S/ AAAAAAAAAA GTCTCTGTGT GCGCCAGAGA ACACTGGGGC AGATATGGGC CAGCACAGAA TGAGGCCC-3' | Biopolymer in Design 3 |
| Fused silica wafers | Mark Optics www.markoptics.com |
||
| Glucose binding protein (GBP) | Collaborator Lab. (www.ncbi.nlm.nih.gov/protein/gi|145579532) |
PDB ID 2HPH | Biopolymer in Design 2 |
| High vacuum grease | Dow Corning (www.dowcorning.com) |
Used to seal water-proof chamber, step 5.1 | |
| Hydrogen Peroxide 30%, H2O2 | J.T. Baker | Used for pirahna solution, step 1.2 | |
| N-ethyl-N'-(3-(dimethylamino) propyl) carbodiimide (EDC) | Sigma Aldrich www.sigmaaldrich.com |
03450 FLUKA | Used for immobilization of biopolymer in Design 1 |
| N-Hydroxysuccinimide (NHS) | Sigma Aldrich (www.sigmaaldrich.com) |
130672 ALDRICH | Used for immobilization of biopolymer in Design 1 |
| Potassium phosphate buffer | Collaborator Lab. | Buffer used in Raman sampling | |
| Phosphate buffered | Collaborator Lab. | Solvent in Design 3 | |
| saline (PBS) | |||
| Polymethylmethacrylate (PMMA) 950 A2 | MicroChem (www.microchem.com) |
A 90 nm thick layer is used as EBL positive tone resist | |
| Recombinant protein A | Protein Mods Inc (www.proteinmods.com) |
PDB ID 1BDD (www.rcsb.org/pdb/explore/explore.do?structureId=1bdd) |
Biopolymer in Design 1 |
| Sulfuric acid 96%, H2SO4 | J.T. Baker | Used for pirahna solution, step 1.2 | |
| Tris(hydroxymethyl)aminomethane (TRIS) and ethylenediaminetetraacetic acid (EDTA) buffer | Sigma Aldrich (www.sigmaaldrich.com) |
T9285 SIGMA | Buffer in Design 3 |
| Dicing saw | Diamond Touch Technology Inc. | Used to cut FS wafer, step 1.1 | |
| (17301 W Colfax Ave # 152, Golden, CO) | |||
| Electron beam evaporator | Kurt J. Lesker (www.lesker.com) |
Used for Au and Ag evaporation | |
| Electron beam evaporator | Johnsen Ultravac (JUV) (www.ultrahivac.com) |
JuV E-gun | Used for Ni evaporation |
| Microscope cover slips (25 mm) | Fisher Scientific (www.fishersci.ca) |
12-545-102 | Used in water-proof chamber, step 5.1 |
| Microscope slides (3×1 in.) | Fisher Scientific (www.fishersci.ca) |
Used in water-proof chamber, step 5.1 | |
| Raith 150TWO EBL exposure system | Raith Inc. (www.raith.com) |
Raith 150TWO system | Used for EBL exposures, step 2.2 |
| Raman microscope | Thermo Scientific (www.thermoscientific.com) |
Nicolet Almega XR | Used for Raman spectroscopy, step 5.3 |
| Sonicator system | Branson (www.bransonic.com) |
Used for liftoff and solutions mixing | |
| Spinner | Brewer Spinner and Hotplate (www.brewerscience.com) |
Cee 200X and Cee 1300X | Used to spin-coat PMMA and conductive polymer, step 2.1 |
References
- Sapsford, K. E., Tyner, K. M., Dair, B. J., Deschamps, J. R., Medlintz, I. L. Analyzing Nanomaterial Bioconjugates: A Review of Current and Emerging Purification and Characterization Techniques. Anal. Chem. 83, 4453-4488 (2011).
- Walcarius, A., Minteer, S. h. D., Wang, J., Yu, L., Merkoçi, A. Nanomaterials for Bio-Functionalized Electrodes: Recent Trends. J. Mater. Chem. B. 1, 4878-4908 (2013).
- Kim, J., et al. Applications, Techniques, and Microfluidic Interfacing for Nanoscale Biosensing. Microfluid. Nanofluid. 7, 149-167 (2009).
- Rassaei, L., Singh, P. S., Lemay, S. G. Lithography-Based Nanoelectrochemistry. Anal. Chem. 83, 3974-3980 (2011).
- Wong, L. S., Khan, F., Micklefield, J. Selective Covalent Protein Immobilization: Strategies and Applications. Chem. Rev. 109, 4025-4053 (2009).
- Ley, C., Holtmann, D., Mangold, K. -. M., Schrader, J. Immobilization of Histidine-Tagged Proteins on Electrodes. Colloids and Surfaces B: Biointerfaces. 88, 539-551 (2011).
- Kim, D., Herr, A. E. Protein Immobilization Techniques for Microfluidic Assays. Biomicrofluidics. 7, 041501 (2013).
- Anker, J. N., Hall, W. P., Lyandres, O., Shah, N. C., Xhao, J., Van Duyne, R. P. Biosensing with Plasmonic Nanosensors. Nature Materials. 7, 442-453 (2008).
- Bantz, K. C., et al. Recent Progress in SERS Biosensing. Phys.Chem. 13, 11551-11567 (2011).
- Sharma, B., Frontiera, R. R., Henry, A. -. I., Ringe, E., Van Duyne, R. P. SERS: Materials, Applications, and the Future. Mater. Today. 15, 16-25 (2012).
- Kleinman, S. L., Frontiera, R. R., Henry, A. -. I., Dieringer, J. A., Van Duyne, R. P. Creating, Characterizing, and Controlling Chemistry with SERS Hot Spots. Phys.Chem.Chem.Phys. 15, 21-36 (2013).
- Fan, M., Andrade, F. S., Brolo, A. G. A Review on the Fabrication of Substrates for Surface Enhanced Raman Spectroscopy and their Applications in Analytical Chemistry. Anal. Chim. Acta. 693, 7-25 (2011).
- Cao, Y., Li, D., Jiang, F., Yang, Y., Zh, H. Engineering Metal Nanostructure for SERS Application. J. Nanomater. 123812, 1-12 (2013).
- Glembocki, O., Rendell, R., Alexson, D., Prokes, S., Fu, A., Mastro, M. Dielectric-Substrate-Induced Surface-Enhanced Raman Scattering. Phys. Rev. B. 80, 085416 (2009).
- Merlen, A., et al. Surface Enhanced Spectroscopy with Gold Nanostructures on Silicon and Glass Substrates. Surf. Sci. 605, 1214-1218 (2011).
- Muhammad, M., Buswell, S. C., Dew, S. K., Stepanova, M. Nanopatterning of PMMA on Insulating Surfaces with Various Anticharging Schemes Using 30 keV Electron Beam Lithography. J. Vac. Sci. Technol. B. 29, 06F304 (2011).
- Peters, R., Fito, T., Gutierrez-Rivera, L., Dew, S. K., Stepanova, M. Study of Multilayer Systems in Electron Beam Lithography. J. Vac. Sci. Technol. B. 31, 06F407 (2013).
- Gutierrez-Rivera, L., Peters, R., Dew, S., Stepanova, M. Application of EBL Fabricated Nanostrucutred Substrates for SERS Detection of Protein A in Aqueous Solution. J. Vac. Sci. Technol.B. 31, (2013).
- Gutierrez-Rivera, L., Peters, R., Dew, S., Stepanova, M. Surface-Enhanced Raman Spectroscopy Detection of Protein-Ligand Binding Using D-glucose and Glucose Binding Protein on Nanostructured Plasmonic Substrates. , (2014).
- Peters, R. . Fabrication and Testing of Surface-Enhanced Raman Spectroscopy Substrates for the Detection of Biomolecules [MSc Thesis]. , (2014).
- Gouda, H., Torigoe, H., Saito, A., Sato, M., Arata, Y., Shimada, I. Three-Dmensional Solution Structure of the B Domain of Staphylococcal Protein A: Comparisons of the Solution and Crystal Structures. Biochemistry. 31, 9665-9672 (1992).
- Cuneo, M. J., Johnson, S. J., Beese, L. S., Hellinga, H. W. High Resolution Structure of E. Coli Glucose/Galactose Binding Protein Bound with Glucose. Research Collaboratory for Structural Bioinformatics (RCSB) Protein Data Bank. , (2009).
- Humphrey, W., Dalke, A., Schulten, K. VMD – Visual Molecular Dynamics. J. Molec. Graphics. 14, 33-38 (1996).
- Walsh, R., DeRosa, M. C. Retention of Function in the DNA Homolog of the RNA Dopamine Aptamer. Biochem. Biophys. Res. Comm. 388, 732-735 (2009).
- Akitomi, J., Kato, S., Yoshida, Y., Horii, K., Furuich, M., Waga, I. ValFold: Program for the Aptamer Truncation Process. Biomed. Inf. 7, 38-40 (2011).
- Han, K., Lee, Y., Kim, W. PseudoViewer: Automatic Visualization of RNA Pseudoknots. Bioinformatics. 18, S321-S327 (2002).
- Dwyer, M. A., Hellinga, H. W. Periplasmic Binding Proteins: a Versatile Superfamily for Protein Engineering. Curr. Opin. Struct. Biol. 14, 495-504 (2004).
- Benson, D. E., Conrad, D. W. Design of Bioelectronic Interfaces by Exploiting Hinge-Bending Motions in Proteins. Science. 293, 1641-1644 (2001).
- Bozic, S., Chorzempa, J. . Pirahna Cleaning. , (2011).
- Mohammad, M. A. Raith 150TWO SOP. , (2011).
- Schmidt, M. W., et al. General Atomic and Molecular Electronic Structure System. J. Comput. Chem. 14, 1347-1363 (1993).
- Bode, B. M., Gordon, M. S. MacMolPlt: a Graphical User Interface for GAMESS. J. of Mol. Graph. Mod. 16, 133-138 (1998).
- Bright, A., Devi, T. S. R., Gunasekaran, S. Spectroscopical Vibrational Band Assignment and Qualitative Analysis of Biomedical Compounds with Cardiovascular Activity. Int. J. Chem. Tech. Res. 2, 379-388 (2010).
- Bandekar, J. Amide Modes and Protein Conformation. Biochim. Biophys. Acta. 1120, 123-243 (1992).
- Barth, A., Zscherp, C. What Vibrations Tell About Proteins. Quarterly Reviews of Biophysics. 35, 369-340 (2002).
- Chrimes, A. F., Khoshmanesh, K. h., Stoddart, P. R. M. i. t. c. h. e. l. l. A., Kalantar-Zadeh, K. Microfluidics and Raman Microscopy: Current Applications and Future Challenges. Chem. Soc. Rev. 42, 5880-5906 (2013).
- Park, S. -. K., Lee, N. -. S., Lee, S. -. H. Vibrational Analysis of Dopamine Neutral Base based on Density Functional Force Field. Bull.-Korean Chem. Soc. 21, 959-968 (2000).
- Briand, E., Salmain, M., Compère, C., Pradier, C. M. Immobilization of Protein A on SAMs for the elaboration of immunosensors. Coll. Surf. B: Biointerfaces. 53, 215-224 (2006).
- Lakowicz, L. R., et al. Radiative decay engineering: 2. Effects of Silver Island Films on Fluorescence Intensity, Lifetimes, and Resonance Energy Transfer. Analytical biochemistry. 301, 261-277 (2002).

