Bestemmelse af Zeta Potentielle via Nanopartikel Translokation Hastigheder gennem en Tunable nanopore: Brug af DNA-modificerede Partikler som eksempel
Summary
Her bruger vi en polyurethan afstemmelig nanopore integreret i en resistiv puls sensing teknik til at karakterisere nanopartikler overfladekemi via målingen af partikel- translokation hastigheder, som kan anvendes til at bestemme zetapotentialet af individuelle nanopartikler.
Abstract
Nanopore teknologier, kendt kollektivt som Resistive Pulse sensorer (RPS), bliver brugt til at påvise, kvantificere og karakterisere proteiner, molekyler og nanopartikler. Tunable resistiv puls sensing (TRP) er en forholdsvis ny tilpasning til RPS, der inkorporerer en afstemmelig pore, der kan ændres i realtid. Her, bruger vi TRP at overvåge translokation tider af DNA-modificerede nanopartikler, når de krydser den afstembare pore membran som en funktion af DNA-koncentrationen og struktur (dvs. enkeltstrenget til dobbeltstrenget DNA).
TRP er baseret på to Ag / AgCl elektroder, adskilt af en elastomer pore membran, der etablerer en stabil ionstrømmen på en påført elektrisk felt. I modsætning til forskellige optiske-baserede partikel karakterisering teknologier, kan TRP karakterisere enkelte partikler blandt en stikprøve, der giver mulighed for multimodale prøver, der skal analyseres med lethed. Her viser vi Zetapotential målingervia partikel translokation hastigheder af kendte standarder og anvende disse til prøveanalyt translokation gange, hvilket resulterer i at måle zetapotentialet af disse analytter.
Samt erhvervelse middelværdier Zetapotential værdier prøverne alle målt ved anvendelse af en partikel-by-partikel perspektiv udviser mere information om en given prøve gennem prøven populationsfordelinger, f.eks. Af sådan, denne metode viser potentiale inden for sensing applikationer til både medicinske og miljømæssige område.
Introduction
Funktionaliserede nanopartikler bliver stadig mere populære som biosensorer i både medicinske og miljømæssige område. Evnen til at ændre en nanopartikel overflade kemi, med DNA, for eksempel, har vist sig nyttig til målrettet lægemiddelafgivelsessystemer 1 og overvågning DNA-protein-interaktioner 2-4. En stadig mere almindelig nanopartikel ejendom udnyttes i bioassays og i leveringen af terapi er superparamagnetisme 5. Superparamagnetiske partikler (SPPS) er særdeles nyttige i at identificere og fjerne specifikke analytter fra komplekse blandinger og kan gøre det med den simple brug af en enkelt magnet. Når fjernet, de analyt-bundne partikler kan karakteriseres og analyseres egnet til formålet.
Tidligere metoder til påvisning og karakterisering af nanopartikler omfatter optiske teknikker såsom dynamisk lysspredning (DLS), også kendt som fotonkorrelationsspektroskopi. Selv om en high throughput teknik, er DLS begrænset til at være en gennemsnitsberegning baseret teknik og ved analysering multimodale prøver uden tilsætning af specialiseret software, vil de større partikler producere en langt mere dominerende signal, efterlader nogle af de mindre partikler helt ubemærket 6,7. Partikel-by-partikel karakteriseringsteknikker er derfor meget mere gunstigt at analysere nanopartikler og funktionaliserede nanopartikel-systemer.
RPS baserede teknologier er baseret omkring påføring af et elektrisk felt til en prøve og kontrol transportmekanismen af partiklerne gennem en syntetisk eller biologisk nanopore. En forholdsvis ny nanopartikel påvisning og karakterisering teknik baseret på RPS er justerbar resistiv puls sensing (TRP) 8-16. TRP er en to-elektrodesystem adskilt af en elastomer, afstemmelige pore membran. Afstemmelig pore fremgangsmåde muliggør analytter af en række af form 17 og størrelse, der skal måles via deres transport mekanismer gennem poren. Afstemmelige porer er tidligere blevet anvendt til påvisning af små partikler (70-95 nm diameter) producerer sammenlignelige resultater til andre teknikker, såsom transmissionselektronmikroskopi spektroskopi (TEM) 10. Når et elektrisk felt anvendes, er en ionisk strøm observeret og som partikler / molekyler passere gennem poren, de midlertidigt blokere pore, hvilket medfører en reduktion i strøm, der kan defineres som en "blokade begivenhed«. Hver blokade begivenhed repræsenterer en enkelt partikel, således at hver partikel i en prøve kan karakteriseres individuelt på basis af blokaden størrelsesorden, Δ 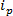 Og fuld bredde halvt maksimum, FWHM, samt andre blokade egenskaber. Analysere individuelle partikler, når de passerer gennem en nanopore er fordelagtig til multimodale prøver som TRP succes og effektivt kan skelne en række partikelstørrelser amonGST en enkelt prøve. Tunable resistiv puls sensing fuldender størrelse 10, Zetapotential 12,18 og koncentration 15 målinger samtidig i en enkelt kørsel og kan derfor stadig skelne prøver af tilsvarende, hvis ikke den samme størrelse ved deres overfladeladning 19; en fordel i forhold alternative dimensionering teknikker.
Og fuld bredde halvt maksimum, FWHM, samt andre blokade egenskaber. Analysere individuelle partikler, når de passerer gennem en nanopore er fordelagtig til multimodale prøver som TRP succes og effektivt kan skelne en række partikelstørrelser amonGST en enkelt prøve. Tunable resistiv puls sensing fuldender størrelse 10, Zetapotential 12,18 og koncentration 15 målinger samtidig i en enkelt kørsel og kan derfor stadig skelne prøver af tilsvarende, hvis ikke den samme størrelse ved deres overfladeladning 19; en fordel i forhold alternative dimensionering teknikker.
Zeta potentiale defineres som det elektrostatiske potentiale på planet af shear 20, og beregnes ud fra partikelhastigheder, når de krydser en pore 19. Zeta potentielle målinger af de enkelte partikler giver således indsigt i de translokation mekanismer og adfærd nanopartikler systemer i opløsning, værdifulde oplysninger for fremtiden for nanopartikel assay design til en række applikationer. Partikel-by-partikel analyse af en sådan art giver også mulighed for udbredelsen og fordelingen af zeta potentielle værdier blandt en stikprøve befolkningen til at blive udforsket, giver mulighed for mere information on reaktionskinetik (single-strandede til dobbeltstrenget DNA, for eksempel) og partikel stabiliteter i opløsning, der skal nås.
Her beskriver vi en teknik, der detekterer og karakteriserer både umodificerede og DNA-modificeret SPP overflader. Den heri beskrevne protokol for en række uorganiske og biologiske nanopartikler, men vi vise proceduren ved anvendelse af DNA-modificerede overflader på grund af deres brede vifte af anvendelser. Teknikken tillader brugeren at skelne mellem enkeltstrengede og dobbeltstrengede DNA-mål på en nanopartikel overflade, baseret på partikel translokation hastigheder gennem et poresystem og dermed deres zeta potentialer.
Protocol
Representative Results
Discussion
Beregningen for zetapotentialet anvendes en kalibrering baseret metode relateret til arbejde ved Arjmandi et al. 21. Varigheden af translokationen af partikler, når de krydser en nanopore måles som en funktion af påtrykt spænding, ved hjælp af en gennemsnitlig elektriske felt og partikelhastigheder priserne i hele en regelmæssig konisk pore. Den elektroforetiske mobilitet er differentialkvotienten af 1 / T (hvor T er blokaden varighed) med hensyn til spænding multipliceret me…
Disclosures
The authors have nothing to disclose.
Acknowledgements
Forfatterne takker Izon Science Ltd for deres støtte. Arbejdet blev støttet af Europa-Kommissionen for forskning (PCIG11-GA-2012 til 321.836 Nano4Bio).
Materials
| Phosphate buffered Saline (PBS) | Sigma Aldrich, UK | P4417 | 1 tablet dissolved in 200 mL deionised water to make buffer solution. |
| Tween-20 | Sigma Aldrich, UK | P1379 | 0.05% (v/v) in PBS buffer as a surfactant |
| Carboxyl polystyrene nanoparticles | Bangs Laboratories, US | CPC200 | Nominal diamter of 220 nm, raw concentration of 1E12 particles/mL, specific surface charge of 86 µeq/g (equivalent to a surface charge density of 3.2E19 C/nm^2. |
| Streptavidin coated nanoparticles | Ademtech, France | 3121 | Batch had binding capacity of 4352 pmol/mg (188 nM theoretical DNA binding capacity) at a raw concentration of 1.1E11 particles/mL. |
| Biotinylated oligonucleotides | Sigma Aldrich, UK | VC00001 | Supplier spec: Reverse Phase 1 purification (0.05 Scale); Biotin modification at 3' end; Lyophilised powders reconstituted to 100 µM using deionised water, and diluted as required. Sequences: CP 5'ATGGTTAAACCTCAC TACGCGTGGC[Btn]3' |
| Standard olignonucleotides | Sigma Aldrich, UK | VC00001 | Supplier spec: Reverse Phase 1 purification (0.05 Scale); Lyophilised powders reconstituted to 100 µM using deionised water, and diluted as required. Sequences of DNA targets: Fully complementary – 5'GCCACGCGTAGTGAGGTTTAACCAT3', Middle binding – 5'GTAGTGAGGT3', End binding – 5'GTTTAACCAT3', Partially complementary overhanging – 5'GTGAGGTTTAACCAT TTTTTTTTTTTTTTT3'. |
| Izon qNano | Izon Science, NZ | Inherent pressure on system of 47 Pa, | |
| Izon Variable Pressure Module (VPM) | Izon Science, NZ | Each 'cm' of pressure is equivalent to approximately 1000 Pa. | |
| Polyurethane nanopore membranes | Izon Science, NZ | NP150 | Analyte size range 60-480 nm, pore diameter of calculated to be 799 nm at a 45 mm stretch. |
| Magrack 6 | GE Healthcare, UK | 28-9489-64 | |
| Sonic Bath | Fisher Scientific, UK | 10692353 | 80 Watts |
| Vortexer | IKA, Germany | 0003365000 | |
| Rotary Wheel | Labnet International, US | H5500-230 V |
References
- Alexander, C. M., Maye, M. M., Dabrowiak, J. C. DNA-capped nanoparticles designed for doxorubicin drug delivery. Chem Commun. 47 (12), 3418-3420 (2011).
- Billinge, E. R., Platt, M. Aptamer based dispersion assay using tunable resistive pulse sensing (TRPS). Anal Methods. 7 (20), 8534-8538 (2015).
- Bulyk, M. L. Protein Binding Microarrays for the Characterization of Protein-DNA Interactions. Adv Biochem Eng Biotechnol. 104, 65-85 (2007).
- Platt, M., Rowe, W., Knowles, J., Day, P. J., Kell, D. B. Analysis of aptamer sequence activity relationships. Integr Biol. 1 (1), 116-122 (2009).
- Ruiz-Hernández, E., Baeza, A., Vallet-Regí, M. Smart Drug Delivery through DNA/Magnetic Nanoparticle Gates. ACS Nano. 5 (2), 1259-1266 (2011).
- Murdock, R. C., Braydich-stolle, L., Schrand, A. M., Schlager, J. J., Hussain, S. M. Characterization of Nanomaterial Dispersion in Solution Prior to In Vitro Exposure Using Dynamic Light Scattering Technique. Toxicol Sci. 101 (2), 239-253 (2008).
- Hupfield, S., Holsaeter, A. M., Skar, M., Frantzen, C. B., Brandl, M. Liposome size analysis by dynamic/static light scattering upon size exclusion-/field flow fractionation. J Nanosci Nanotechnol. 6 (7), 3025-3031 (2006).
- Roberts, G. S., et al. Tunable pores for measuring concentrations of synthetic and biological nanoparticle dispersions. Biosens Bioelectron. 31 (1), 17-25 (2012).
- Roberts, G. S., Kozak, D., Anderson, W., Broom, M. F., Vogel, R., Trau, M. Tunable nano/micropores for particle detection and discrimination: scanning ion occlusion spectroscopy. Small. 6 (23), 2653-2658 (2010).
- Vogel, R., et al. Quantitative sizing of nano/microparticles with a tunable elastomeric pore sensor. Anal Chem. 83 (9), 3499-3506 (2011).
- Booth, M. A., Vogel, R., Curran, J. M., Harbison, S., Travas-Sejdic, J. Detection of target-probe oligonucleotide hybridization using synthetic nanopore resistive pulse sensing. Biosens Bioelectron. 45, 136-140 (2013).
- Kozak, D., Anderson, W., Vogel, R., Chen, S. Simultaneous size and ζ-potential measurements of individual nanoparticles in dispersion using size-tunable pore sensors. ACS Nano. 6 (8), 6990-6997 (2012).
- Kozak, D., Anderson, W., Vogel, R., Trau, M. Advances in Resistive Pulse Sensors: Devices bridging the void between molecular and microscopic detection. Nano Today. 6 (5), 531-545 (2011).
- Weatherall, E., Willmott, G. R. Applications of tunable resistive pulse sensing. Analyst. 140, 3318-3334 (2015).
- Willmott, G. R., et al. Use of tunable nanopore blockade rates to investigate colloidal dispersions. J Phys Condens Matter. 22 (45), 454116 (2010).
- Blundell, E. L. C. J., Mayne, L. J., Billinge, E. R., Platt, M. Emergence of tunable resistive pulse sensing as a biosensor. Anal Methods. 7, 7055-7066 (2015).
- Platt, M., Willmott, G. R., Lee, G. U. Resistive Pulse Sensing of Analyte-Induced Multicomponent Rod Aggregation Using Tunable Pores. Small. 8 (15), 2436-2444 (2012).
- Vogel, R., Anderson, W., Eldridge, J., Glossop, B., Willmott, G. A variable pressure method for characterizing nanoparticle surface charge using pore sensors. Anal Chem. 84 (7), 3125-3131 (2012).
- Blundell, E. L. C. J., Vogel, R., Platt, M. Particle-by-Particle Charge Analysis of DNA-Modified Nanoparticles Using Tunable Resistive Pulse Sensing. Langmuir. 32 (4), (2016).
- Hunter, R. J. . Zeta Potential in Colloid Science: Principles and Applications. , (1981).
- Arjmandi, N., Van Roy, W., Lagae, L., Borghs, G. Measuring the electric charge and zeta potential of nanometer-sized objects using pyramidal-shaped nanopores. Anal Chem. 84 (20), 8490-8496 (2012).
- Bacri, L., et al. Dynamics of colloids in single solid-state nanopores. J Phys Chem B. 115 (12), 2890-2898 (2011).
- Cabello-Aguilar, S., et al. Dynamics of polymer nanoparticles through a single artificial nanopore with a high-aspect-ratio. Soft Matter. 10 (42), 8413-8419 (2014).
- Billinge, E. R., Muzard, J., Platt, M. Tunable resistive pulse sensing as a tool to monitor analyte induced particle aggregation. Nanomater Nanosci. 1 (1), 11 (2013).
- Li, J., Fan, C., Pei, H., Shi, J., Huang, Q. Smart Drug Delivery Nanocarriers with Self-Assembled DNA Nanostructures. Adv Mater. 25 (32), 4386-4396 (2013).
- Billinge, E. R., Broom, M., Platt, M. Monitoring aptamer-protein interactions using tunable resistive pulse sensing. Anal Chem. 86 (2), 1030-1037 (2014).
- Gold, L., et al. Aptamer-Based Multiplexed Proteomic Technology for Biomarker Discovery. PLoS One. 5 (12), e15004 (2010).
- Park, S. -. J., Taton, T. A., Mirkin, C. A. Array-Based Electrical Detection of DNA with Nanoparticle Probes. Science. 295 (5559), 1503-1506 (2002).

