Determinação do Potencial Zeta de nanopartículas de translocação através de velocidades por meio de um Tunable Nanopore: Utilizando partículas modificadas-ADN como um Exemplo
Summary
Aqui usamos um nanoporo sintonizável poliuretano integrados em uma técnica de detecção de impulsos resistiva para caracterizar nanopartículas química da superfície por meio da medição das velocidades das partículas de translocação, que pode ser usado para determinar o potencial Zeta de nanopartículas individuais.
Abstract
tecnologias Nanopore, conhecidos coletivamente como resistivas sensores de pulso (RPS), estão sendo usados para detectar, quantificar e caracterizar proteínas, moléculas e nanopartículas. detecção de impulsos resistiva ajustável (TRPS) é uma adaptação relativamente recente de RPS que incorpora uma poro sintonizável que pode ser alterada em tempo real. Aqui, nós utilizamos TRPS para monitorar os tempos de translocação de nanopartículas de ADN-modificado, enquanto atravessam a membrana de poro sintonizável como uma função da concentração de DNA e da estrutura (ou seja, de cadeia simples ao ADN de cadeia dupla).
TRPS baseia-se em dois eléctrodos de Ag / AgCl, separados por uma membrana de poros elastomérico que estabelece uma corrente iónica estável sobre um campo eléctrico aplicado. Ao contrário de várias tecnologias de caracterização de partículas ópticos à base, TRPS pode caracterizar partículas individuais entre uma amostra da população, permitindo amostras multimodais a ser analisado com facilidade. Aqui, demonstramos medidas de potencial zetavia velocidades de partículas de translocação de padrões conhecidos e aplicá-las a experimentar momentos de translocação de analitos, resultando assim na medição do potencial zeta dos analitos.
Bem como a aquisição de valores de potencial zeta médios, as amostras são todos medidos usando uma perspectiva de partícula-a-partícula exibindo mais informações sobre uma dada amostra através de distribuições população de amostra, por exemplo. De tal, este método demonstra potencial dentro de aplicações de detecção para ambos os campos médicos e ambientais.
Introduction
nanopartículas funcionalizadas estão se tornando cada vez mais popular como biossensores em ambos os campos médicos e ambientais. A capacidade de alterar a química de superfície de uma nanopartícula, com o DNA, por exemplo, está a revelar útil para sistemas de distribuição de drogas-alvo 1, o controlo interações DNA-proteína 2-4. Uma propriedade cada vez mais comum de nanopartículas sendo utilizado em bioensaios e na entrega de agentes terapêuticos é superparamagnetismo 5. partículas superparamagnéticas (SPPS) são extremamente úteis na identificação e remoção de analitos específicos a partir de misturas complexas e podem fazê-lo com o simples uso de um único íman. Uma vez removido, as partículas ligadas a analitos podem ser caracterizados e analisados apto para o efeito.
Os métodos anteriores utilizados para a detecção e caracterização de nanopartículas incluem técnicas ópticas, tais como dispersão de luz dinâmica (DLS), também conhecido como espectroscopia de correlação de fotões. Embora um oitécnica de transferência de GH, DLS está limitado a ser uma técnica de base média e ao analisar amostras multimodais, sem a adição de software especializado, as partículas maiores irão produzir um sinal muito mais dominante, deixando algumas das partículas menores completamente despercebido 6,7. Partícula-a-partícula técnicas de caracterização são, portanto, muito mais favorável para analisar sistemas de nanopartículas funcionalizadas de nanopartículas e.
tecnologias baseadas RPS se baseiam em torno da aplicação de um campo eléctrico a uma amostra e de controlo do mecanismo de transporte das partículas através de um nanoporo sintético ou biológico. Uma técnica relativamente recente detecção de nanopartículas e caracterização com base em RPS é resistiva ajustável sensor de pulso (TRPS) 8-16. TRPS é um sistema de dois eléctrodos separados por uma membrana de poros elastomérico, sintonizável. Um método de poro sintonizável permite a analitos de uma gama de 17 forma e tamanho para ser medido através do seu transmecanismos de portas através do poro. Poros sintonizáveis foram anteriormente utilizados para a detecção de partículas pequenas (70-95 nm de diâmetro) produzir resultados comparáveis a outras técnicas, tais como a espectroscopia electrónica de transmissão (MET) 10. Quando um campo eléctrico é aplicado, uma corrente iónica é observada e medida que as partículas / moléculas de passar através do poro, eles bloqueiam temporariamente os poros, causando uma redução da corrente que pode ser definido como um "evento de bloqueio '. Cada evento de bloqueio é representativa de uma única partícula, para que cada partícula dentro de uma amostra pode ser caracterizado com base na magnitude individualmente bloqueio, Δ 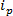 E largura a meia-máxima, FWHM, bem como outras propriedades de bloqueio. Analisando as partículas individuais que passam através de um nanoporo é vantajosa para amostras multimodais como TRPS pode com sucesso e eficazmente distinguir uma gama de tamanhos de partículas amonGST de uma única amostra. Sensor de pulso resistiva ajustável completa tamanho 10, Potencial Zeta 12,18 e concentração 15 medições simultaneamente em uma única corrida e, portanto, ainda pode diferenciar amostras de semelhante, se não o mesmo tamanho de sua carga de superfície 19; uma vantagem sobre as técnicas de dimensionamento alternativos.
E largura a meia-máxima, FWHM, bem como outras propriedades de bloqueio. Analisando as partículas individuais que passam através de um nanoporo é vantajosa para amostras multimodais como TRPS pode com sucesso e eficazmente distinguir uma gama de tamanhos de partículas amonGST de uma única amostra. Sensor de pulso resistiva ajustável completa tamanho 10, Potencial Zeta 12,18 e concentração 15 medições simultaneamente em uma única corrida e, portanto, ainda pode diferenciar amostras de semelhante, se não o mesmo tamanho de sua carga de superfície 19; uma vantagem sobre as técnicas de dimensionamento alternativos.
O potencial zeta é definido como o potencial electrostático no plano de corte 20, e é calculada a partir de velocidades das partículas, enquanto atravessam um poro 19. as medições do potencial zeta das partículas individuais, assim, dá conhecimento sobre os mecanismos de translocação e o comportamento dos sistemas de nanopartículas em solução, a informação valiosa para futuro ensaio de modelos de partículas para uma gama de aplicações. análise de partículas-a-partícula de tal natureza também permite a propagação e distribuição de valores de potencial zeta entre uma amostra da população a ser explorado, permitindo a mais informaçãocinética de reacção de N (de cadeia simples ao ADN de cadeia dupla, por exemplo) e estabilidades das partículas na solução a ser atingido.
Aqui, descrevemos uma técnica que detecta e caracteriza ambas as superfícies SPP não modificados e modificados-DNA. O protocolo aqui descrito é aplicável a uma variedade de nanopartículas inorgânicas e biológicos, mas que demonstram o procedimento usando superfícies modificadas-ADN devido à sua ampla gama de aplicações. A técnica permite que o utilizador para distinguir entre alvos de ADN de cadeia simples e de cadeia dupla numa superfície de nanopartículas, baseado em velocidades das partículas de translocação através de um sistema de poros e, consequentemente, os seus potenciais zeta.
Protocol
Representative Results
Discussion
O cálculo do potencial zeta usado um método baseado calibração relacionados ao trabalho por Arjmandi et al. 21. A duração da translocação de partículas, enquanto atravessam um nanoporo é medida como uma função da tensão aplicada, utilizando um campo médio de partícula e velocidades eléctricos sobre a totalidade de uma poro cónica regular. A mobilidade electroforética é o derivado de 1 / T (em que T é a duração do bloqueio) em relação à tensão, multiplicado pelo quadrad…
Disclosures
The authors have nothing to disclose.
Acknowledgements
Os autores agradecem Izon Ciência Ltd por seu apoio. O trabalho foi apoiado pela Comissão Europeia para a Investigação (PCIG11-GA-2012-321836 Nano4Bio).
Materials
| Phosphate buffered Saline (PBS) | Sigma Aldrich, UK | P4417 | 1 tablet dissolved in 200 mL deionised water to make buffer solution. |
| Tween-20 | Sigma Aldrich, UK | P1379 | 0.05% (v/v) in PBS buffer as a surfactant |
| Carboxyl polystyrene nanoparticles | Bangs Laboratories, US | CPC200 | Nominal diamter of 220 nm, raw concentration of 1E12 particles/mL, specific surface charge of 86 µeq/g (equivalent to a surface charge density of 3.2E19 C/nm^2. |
| Streptavidin coated nanoparticles | Ademtech, France | 3121 | Batch had binding capacity of 4352 pmol/mg (188 nM theoretical DNA binding capacity) at a raw concentration of 1.1E11 particles/mL. |
| Biotinylated oligonucleotides | Sigma Aldrich, UK | VC00001 | Supplier spec: Reverse Phase 1 purification (0.05 Scale); Biotin modification at 3' end; Lyophilised powders reconstituted to 100 µM using deionised water, and diluted as required. Sequences: CP 5'ATGGTTAAACCTCAC TACGCGTGGC[Btn]3' |
| Standard olignonucleotides | Sigma Aldrich, UK | VC00001 | Supplier spec: Reverse Phase 1 purification (0.05 Scale); Lyophilised powders reconstituted to 100 µM using deionised water, and diluted as required. Sequences of DNA targets: Fully complementary – 5'GCCACGCGTAGTGAGGTTTAACCAT3', Middle binding – 5'GTAGTGAGGT3', End binding – 5'GTTTAACCAT3', Partially complementary overhanging – 5'GTGAGGTTTAACCAT TTTTTTTTTTTTTTT3'. |
| Izon qNano | Izon Science, NZ | Inherent pressure on system of 47 Pa, | |
| Izon Variable Pressure Module (VPM) | Izon Science, NZ | Each 'cm' of pressure is equivalent to approximately 1000 Pa. | |
| Polyurethane nanopore membranes | Izon Science, NZ | NP150 | Analyte size range 60-480 nm, pore diameter of calculated to be 799 nm at a 45 mm stretch. |
| Magrack 6 | GE Healthcare, UK | 28-9489-64 | |
| Sonic Bath | Fisher Scientific, UK | 10692353 | 80 Watts |
| Vortexer | IKA, Germany | 0003365000 | |
| Rotary Wheel | Labnet International, US | H5500-230 V |
References
- Alexander, C. M., Maye, M. M., Dabrowiak, J. C. DNA-capped nanoparticles designed for doxorubicin drug delivery. Chem Commun. 47 (12), 3418-3420 (2011).
- Billinge, E. R., Platt, M. Aptamer based dispersion assay using tunable resistive pulse sensing (TRPS). Anal Methods. 7 (20), 8534-8538 (2015).
- Bulyk, M. L. Protein Binding Microarrays for the Characterization of Protein-DNA Interactions. Adv Biochem Eng Biotechnol. 104, 65-85 (2007).
- Platt, M., Rowe, W., Knowles, J., Day, P. J., Kell, D. B. Analysis of aptamer sequence activity relationships. Integr Biol. 1 (1), 116-122 (2009).
- Ruiz-Hernández, E., Baeza, A., Vallet-Regí, M. Smart Drug Delivery through DNA/Magnetic Nanoparticle Gates. ACS Nano. 5 (2), 1259-1266 (2011).
- Murdock, R. C., Braydich-stolle, L., Schrand, A. M., Schlager, J. J., Hussain, S. M. Characterization of Nanomaterial Dispersion in Solution Prior to In Vitro Exposure Using Dynamic Light Scattering Technique. Toxicol Sci. 101 (2), 239-253 (2008).
- Hupfield, S., Holsaeter, A. M., Skar, M., Frantzen, C. B., Brandl, M. Liposome size analysis by dynamic/static light scattering upon size exclusion-/field flow fractionation. J Nanosci Nanotechnol. 6 (7), 3025-3031 (2006).
- Roberts, G. S., et al. Tunable pores for measuring concentrations of synthetic and biological nanoparticle dispersions. Biosens Bioelectron. 31 (1), 17-25 (2012).
- Roberts, G. S., Kozak, D., Anderson, W., Broom, M. F., Vogel, R., Trau, M. Tunable nano/micropores for particle detection and discrimination: scanning ion occlusion spectroscopy. Small. 6 (23), 2653-2658 (2010).
- Vogel, R., et al. Quantitative sizing of nano/microparticles with a tunable elastomeric pore sensor. Anal Chem. 83 (9), 3499-3506 (2011).
- Booth, M. A., Vogel, R., Curran, J. M., Harbison, S., Travas-Sejdic, J. Detection of target-probe oligonucleotide hybridization using synthetic nanopore resistive pulse sensing. Biosens Bioelectron. 45, 136-140 (2013).
- Kozak, D., Anderson, W., Vogel, R., Chen, S. Simultaneous size and ζ-potential measurements of individual nanoparticles in dispersion using size-tunable pore sensors. ACS Nano. 6 (8), 6990-6997 (2012).
- Kozak, D., Anderson, W., Vogel, R., Trau, M. Advances in Resistive Pulse Sensors: Devices bridging the void between molecular and microscopic detection. Nano Today. 6 (5), 531-545 (2011).
- Weatherall, E., Willmott, G. R. Applications of tunable resistive pulse sensing. Analyst. 140, 3318-3334 (2015).
- Willmott, G. R., et al. Use of tunable nanopore blockade rates to investigate colloidal dispersions. J Phys Condens Matter. 22 (45), 454116 (2010).
- Blundell, E. L. C. J., Mayne, L. J., Billinge, E. R., Platt, M. Emergence of tunable resistive pulse sensing as a biosensor. Anal Methods. 7, 7055-7066 (2015).
- Platt, M., Willmott, G. R., Lee, G. U. Resistive Pulse Sensing of Analyte-Induced Multicomponent Rod Aggregation Using Tunable Pores. Small. 8 (15), 2436-2444 (2012).
- Vogel, R., Anderson, W., Eldridge, J., Glossop, B., Willmott, G. A variable pressure method for characterizing nanoparticle surface charge using pore sensors. Anal Chem. 84 (7), 3125-3131 (2012).
- Blundell, E. L. C. J., Vogel, R., Platt, M. Particle-by-Particle Charge Analysis of DNA-Modified Nanoparticles Using Tunable Resistive Pulse Sensing. Langmuir. 32 (4), (2016).
- Hunter, R. J. . Zeta Potential in Colloid Science: Principles and Applications. , (1981).
- Arjmandi, N., Van Roy, W., Lagae, L., Borghs, G. Measuring the electric charge and zeta potential of nanometer-sized objects using pyramidal-shaped nanopores. Anal Chem. 84 (20), 8490-8496 (2012).
- Bacri, L., et al. Dynamics of colloids in single solid-state nanopores. J Phys Chem B. 115 (12), 2890-2898 (2011).
- Cabello-Aguilar, S., et al. Dynamics of polymer nanoparticles through a single artificial nanopore with a high-aspect-ratio. Soft Matter. 10 (42), 8413-8419 (2014).
- Billinge, E. R., Muzard, J., Platt, M. Tunable resistive pulse sensing as a tool to monitor analyte induced particle aggregation. Nanomater Nanosci. 1 (1), 11 (2013).
- Li, J., Fan, C., Pei, H., Shi, J., Huang, Q. Smart Drug Delivery Nanocarriers with Self-Assembled DNA Nanostructures. Adv Mater. 25 (32), 4386-4396 (2013).
- Billinge, E. R., Broom, M., Platt, M. Monitoring aptamer-protein interactions using tunable resistive pulse sensing. Anal Chem. 86 (2), 1030-1037 (2014).
- Gold, L., et al. Aptamer-Based Multiplexed Proteomic Technology for Biomarker Discovery. PLoS One. 5 (12), e15004 (2010).
- Park, S. -. J., Taton, T. A., Mirkin, C. A. Array-Based Electrical Detection of DNA with Nanoparticle Probes. Science. 295 (5559), 1503-1506 (2002).

