La Técnica del riñón perfundido aislado del ratón
Summary
El aislado de riñón perfundido ratón (MIPK) es una técnica para mantener un riñón de ratón bajo condiciones ex vivo perfundidos y funcionales para 1 hr. Los tampones y técnica quirúrgica se describen en detalle.
Abstract
El aislado de riñón perfundido ratón (MIPK) es una técnica para mantener un riñón de ratón bajo condiciones ex vivo perfundidos y funcionales para 1 hr. Este es un requisito previo para el estudio de la fisiología del órgano aislado y para muchas aplicaciones innovadoras que pueden ser posibles en el futuro, incluyendo descelularización la perfusión de bioingeniería renal o la administración de anti-rechazo o drogas genoma de edición en altas dosis para cebar el riñón para el trasplante. Durante el tiempo de la perfusión, el riñón puede ser manipulado, la función renal puede ser evaluada, y diversos productos farmacéuticos administrado. Después del procedimiento, el riñón puede ser trasplantado o tratados con la biología molecular, análisis bioquímicos, o microscopía.
Este artículo describe el líquido de perfusión y la técnica quirúrgica necesaria para la perfusión ex vivo de los riñones de ratones. Los detalles del aparato de perfusión y se dan los datos se presentan mostrando la vESPONSABILIDAD de la preparación del riñón: el flujo sanguíneo renal, la resistencia vascular, y de orina de datos como, micrografías electrónicas de transmisión funcionales de los diferentes segmentos de la nefrona como lecturas morfológicas, y transferencias Western de las proteínas de transporte de los diferentes segmentos de la nefrona como lectura molecular.
Introduction
La perfusión aislada de órganos ha sido objeto de un esfuerzo continuo entre los fisiólogos durante muchas décadas 1. La técnica permite la función del órgano, sin influencias sistémicas como la hipertensión arterial, las hormonas, o los nervios, para ser estudiado. Carl Eduard Loebell se considera que es el primero que ha descrito la perfusión con éxito de un riñón aislado, en 1849 2. Desde entonces, el aparato de perfusión ha sufrido refinamiento significativo. Frey y Gruber introdujeron un pulmón artificial para las bombas de oxigenación y perfusión continua para pulsátiles 2. Mientras que los primeros investigadores estudiaron principalmente los riñones de los mamíferos grandes, a saber, cerdos y perros 2 3 -el primer informe del uso de riñones de rata, por Weiss et al. , Fue un hito en el estudio de la perfusión de los órganos mamífero pequeño 4. Schurek et al. informaron la necesidad de la adición de eritrocitos de mamíferos al perfundido si tubular renal suficienteoxigenación debía lograrse 5. Crítico para experimentos a largo plazo fue la introducción de la diálisis continua de la memoria intermedia por el mismo grupo de investigación 6. En 2003, Schweda et al. fueron los primeros en informar de un riñón aislado perfundido funcional del ratón (MIPK) 7, posteriormente refinado por Rahgozar et al. 18 y Lindell et al. 14.
Aunque técnicamente más difícil que la rata aislado y perfundido de riñón, el uso de la MIPK lleva la ventaja de permitir el uso de una amplia gama de ratones genéticamente alterados. Este artículo presenta los detalles del método de los autores de la perfusión de los riñones de ratones aislados durante 1 hora. El método permite la evaluación continua de la tasa de flujo renal, la resistencia vascular, la liberación de hormonas, el análisis de gases en sangre, análisis de orina, y la aplicación de fármacos. Después del procedimiento, los riñones podrían ser procesados para el análisis molecular y bioquímica, se fijarán para microscopía, otrasplantado en un ratón receptor (Figura 1).
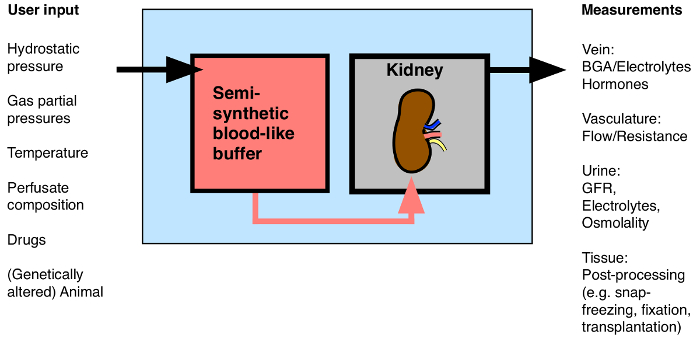
Figura 1: Visión general de la posible entrada / salida para el riñón aislado y perfundido. BGA: análisis de gases en sangre. Haga clic aquí para ver una versión más grande de esta figura.
Esta técnica es probable que reciba una atención creciente en los próximos años, ya que muchas aplicaciones innovadoras se están discutiendo con el amanecer de la perfusión renal normothermic prolongado antes del trasplante (con o sin la aplicación de anti-rechazo o drogas genoma de edición) 8, 9, 10 , 11, la bioingeniería de los riñones enteros de andamios descelularizados 12, y la aplicación de altas dosis de tintes fluorescentes para la imagen multifotónica 13 </sup>. También es un modelo ideal con el que estudiar el papel de los genes específicos durante la lesión renal aguda 14.
Un protocolo paso a paso se da para permitir que otros laboratorios para realizar la perfusión aislada de riñón de ratón con éxito. En primer lugar, se especifica la composición y preparación de la memoria intermedia. A continuación, la cirugía se describe en detalle y se muestran los pasos críticos. En tercer lugar, se presentan los datos que son representativos de una preparación exitosa: el flujo sanguíneo renal, la resistencia vascular, la tasa de filtración glomerular, y el electrolito fraccionada mediciones funcionales de micrografías de viabilidad y electrónicas de transmisión de la morfología de los diferentes segmentos de la nefrona de los riñones perfundidos todos excreción- fijo después de 1 hora de perfusión.
Protocol
Representative Results
Discussion
El ratón aislados del riñón perfundido es una herramienta para el estudio de la función renal en un ambiente controlado ex vivo durante 1 hora, reduciendo la brecha entre los experimentos in vivo en animales intactos, lo que puede ser defectuoso por el impacto de numerosos factores sistémicos, y los experimentos in vitro en segmentos de la nefrona aisladas o células cultivadas, lo que necesariamente descuidar el impacto de la estructura de los órganos intactos en la función. H…
Disclosures
The authors have nothing to disclose.
Acknowledgements
The authors would like to thank Hans-Joachim Schurek for invaluable scientific advice. The authors would like to thank Monique Carrel and Michèle Heidemeyer for excellent technical assistance, David Penton Ribas and Nourdine Faresse for a critical reading of the manuscript and Carsten Wagner and Jürg Biber for the NaPi-2a antibody. This work was supported by the Swiss National Centre for Competence in Research “Kidney.CH” and by a project grant (310030_143929/1) from the Swiss National Science Foundation.
Materials
| Perfusion Circuit: | |||
| Moist chamber 834/8 | Harvard Apparatus/Hugo Sachs Elektronik GmbH | 73-2901 | |
| Cannular with basket and side port | Harvard Apparatus/Hugo Sachs Elektronik GmbH | 73-2947 | |
| Thermostat TC120-ST5 | Harvard Apparatus/Hugo Sachs Elektronik GmbH | 73-4544 | |
| ISM 827/230V Roller Pump Reglo Analogue | Harvard Apparatus/Hugo Sachs Elektronik GmbH | 73-0114 | |
| Reservoir jacketed for buffer solution 1L | Harvard Apparatus/Hugo Sachs Elektronik GmbH | 73-3438 | |
| Reservoir jacketed for buffer solution 0.5L | Harvard Apparatus/Hugo Sachs Elektronik GmbH | 73-3436 | |
| Pressure Transducer APT300 | Harvard Apparatus/Hugo Sachs Elektronik GmbH | 73-3862 | |
| TAM-D Plugsys Transducer | Harvard Apparatus/Hugo Sachs Elektronik GmbH | 73-1793 | |
| SCP Plugsys servo controller | Harvard Apparatus/Hugo Sachs Elektronik GmbH | 73-2806 | |
| Windkessel | Harvard Apparatus/Hugo Sachs Elektronik GmbH | 73-3717 | |
| HSE-USB data acquisition | Harvard Apparatus/Hugo Sachs Elektronik GmbH | 73-3330 | |
| Low-Flux Dialysator Diacap Polysulfone | B.Braun | 7203525 | |
| PE-Tubing for aorta cannulation 1.19mm I.D. x 1.70mm O.D. | Scientific Commodities Inc. | BB31695-PE/8 | |
| Name | Company | Catalog Number | Comments |
| Buffer reagents: | |||
| Aminoplasmal 10% | B.Braun | 134518064 | |
| Sodium pyruvate | Sigma-Aldrich | P2256-25G | |
| L-Glutamic acid monosodium salt hydrate | Sigma-Aldrich | G1626-100G | |
| L-(-)-Malic acid sodium salt | Sigma-Aldrich | M1125-25G | |
| Sodium-L-Lactate | Sigma-Aldrich | L7022-10G | |
| alpha-Ketoglutaric acid sodium salt | Sigma-Aldrich | K1875-25G | |
| NaCl | Sigma-Aldrich | 31434-1KG-R | |
| NaHCO3 | Sigma-Aldrich | S5761-5KG | |
| KCl | Sigma-Aldrich | 60130-1KG | |
| Urea | Sigma-Aldrich | U5378-500G | |
| Creatinine | Sigma-Aldrich | C4255-10G | |
| Ampicillin | Roche | 10835242001 | |
| MgCl2 * 6H2O | Sigma-Aldrich | M2393-500G | |
| D-Glucose | Sigma-Aldrich | G8270-1KG | |
| CaCl2 * 6H2O | Riedel-de-Haën | 12074 | |
| NaH2PO4 | Sigma-Aldrich | S9638-500G | |
| Na2HPO4 | Sigma-Aldrich | S0876-500G | |
| Antidiuretic Hormone dDAVP | Sigma-Aldrich | V2013-1MG | |
| FITC-Inulin | Sigma-Aldrich | ||
| Filter used for erythrocyte filtration | Macherey-Nagel | MN 615 | |
| BGA Analysis: | |||
| ABL 80 flex | Radiometer Medical ApS | ||
| Electron Microscope: | |||
| Philips CM100 TEM | FEI |
References
- Carrel, A., Lindbergh, C. A. The culture of whole organs. Science (New York, N.Y.). 81 (2112), 621-623 (1935).
- Skutul, K. . Über Durchströmungsapparate Pflüger’s Archiv. 123 (4-6), 249-273 (1908).
- Nizet, A. The isolated perfused kidney: possibilities, limitations and results. Kidney Int. 7 (1), 1-11 (1975).
- Weiss, C., Passow, H., Rothstein, A. Autoregulation of flow in isolated rat kidney in the absence of red cells. Am J Physiol. 196 (5), 1115-1118 (1959).
- Schurek, H. J., Kriz, W. Morphologic and functional evidence for oxygen deficiency in the isolated perfused rat kidney. Lab Invest. 53 (2), 145-155 (1985).
- Stolte, H., Schurek, H. J., Alt, J. M. Glomerular albumin filtration: a comparison of micropuncture studies in the isolated perfused rat kidney with in vivo experimental conditions. Kidney Int. 16 (3), 377-384 (1979).
- Schweda, F., Wagner, C., Krämer, B. K., Schnermann, J., Kurtz, A. Preserved macula densa-dependent renin secretion in A1 adenosine receptor knockout mice. AJP Renal Physiol. 284 (4), F770-F777 (2003).
- Moers, C., Smits, J. M., et al. Machine perfusion or cold storage in deceased-donor kidney transplantation. N Engl J Med. 360 (1), 7-19 (2009).
- Nicholson, M. L., Hosgood, S. A. Renal transplantation after ex vivo normothermic perfusion: the first clinical study. Am J Transplant. 13 (5), 1246-1252 (2013).
- Worner, M., Poore, S., Tilkorn, D., Lokmic, Z., Penington, A. J. A low-cost, small volume circuit for autologous blood normothermic perfusion of rabbit organs. Art Org. 38 (4), 352-361 (2014).
- Kaths, J. M., Spetzler, V. N., et al. Normothermic Ex Vivo Kidney Perfusion for the Preservation of Kidney Grafts prior to Transplantation. J Vis Exp. (101), e52909 (2015).
- Song, J. J., Guyette, J. P., Gilpin, S. E., Gonzalez, G., Vacanti, J. P., Ott, H. C. Regeneration and experimental orthotopic transplantation of a bioengineered kidney. Nature Med. 19 (5), 646-651 (2013).
- Hall, A. M., Crawford, C., Unwin, R. J., Duchen, M. R., Peppiatt-Wildman, C. M. Multiphoton imaging of the functioning kidney. JASN. 22 (7), 1297-1304 (2011).
- Lindell, S. L., Williams, N., Brusilovsky, I., Mangino, M. J. Mouse IPK: A Powerful Tool to Partially Characterize Renal Reperfusion and Preservation Injury. Open Transplant J. 5, 15-22 (2011).
- Wagner, C., De Wit, C., Kurtz, L., Grünberger, C., Kurtz, A., Schweda, F. Connexin40 is essential for the pressure control of renin synthesis and secretion. Circ Res. 100 (4), 556-563 (2007).
- Czogalla, J., Vohra, T., Penton, D., Kirschmann, M., Craigie, E., Loffing, J. The mineralocorticoid receptor (MR) regulates ENaC but not NCC in mice with random MR deletion. Pflüger’s Archiv. , (2016).
- Poosti, F., et al. Precision-cut kidney slices (PCKS) to study development of renal fibrosis and efficacy of drug targeting ex vivo. Dis Model Mech. 8 (10), 1227-1236 (2015).
- Rahgozar, M., Guan, Z., Matthias, A., Gobé, G. C., Endre, Z. H. Angiotensin II facilitates autoregulation in the perfused mouse kidney: An optimized in vitro model for assessment of renal vascular and tubular function. Nephrology. 9 (5), 288-296 (2004).

