Fare İzole perfüze Böbrek Tekniği
Summary
Fare izole edilmiş perfüze böbrek (MIPK) perfüze edildi ve 1 saat için fonksiyonel ex vivo koşullar altında bir fare böbrek tutmak için kullanılan bir tekniktir. tamponlar ve cerrahi teknik ayrıntılı olarak tarif edilmiştir.
Abstract
Fare izole edilmiş perfüze böbrek (MIPK) perfüze edildi ve 1 saat için fonksiyonel ex vivo koşullar altında bir fare böbrek tutmak için kullanılan bir tekniktir. Bu izole organ ve perfüzyon böbrek biyomühendislik için Decellularization veya anti-reddi veya asal böbrek yüksek dozlarda genom düzenleme ilaç uygulaması da dahil olmak üzere gelecekte mümkün olabilir pek çok yenilikçi uygulamalar için fizyolojisi eğitimi için bir ön koşuldur nakli için. perfüzyon süre boyunca, böbrek, böbrek fonksiyonu değerlendirilebilir, manipüle ve çeşitli ilaç tatbik edilebilir. İşlemden sonra, böbrek nakledilen veya moleküler biyoloji, biyokimya analizi, ya da mikroskopi için işlenir.
Bu yazıda perfüzat ve fare böbrekler ex vivo perfüzyon için gerekli cerrahi teknik anlatılmaktadır. perfüzyon aparatı detayları verilen ve veri v gösteren sunulmuşturböbreğin hazırlama iability: morfolojik okumalar ve moleküler okuma farklı nefron bölümlerinin taşıyıcı proteinlerin Western blotlar farklı nefron bölümlerinin işlevsel transmisyon elektron mikroskobuyla böbrek kan akışı, vasküler direnç ve idrar verileri.
Introduction
Organların izole perfüzyon onlarca yıl 1 fizyolog arasında sürekli bir çaba konusu olmuştur. tekniği, kan basıncı, hormonlar, ya da sinirler gibi sistemik etkileri olmadan, organın işlevini sağlayan, çalışılacak. Carl Eduard Loebell 1849 2, izole edilmiş böbrek başarıyla perfüzyon tarif eden ilk olarak kabul edilir. O zamandan beri, perfüzyon aparatı önemli arıtma uğramıştır. Frey ve Gruber sürekli perfüzyon 2 oksijenasyon ve pulsatil pompalar için yapay akciğer tanıttı. Erken araştırmacılar özellikle büyük memeliler-yani, domuzlar 2 ve köpekler 3 sıçan böbreklerinde kullanımı -the ilk rapor, Weiss ve ark ait böbrekler okudu iken. Küçük memeli organ perfüzyon 4 çalışmada bir dönüm noktası oldu. Schurek ve ark. Yeterli böbrek tübüler eğer perfüzat memeli eritrosit ekleme gerekliliğini bildirdioksijen 5 elde edilebilir amaçlanmıştır. Uzun vadeli deneyler için kritik Aynı araştırma grubu 6 ile tampon sürekli diyaliz tanıtım oldu. 2003 yılında, Schweda ve ark. Daha sonra Rahgozar ve arkadaşları tarafından rafine fonksiyonel fare izole perfüze böbrek (MIPK) 7, rapor için ilk idi. 18 ve Lindell ve diğ. 14.
perfüze böbrek izole sıçan daha teknik olarak daha zor olsa da, MIPK kullanımı genetik olarak değiştirilmiş farelerin geniş bir yelpazede kullanımını sağlayan avantajını taşımaktadır. Bu kağıt 1 saat boyunca izole fare böbrekleri perfüze için yazarların yöntemin ayrıntılarını sunar. yöntem böbrek akış hızı, damar direnci, hormon salınımı, kan gazı analizi, idrar analizi ve ilaçların uygulama sürekli değerlendirme sağlar. prosedür takip edilerek, böbrekler, moleküler ve biyokimyasal analiz için işlenebilir mikroskopi için sabit ya daBir alıcı fare içine nakledilen (Şekil 1).
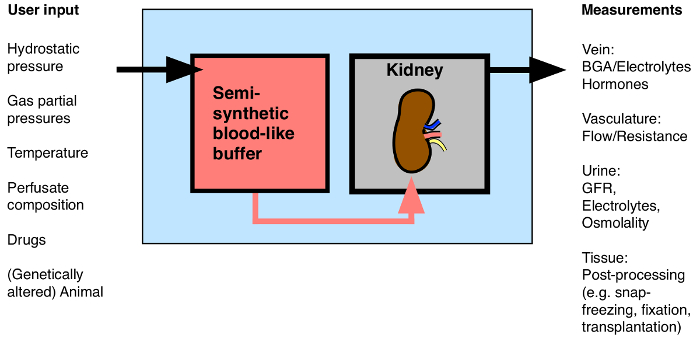
Şekil 1: İzole perfüze Böbrek Olası Giriş / Çıkış bakış. BGA: Kan gazı analizi. Bu rakamın büyük halini görmek için lütfen buraya tıklayınız.
Birçok yenilikçi uygulamalar ile (veya anti-ret veya genom düzenleme ilaçların uygulama olmadan) 8, 9 nakilden önce uzun süreli normotermik böbrek perfüzyon şafak ile tartışılmaktadır olarak bu tekniğin büyük olasılıkla, 10, önümüzdeki yıllarda artan ilgi alacaksınız , 11, hücresizleştirilmiş iskeleler 12 gelen bütün böbreklerin Bioengineering ve multiphoton görüntüleme 13 floresan boyalar yüksek dozlarda uygulanması </sup>. Ayrıca akut böbrek hasarı 14 sırasında belirli genlerin rolünü araştırmak için ideal bir modeldir.
Bir adım-adım protokolü diğer laboratuarlar başarıyla izole fare böbrek perfüzyon gerçekleştirmek için izin verilir. İlk olarak, bileşim, ve tampon hazırlanması belirtilir. Daha sonra, cerrahi ayrıntılı olarak tarif edilmiştir ve kritik adımlar gösterilmektedir. Üçüncü olarak, veri başarılı bir hazırlık temsil ettiğini sunulmuştur: renal kan akımı, damar direnci, glomerüler filtrasyon hızı ve fraksiyonel elektrolit atılımı hepsi perfüze böbreklerin farklı nefron segmentlerinden morfolojisi canlılık-ve transmisyon elektron mikroskobuyla olarak fonksiyonel ölçümler perfüzyon 1 saat sonra sabit.
Protocol
Representative Results
Discussion
Perfüze böbrek izole fare çok sayıda sistemik faktörlerin etkisi ile kusurlu olabilir sağlam hayvanlarda in vivo deneyler arasındaki köprü, 1 saat boyunca kontrollü bir ortamda ex vivo böbrek fonksiyonunu incelemek için bir araçtır ve in vitro deneylerde izole nefron segmentleri veya mutlaka fonksiyonu bozulmamış organ yapısı etkisini ihmal kültürlü hücreler. , Yazarların bilgisine, hiçbir alternatif bir teknik bu özel görevi vardır gerçekleştirmek için bir. Böbr…
Disclosures
The authors have nothing to disclose.
Acknowledgements
The authors would like to thank Hans-Joachim Schurek for invaluable scientific advice. The authors would like to thank Monique Carrel and Michèle Heidemeyer for excellent technical assistance, David Penton Ribas and Nourdine Faresse for a critical reading of the manuscript and Carsten Wagner and Jürg Biber for the NaPi-2a antibody. This work was supported by the Swiss National Centre for Competence in Research “Kidney.CH” and by a project grant (310030_143929/1) from the Swiss National Science Foundation.
Materials
| Perfusion Circuit: | |||
| Moist chamber 834/8 | Harvard Apparatus/Hugo Sachs Elektronik GmbH | 73-2901 | |
| Cannular with basket and side port | Harvard Apparatus/Hugo Sachs Elektronik GmbH | 73-2947 | |
| Thermostat TC120-ST5 | Harvard Apparatus/Hugo Sachs Elektronik GmbH | 73-4544 | |
| ISM 827/230V Roller Pump Reglo Analogue | Harvard Apparatus/Hugo Sachs Elektronik GmbH | 73-0114 | |
| Reservoir jacketed for buffer solution 1L | Harvard Apparatus/Hugo Sachs Elektronik GmbH | 73-3438 | |
| Reservoir jacketed for buffer solution 0.5L | Harvard Apparatus/Hugo Sachs Elektronik GmbH | 73-3436 | |
| Pressure Transducer APT300 | Harvard Apparatus/Hugo Sachs Elektronik GmbH | 73-3862 | |
| TAM-D Plugsys Transducer | Harvard Apparatus/Hugo Sachs Elektronik GmbH | 73-1793 | |
| SCP Plugsys servo controller | Harvard Apparatus/Hugo Sachs Elektronik GmbH | 73-2806 | |
| Windkessel | Harvard Apparatus/Hugo Sachs Elektronik GmbH | 73-3717 | |
| HSE-USB data acquisition | Harvard Apparatus/Hugo Sachs Elektronik GmbH | 73-3330 | |
| Low-Flux Dialysator Diacap Polysulfone | B.Braun | 7203525 | |
| PE-Tubing for aorta cannulation 1.19mm I.D. x 1.70mm O.D. | Scientific Commodities Inc. | BB31695-PE/8 | |
| Name | Company | Catalog Number | Comments |
| Buffer reagents: | |||
| Aminoplasmal 10% | B.Braun | 134518064 | |
| Sodium pyruvate | Sigma-Aldrich | P2256-25G | |
| L-Glutamic acid monosodium salt hydrate | Sigma-Aldrich | G1626-100G | |
| L-(-)-Malic acid sodium salt | Sigma-Aldrich | M1125-25G | |
| Sodium-L-Lactate | Sigma-Aldrich | L7022-10G | |
| alpha-Ketoglutaric acid sodium salt | Sigma-Aldrich | K1875-25G | |
| NaCl | Sigma-Aldrich | 31434-1KG-R | |
| NaHCO3 | Sigma-Aldrich | S5761-5KG | |
| KCl | Sigma-Aldrich | 60130-1KG | |
| Urea | Sigma-Aldrich | U5378-500G | |
| Creatinine | Sigma-Aldrich | C4255-10G | |
| Ampicillin | Roche | 10835242001 | |
| MgCl2 * 6H2O | Sigma-Aldrich | M2393-500G | |
| D-Glucose | Sigma-Aldrich | G8270-1KG | |
| CaCl2 * 6H2O | Riedel-de-Haën | 12074 | |
| NaH2PO4 | Sigma-Aldrich | S9638-500G | |
| Na2HPO4 | Sigma-Aldrich | S0876-500G | |
| Antidiuretic Hormone dDAVP | Sigma-Aldrich | V2013-1MG | |
| FITC-Inulin | Sigma-Aldrich | ||
| Filter used for erythrocyte filtration | Macherey-Nagel | MN 615 | |
| BGA Analysis: | |||
| ABL 80 flex | Radiometer Medical ApS | ||
| Electron Microscope: | |||
| Philips CM100 TEM | FEI |
References
- Carrel, A., Lindbergh, C. A. The culture of whole organs. Science (New York, N.Y.). 81 (2112), 621-623 (1935).
- Skutul, K. . Über Durchströmungsapparate Pflüger’s Archiv. 123 (4-6), 249-273 (1908).
- Nizet, A. The isolated perfused kidney: possibilities, limitations and results. Kidney Int. 7 (1), 1-11 (1975).
- Weiss, C., Passow, H., Rothstein, A. Autoregulation of flow in isolated rat kidney in the absence of red cells. Am J Physiol. 196 (5), 1115-1118 (1959).
- Schurek, H. J., Kriz, W. Morphologic and functional evidence for oxygen deficiency in the isolated perfused rat kidney. Lab Invest. 53 (2), 145-155 (1985).
- Stolte, H., Schurek, H. J., Alt, J. M. Glomerular albumin filtration: a comparison of micropuncture studies in the isolated perfused rat kidney with in vivo experimental conditions. Kidney Int. 16 (3), 377-384 (1979).
- Schweda, F., Wagner, C., Krämer, B. K., Schnermann, J., Kurtz, A. Preserved macula densa-dependent renin secretion in A1 adenosine receptor knockout mice. AJP Renal Physiol. 284 (4), F770-F777 (2003).
- Moers, C., Smits, J. M., et al. Machine perfusion or cold storage in deceased-donor kidney transplantation. N Engl J Med. 360 (1), 7-19 (2009).
- Nicholson, M. L., Hosgood, S. A. Renal transplantation after ex vivo normothermic perfusion: the first clinical study. Am J Transplant. 13 (5), 1246-1252 (2013).
- Worner, M., Poore, S., Tilkorn, D., Lokmic, Z., Penington, A. J. A low-cost, small volume circuit for autologous blood normothermic perfusion of rabbit organs. Art Org. 38 (4), 352-361 (2014).
- Kaths, J. M., Spetzler, V. N., et al. Normothermic Ex Vivo Kidney Perfusion for the Preservation of Kidney Grafts prior to Transplantation. J Vis Exp. (101), e52909 (2015).
- Song, J. J., Guyette, J. P., Gilpin, S. E., Gonzalez, G., Vacanti, J. P., Ott, H. C. Regeneration and experimental orthotopic transplantation of a bioengineered kidney. Nature Med. 19 (5), 646-651 (2013).
- Hall, A. M., Crawford, C., Unwin, R. J., Duchen, M. R., Peppiatt-Wildman, C. M. Multiphoton imaging of the functioning kidney. JASN. 22 (7), 1297-1304 (2011).
- Lindell, S. L., Williams, N., Brusilovsky, I., Mangino, M. J. Mouse IPK: A Powerful Tool to Partially Characterize Renal Reperfusion and Preservation Injury. Open Transplant J. 5, 15-22 (2011).
- Wagner, C., De Wit, C., Kurtz, L., Grünberger, C., Kurtz, A., Schweda, F. Connexin40 is essential for the pressure control of renin synthesis and secretion. Circ Res. 100 (4), 556-563 (2007).
- Czogalla, J., Vohra, T., Penton, D., Kirschmann, M., Craigie, E., Loffing, J. The mineralocorticoid receptor (MR) regulates ENaC but not NCC in mice with random MR deletion. Pflüger’s Archiv. , (2016).
- Poosti, F., et al. Precision-cut kidney slices (PCKS) to study development of renal fibrosis and efficacy of drug targeting ex vivo. Dis Model Mech. 8 (10), 1227-1236 (2015).
- Rahgozar, M., Guan, Z., Matthias, A., Gobé, G. C., Endre, Z. H. Angiotensin II facilitates autoregulation in the perfused mouse kidney: An optimized in vitro model for assessment of renal vascular and tubular function. Nephrology. 9 (5), 288-296 (2004).

