Summary
Musen isoleret perfunderede nyre (MIPK) er en teknik til at holde en mus nyre under ex vivo betingelser perfunderes og funktionelle i 1 time. Bufferne og kirurgisk teknik er beskrevet i detaljer.
Abstract
Musen isoleret perfunderede nyre (MIPK) er en teknik til at holde en mus nyre under ex vivo betingelser perfunderes og funktionelle i 1 time. Dette er en forudsætning for at studere fysiologi af den isolerede organ og for mange innovative applikationer, der kan være muligt i fremtiden, herunder perfusion decellularization for nyre bioteknologi eller administration af anti-afvisning eller genom-redigering narkotika i høje doser til prime nyrerne til transplantation. I den tid af perfusionen, kan nyren manipuleres, nyrefunktionen kan vurderes, og forskellige lægemidler administreres. Efter proceduren, kan nyren transplanteres eller behandles med molekylær biologi, biokemisk analyse eller mikroskopi.
Dette papir beskriver perfusatet og den kirurgiske teknik er nødvendig for ex vivo perfusion af mus nyrer. Nærmere oplysninger om perfusionsapparatet er givet, og data er præsenteret som viser viability i nyrerne forberedelse: renal blodgennemstrømning, vaskulær modstand, og urin data som funktionelle, transmission elektronmikrofotografier af forskellige nephron segmenter som morfologiske udlæsninger og western blots af transportproteiner i forskellige nephron segmenter som molekylær udlæsning.
Introduction
Den isolerede perfusion af organer har været genstand for en løbende indsats blandt fysiologer i mange årtier 1. Teknikken muliggør funktionen af organet, uden systemiske påvirkninger, såsom blodtryk, hormoner, eller nerver, der skal undersøges. Carl Eduard Loebell anses for at være den første til at have beskrevet den succesfulde perfusion af en isoleret nyre, i 1849 2. Siden da har perfusionsapparatet undergået betydelig forfinelse. Frey og Gruber indført en kunstig lunge for iltning og pulserende pumper til kontinuerlig perfusion 2. Mens tidlige forskere hovedsageligt undersøgt nyrerne af store pattedyr-nemlig, svin 2 og hunde 3 -den første rapport af brugen af rotte nyrer, ved Weiss et al. , Var en milepæl i studiet af små pattedyr-orgel perfusion 4. Schurek et al. rapporterede nødvendigheden af at tilføre mammale erytrocytter til perfusatet hvis tilstrækkelig renal tubulæriltning skulle opnås 5. Kritisk for langsigtede eksperimenter var indførelsen af kontinuerlig dialyse af bufferen af samme forskergruppe 6. I 2003 Schweda et al. var de første til at rapportere et isoleret funktionel mus perfunderet nyre (MIPK) 7, senere raffineres af Rahgozar et al. 18 og Lindell et al. 14.
Mens teknisk mere udfordrende end rotten isoleret perfunderede nyre, brugen af MIPK bærer den fordel, at anvendelsen af en bred vifte af genetisk ændrede mus. Denne artikel præsenterer detaljerne i forfatternes metode til perfusion isolerede mus nyrer i 1 time. Metoden giver mulighed for løbende vurdering af renal flow, vaskulær modstand, hormon frigivelse, blodgas analyse, urinanalyse, og anvendelsen af lægemidler. Ved at følge fremgangsmåden, kunne nyrer behandles til molekylær og biokemisk analyse, fastsættes for mikroskopi, ellertransplanteres i en recipient mus (figur 1).
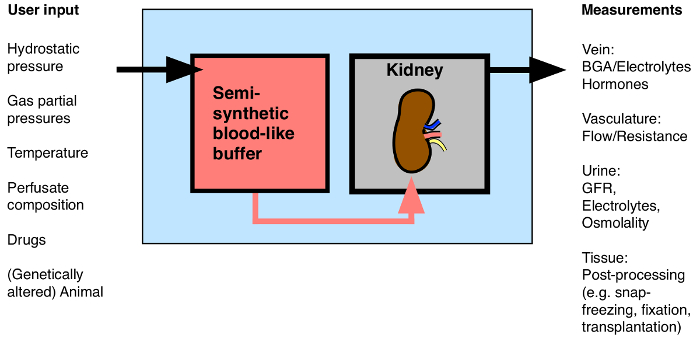
Figur 1: Oversigt over mulige Input / Output til de isolerede perfunderede nyre. BGA: Blood gasanalyse. Klik her for at se en større version af dette tal.
Denne teknik vil sandsynligvis modtage stigende opmærksomhed i de kommende år, da mange innovative applikationer drøftes med begyndelsen af langvarig normotermisk nyre perfusion før transplantation (med eller uden anvendelse af anti-afvisning eller genom-redigering narkotika) 8, 9, 10 , 11, den bioteknik af hele nyrer fra decellulariserede stilladser 12, og anvendelsen af høje doser af fluorescerende farvestoffer for multifoton billeddannelse 13 </sup>. Det er også en ideel model, med hvilken at undersøge den rolle af specifikke gener under akut nyreskade 14.
En trin-for-trin-protokollen er givet for at tillade andre laboratorier til at udføre isoleret mus nyre perfusion med succes. Først bliver sammensætningen og fremstillingen af bufferen angivet. Derefter kirurgi beskrevet detaljeret og er vist de kritiske trin. For det tredje, data præsenteres som er repræsentative for en vellykket forberedelse: renal blodgennemstrømning, vaskulær modstand, glomerulære filtrationshastighed, og fraktioneret elektrolyt udskillelse-alle som funktionelle målinger af rentabilitet-og transmission elektron mikrografier af morfologi forskellige nephron segmenter af perfunderede nyrer fast efter 1 time af perfusion.
Protocol
Representative Results
Discussion
Musen isoleret perfunderede nyre er et værktøj til at studere nyrefunktion i et kontrolleret miljø ex vivo i 1 time, bygge bro mellem in vivo forsøg i intakte dyr, som kan være mangelfulde med virkningen af talrige systemiske faktorer, og in vitro eksperimenter i isolerede nephron segmenter eller dyrkede celler, som nødvendigvis forsømmer virkningen af intakt organ struktur på funktion. Der er, til forfatternes viden, noget alternativ teknik med til at udføre denne specifikke op…
Disclosures
The authors have nothing to disclose.
Acknowledgements
The authors would like to thank Hans-Joachim Schurek for invaluable scientific advice. The authors would like to thank Monique Carrel and Michèle Heidemeyer for excellent technical assistance, David Penton Ribas and Nourdine Faresse for a critical reading of the manuscript and Carsten Wagner and Jürg Biber for the NaPi-2a antibody. This work was supported by the Swiss National Centre for Competence in Research “Kidney.CH” and by a project grant (310030_143929/1) from the Swiss National Science Foundation.
Materials
| Perfusion Circuit: | |||
| Moist chamber 834/8 | Harvard Apparatus/Hugo Sachs Elektronik GmbH | 73-2901 | |
| Cannular with basket and side port | Harvard Apparatus/Hugo Sachs Elektronik GmbH | 73-2947 | |
| Thermostat TC120-ST5 | Harvard Apparatus/Hugo Sachs Elektronik GmbH | 73-4544 | |
| ISM 827/230V Roller Pump Reglo Analogue | Harvard Apparatus/Hugo Sachs Elektronik GmbH | 73-0114 | |
| Reservoir jacketed for buffer solution 1L | Harvard Apparatus/Hugo Sachs Elektronik GmbH | 73-3438 | |
| Reservoir jacketed for buffer solution 0.5L | Harvard Apparatus/Hugo Sachs Elektronik GmbH | 73-3436 | |
| Pressure Transducer APT300 | Harvard Apparatus/Hugo Sachs Elektronik GmbH | 73-3862 | |
| TAM-D Plugsys Transducer | Harvard Apparatus/Hugo Sachs Elektronik GmbH | 73-1793 | |
| SCP Plugsys servo controller | Harvard Apparatus/Hugo Sachs Elektronik GmbH | 73-2806 | |
| Windkessel | Harvard Apparatus/Hugo Sachs Elektronik GmbH | 73-3717 | |
| HSE-USB data acquisition | Harvard Apparatus/Hugo Sachs Elektronik GmbH | 73-3330 | |
| Low-Flux Dialysator Diacap Polysulfone | B.Braun | 7203525 | |
| PE-Tubing for aorta cannulation 1.19mm I.D. x 1.70mm O.D. | Scientific Commodities Inc. | BB31695-PE/8 | |
| Name | Company | Catalog Number | Comments |
| Buffer reagents: | |||
| Aminoplasmal 10% | B.Braun | 134518064 | |
| Sodium pyruvate | Sigma-Aldrich | P2256-25G | |
| L-Glutamic acid monosodium salt hydrate | Sigma-Aldrich | G1626-100G | |
| L-(-)-Malic acid sodium salt | Sigma-Aldrich | M1125-25G | |
| Sodium-L-Lactate | Sigma-Aldrich | L7022-10G | |
| alpha-Ketoglutaric acid sodium salt | Sigma-Aldrich | K1875-25G | |
| NaCl | Sigma-Aldrich | 31434-1KG-R | |
| NaHCO3 | Sigma-Aldrich | S5761-5KG | |
| KCl | Sigma-Aldrich | 60130-1KG | |
| Urea | Sigma-Aldrich | U5378-500G | |
| Creatinine | Sigma-Aldrich | C4255-10G | |
| Ampicillin | Roche | 10835242001 | |
| MgCl2 * 6H2O | Sigma-Aldrich | M2393-500G | |
| D-Glucose | Sigma-Aldrich | G8270-1KG | |
| CaCl2 * 6H2O | Riedel-de-Haën | 12074 | |
| NaH2PO4 | Sigma-Aldrich | S9638-500G | |
| Na2HPO4 | Sigma-Aldrich | S0876-500G | |
| Antidiuretic Hormone dDAVP | Sigma-Aldrich | V2013-1MG | |
| FITC-Inulin | Sigma-Aldrich | ||
| Filter used for erythrocyte filtration | Macherey-Nagel | MN 615 | |
| BGA Analysis: | |||
| ABL 80 flex | Radiometer Medical ApS | ||
| Electron Microscope: | |||
| Philips CM100 TEM | FEI |
References
- Carrel, A., Lindbergh, C. A. The culture of whole organs. Science (New York, N.Y.). 81 (2112), 621-623 (1935).
- Skutul, K. . Über Durchströmungsapparate Pflüger’s Archiv. 123 (4-6), 249-273 (1908).
- Nizet, A. The isolated perfused kidney: possibilities, limitations and results. Kidney Int. 7 (1), 1-11 (1975).
- Weiss, C., Passow, H., Rothstein, A. Autoregulation of flow in isolated rat kidney in the absence of red cells. Am J Physiol. 196 (5), 1115-1118 (1959).
- Schurek, H. J., Kriz, W. Morphologic and functional evidence for oxygen deficiency in the isolated perfused rat kidney. Lab Invest. 53 (2), 145-155 (1985).
- Stolte, H., Schurek, H. J., Alt, J. M. Glomerular albumin filtration: a comparison of micropuncture studies in the isolated perfused rat kidney with in vivo experimental conditions. Kidney Int. 16 (3), 377-384 (1979).
- Schweda, F., Wagner, C., Krämer, B. K., Schnermann, J., Kurtz, A. Preserved macula densa-dependent renin secretion in A1 adenosine receptor knockout mice. AJP Renal Physiol. 284 (4), F770-F777 (2003).
- Moers, C., Smits, J. M., et al. Machine perfusion or cold storage in deceased-donor kidney transplantation. N Engl J Med. 360 (1), 7-19 (2009).
- Nicholson, M. L., Hosgood, S. A. Renal transplantation after ex vivo normothermic perfusion: the first clinical study. Am J Transplant. 13 (5), 1246-1252 (2013).
- Worner, M., Poore, S., Tilkorn, D., Lokmic, Z., Penington, A. J. A low-cost, small volume circuit for autologous blood normothermic perfusion of rabbit organs. Art Org. 38 (4), 352-361 (2014).
- Kaths, J. M., Spetzler, V. N., et al. Normothermic Ex Vivo Kidney Perfusion for the Preservation of Kidney Grafts prior to Transplantation. J Vis Exp. (101), e52909 (2015).
- Song, J. J., Guyette, J. P., Gilpin, S. E., Gonzalez, G., Vacanti, J. P., Ott, H. C. Regeneration and experimental orthotopic transplantation of a bioengineered kidney. Nature Med. 19 (5), 646-651 (2013).
- Hall, A. M., Crawford, C., Unwin, R. J., Duchen, M. R., Peppiatt-Wildman, C. M. Multiphoton imaging of the functioning kidney. JASN. 22 (7), 1297-1304 (2011).
- Lindell, S. L., Williams, N., Brusilovsky, I., Mangino, M. J. Mouse IPK: A Powerful Tool to Partially Characterize Renal Reperfusion and Preservation Injury. Open Transplant J. 5, 15-22 (2011).
- Wagner, C., De Wit, C., Kurtz, L., Grünberger, C., Kurtz, A., Schweda, F. Connexin40 is essential for the pressure control of renin synthesis and secretion. Circ Res. 100 (4), 556-563 (2007).
- Czogalla, J., Vohra, T., Penton, D., Kirschmann, M., Craigie, E., Loffing, J. The mineralocorticoid receptor (MR) regulates ENaC but not NCC in mice with random MR deletion. Pflüger’s Archiv. , (2016).
- Poosti, F., et al. Precision-cut kidney slices (PCKS) to study development of renal fibrosis and efficacy of drug targeting ex vivo. Dis Model Mech. 8 (10), 1227-1236 (2015).
- Rahgozar, M., Guan, Z., Matthias, A., Gobé, G. C., Endre, Z. H. Angiotensin II facilitates autoregulation in the perfused mouse kidney: An optimized in vitro model for assessment of renal vascular and tubular function. Nephrology. 9 (5), 288-296 (2004).

