hyperpolariseret<sup> 13</sup> C Metabolic Magnetic Resonance Spectroscopy og Imaging
Summary
Dynamic nuclear polarization with subsequent sample dissolution has enabled real-time studies of metabolism in biological systems. Hyperpolarized [1-13C]pyruvate was used to study lactate dehydrogenase activity in a prostate carcinoma cell line in vitro.
Abstract
I de seneste årtier har nye metoder til tumor iscenesættelse, genopsætning, behandlingsrespons overvågning og gentagelse påvisning af en række forskellige kræftformer opstod i forbindelse med positronemissionstomografi state-of-the-art med 18 F-fluorodeoxyglukose ([18 F ] -FDG PET). 13C magnetisk resonans spektroskopisk imaging (13 CMRSI) er en minimalt invasiv billeddannelse metode, som tillader overvågning af metabolisme in vivo og i realtid. Som med enhver anden metode baseret på 13C kernemagnetisk resonans (NMR), det står over for den udfordring at lave termiske polarisering og et efterfølgende lavt signal-støj-forhold på grund af den relativt lave gyromagnetiske forhold på 13 C og dets lave naturlige forekomst i biologiske prøver. Ved at overvinde disse begrænsninger har dynamisk nukleare polarisering (DNP) med opløsning efterfølgende prøve nylig aktiveret almindeligt anvendte NMR og magnetisk resonans imaging (MRI) systemer til at måle, Undersøgelse, og image vigtige metaboliske veje i forskellige biologiske systemer. Et særligt interessante og lovende molekyle anvendt i 13 CMRSI er [1- 13C] pyruvat, som i de sidste ti år, har været meget anvendt til in vitro, præklinisk, og på det seneste, kliniske undersøgelser for at undersøge den cellulære energimetabolisme ved cancer og andre sygdomme. I denne artikel, vi skitsere teknik opløsning DNP brug af en 3,35 T præklinisk DNP hyperpolarisator og demonstrere dens anvendelse i in vitro-studier. En lignende protokol for hyperpolarisering kan anvendes for det meste i in vivo studier så godt. For at gøre dette har vi brugt lactatdehydrogenase (LDH) og katalyserede den metaboliske omsætning af [1- 13C] pyruvat til [1- 13C] lactat i en prostata carcinom-cellelinje, PC3, in vitro under anvendelse 13 CMRSI.
Introduction
I øjeblikket er den mest udbredte kliniske fremgangsmåde til tumor staging, genopsætning, behandlingsrespons overvågning, og fornyet påvisning af en lang række forskellige cancere er [18F] -FDG PET. 1 Men for nylig, flere nye og alternative tilgange er dukket op. En af disse metoder er 13 CMRSI. Denne teknik indebærer indførelsen af 13C-molekylet til en biologisk prøve, efterfulgt af minimalt invasiv MRI at vurdere metabolisme in vitro eller in vivo i realtid. Alligevel den største udfordring af 13. CMRSI, sammenlignet med de andre metoder, såsom [18F] -FDG PET eller computertomografi, er dens lave signal-til-støj-forhold.
NMR-signal er direkte proportional med niveauet af polarisation, et forhold af spin ½ kerner population forskel i to energitilstande til den samlede befolkning (figur 1A). Den polarisering er et produkt af the gyromagnetiske forhold (γ) af kernerne og den anvendte magnetiske feltstyrke over temperaturområdet. En typisk polarisering på 1 time kerner er i størrelsesordenen 0,001% til 0,005% ved 3 T, hvilket giver et relativt dårligt signal-støj-forhold. Dagens state-of-the-art MRI har været en vellykket billeddannelse metode kun på grund af den høje forekomst af 1H i biologiske prøver og den høje gyromagnetiske forhold af 1 H (y 1H = 42,576 MHz / T). Men observere andre kerner, såsom kul, er mere krævende. Det eneste stabile, magnetisk aktivt kul isotop, 13C, kun udgør 1,1% af alle kulstofatomer. Derudover gyromagnetiske forhold på 13C (γ 13C = 10,705 MHz / T) er fire gange lavere end for 1H, hvilket fører til en lavere afsløring effektivitet. Sammenfattende lav 13C overflod og lav γ 13C forårsage termiske målinger 13 C til opnåelse af 0,0176% af følsomheden af en 1H-NMR-måling in vivo.
Dynamisk Nuklear Polarisering
Fremgangsmåde til at overvinde den relativt ringe følsomhed på 13 C-målinger er DNP. Det blev oprindeligt beskrevet for metaller i 1953 af Albert W. Overhauser. I sin artikel, udtalte han: "Det er vist, at hvis den elektron spin resonans af ledningsforstyrrelser elektroner er mættet, vil kernerne blive polariseret i samme grad de ville være, hvis deres gyromagnetiske forhold var, at elektronens spin." 2 Senere det år, Carver og Slichter eksperimentelt bekræftet Overhauser hypotese 3. I 1958 Abragam og Proctor beskrevet denne effekt for elektroner i væsker og kaldte det den "solid effekt." Ved temperaturer under 4 K, elektron-spin-polarisering når næsten 100% og er mere end tre størrelsesordener højere end den nukleare-spin-polarisation (figur 1B) 4. Thans opstår, fordi gyromagnetiske forholdet mellem elektron (γ e = 28024,944 MHz / T) er tre størrelsesordener højere end de nukleare gyromagnetiske nøgletal. De svage interaktioner mellem elektroner og kerner, såsom Overhauser effekt, den faste retning indlæg virkning, og den termiske blanding virkning, tillade overførsel af polarisering fra elektron spins at kernespin ved hjælp mikrobølgebestråling med en frekvens tæt på den tilsvarende elektron paramagnetiske resonans (EPR) frekvens 5,6. DNP teori er blevet videreudviklet til at involvere flere elektroner og termisk blanding. Alligevel til dato ingen samlet kvantitativ teoretisk beskrivelse af DNP er offentliggjort 7,8.
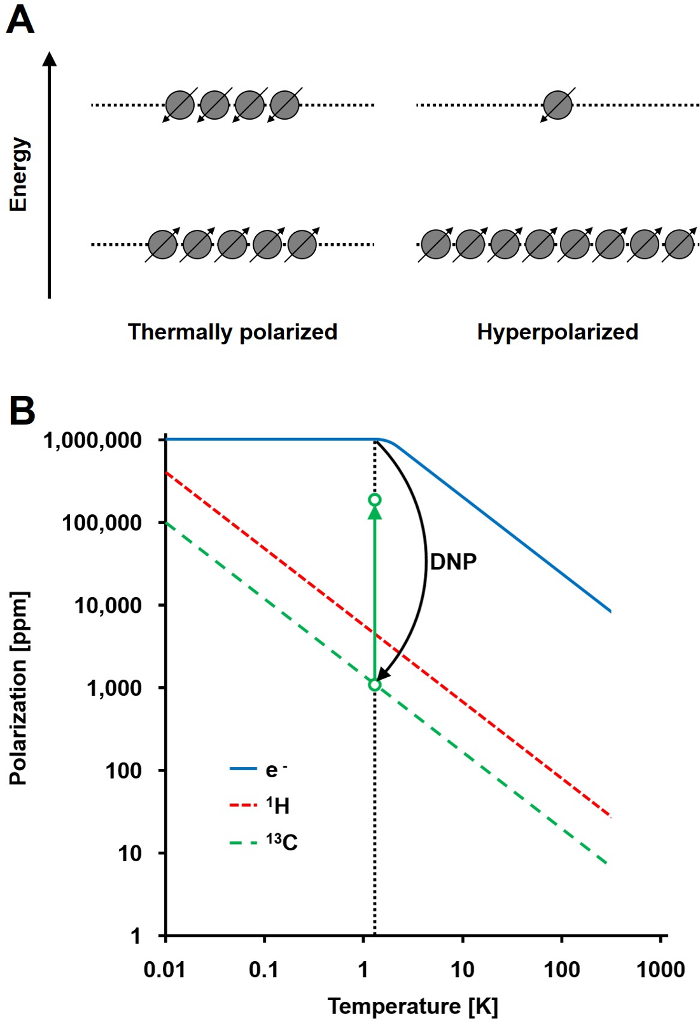
Figur 1: Forståelse Dynamic Nuclear Polarisation og hyperpolarisering. A) En skematisk sammenligning af spin befolkningi termisk ligevægt polarisering staten og den hyperpolariserede tilstand. B) Polariseringen er afhængig af temperatur. Polariseringen af en elektron (e -) når 100% under 1,4 K. DNP muliggør overførsel af polarisationen fra e til de 13 C-kerner, hvilket øger deres polarisation op til 10 5 fold. Klik her for at se en større version af dette tal.
At indføre DNP i studier af biologiske systemer, der anvender 13C NMR, efterfølgende opløsning hurtig prøve havde skal udvikles. 50 år efter Overhauser hypotese, Jan H. Ardenkjaer-Larsen et al. løst teknisk udfordrende spørgsmål om at bringe den hyperpolariserede frosne prøve i flydende tilstand med minimal hyperpolarisering tab 6. Opløsning DNP åbnede en ny forskningsområde kaldet 13 CMRSI, hvilket giver en ny metode til at undersøge og karakterisere forskellige sygdomstilstande 9,10. Som stabile bærere af en uparret elektron, en tritylgruppe radikal tris (8-carboxy-2,2,6,6-tetra (hydroxyethyl) benzo- [1,2-4,5] bis- (1,3) -dithiole-4-yl) methyl-natriumsalt (OX063) eller (2,2,6,6-Tetramethylpiperidin-1-yl) oxy (TEMPO) anvendes sædvanligvis. Disse blandes med den ønskede 13C-mærkede molekyle og eksponeret for mikrobølgebestråling med en frekvens tæt på den tilsvarende EPR frekvens. Ved hjælp af denne teknik, kan polariseringen af 13 C kerner øges op til 37% 11. Dette resulterer i en 10 5 fold polarisering forbedring i forhold til den termiske ligevægt polarisering 11,12. Men så snart mikrobølgebestråling standses og / eller 13C-molekyle overføres til flydende tilstand, polarisationen henfalder med den langsgående relaksationstid (T1) af 13C kerne, blev polariseret. Såledesopfindelse af hurtige opløsningstider teknikker eller en senere teknik forkorte tiden før eksperimentel måling (dvs. injektion) er afgørende for biologiske anvendelser 13.
Der er tre store krav, at kandidaten molekylet har brug for at opfylde for en vellykket 13 CMRSI undersøgelser. Første, 13C kerne af interesse skal have en tilstrækkelig lang T1 (> 10 s). Valget af 13C-mærket er afgørende. Den bedste kandidat kerner er carbonatomer uden direkte kontakt med 1H-kerner via en binding. Det skal også metaboliseres hurtigt inden 2 – 3 i T 1 gange, hvilket resulterer i en nedstrøms metabolisk produkt med en signifikant forskellig kemisk skift fra det oprindelige stof. Blandingen Prøven skal også udgøre et amorft glas, når i en fast tilstand, således at den rumlige fordeling formindsker afstanden mellem elektronen og 13C, således at transfer af polarisering. Hvis kandidatmolekylet ikke danner amorfe glas naturligt, det skal være letopløseligt i en glassing middel, såsom glycerol eller dimethylsulfoxid 14. Disse krav medfører et relativt lille antal kandidatmolekyler. Men selv efter en vellykket opdagelsen af en egnet molekyle, udvikle en arbejdsgruppe protokol for hyperpolarisering kan være teknisk udfordrende 9,14,15.
I de seneste år har adskillige substrater været succesfuldt polariseret, såsom [1- 13C] pyruvat 12,16 – 36, [2- 13C] pyruvat 37, [1- 13C] ethylpyruvat 38, [1- 13C ] lactat 39, [1- 13C] fumarat 40 – 43 13C-bicarbonat 36,44,45, [1- 13C] natriumacetat 43,46 – 49, 13C-urea 6,36,50,51 , [5- 13C] glutamine 15,52,53, [1- 13C] glutamat 53,54, [1- 13 C] 2-oxoglutarat 55, [1- 13C] alanin og andre 14,56. En særlig interessant og almindeligt anvendte substrat til hyperpolarisering er [1- 13C] pyruvat. Det er almindeligt anvendt i prækliniske studier for at undersøge den cellulære energi-metabolisme i forskellige sygdomme 14,17,22. [1- 13 C] pyruvat opfylder alle krav til en vellykket hyperpolarisering, herunder en forholdsvis lang T 1 og hurtig transport over cellemembranen før senere at blive metaboliseret. Prækliniske studier med [1- 13 C] pyruvat øjeblikket oversat til klinikken 57.
Metabolisme af pyruvat
Det er velkendt, at der er en direkte sammenhæng mellem mutationer i et kræftceller 'DNA og ændringer i deres metaboliske veje. Allerede i 1920'erne, Otto Warburg Discovob- at der er en øget metabolisme af glucose og produktion af lactat i tumorer sammenlignet med raske væv 58 – 60 år. Efterfølgende forskellige vekslen i andre metaboliske veje, såsom pentose-phosphat pathway, tricarboxylsyrecyklen, oxidativ phosphorylering, og syntesen af nukleotider og lipider, er blevet beskrevet.
Pyruvat er slutproduktet af glycolyse. I tumoren, det undergår anaerob glycolyse katalyseret af LDH 61 og reagerer med den reducerede form af coenzym nikotinamidadenindinukleotid (NADH), hvilket resulterer i lactat og den oxiderede form af coenzym (NAD +). Alternativt pyruvat undergår en transamineringsreaktion med glutamat til dannelse alanin, katalyseret af alanin transaminase (ALT). Begge reaktioner er let reversible. Pyruvat undergår også decarboxylering katalyseret af pyruvatdehydrogenase (PDH) til carbondioxid og acetyl-CoA, representing en irreversibel reaktion på dette trin. Vekslen i disse reaktionshastigheder kan knyttes til tumor stofskifte 17,21,22,25,62. De metaboliske veje er opsummeret i figur 2.

Figur 2: Diagram over væsentligste metaboliske reaktion af pyruvat. Pyruvat / lactat omdannelse katalyseres af LDH, og pyruvat / alanin omdannelse katalyseres af ALT. Pyruvat omdannes irreversibelt til acetyl-CoA og CO 2 ved PDH, og CO 2 er i et pH-afhængig ligevægt med bicarbonat 80. Klik her for at se en større version af dette tal.
Påvisningen af hyperpolariseret [1- 13C] pyruvat og dets metabolitter er tidligere blevet påvist i rotter hanart 37,63 – 65, lever 66, muskel, og nyre 62,67. En undersøgelse viste betydelige forskelle i lactat-til-alanin-forhold mellem den normale og fastede rottelever 66 og demonstrerede en stærkt forhøjet og hyperpolariserede [1- 13C] lactat niveau i leverkræft 68,69. Der er beviser for, at tumoren klasse kan identificeres i en transgen adenocarcinom af mus prostata (TRAMP) ved hjælp af hyperpolariseret [1- 13 C] pyruvat 22, med de hyperpolariserede laktatniveauer viser en høj korrelation med den histologiske kvalitet af de udskårne tumorer. Den alanin katalyseret fra pyruvat ved ALT er også blevet foreslået som en nyttig markør i rotte hepatocellulært carcinom 23.
Måling af pyruvat-lactat metabolisk flux har været anvendt til overvågning iskæmi 63,65,70 og som en reaktion på behandling med cytotoksisk kemoterapi 17,40, målrettede lægemidler <sup> 24,25,41, eller radioterapi 26 i dyremodeller. Det er også blevet anvendt til påvisning af phosphatidylinositol 3-kinase (PI3K) inhibitor LY294002 respons i glioblastom og brystcancer musemodeller 25. Ændringer i pyruvat-metabolisme i hjernetumorer 26 og prostatacancer 24,71 er også blevet observeret efter behandling.
prostatacarcinom
Prostata karcinom er den dominerende kræft hos ældre mænd og den næsthyppigste kræft relateret til døden hos mænd verden over 72. Til dato, ingen pålidelige, ikke-invasive metoder er tilgængelige for en tidlig diagnose og karakterisering af prostatakræft 73,74, understreger det presserende behov for nye metaboliske billeddannende teknikker til at muliggøre stringent påvisning og iscenesættelse af patienterne. Prostatacarcinom blev anvendt som en model til at demonstrere mulighederne for opløsning DNP kombineret med 13 CMRSI i patients 57. Dette arbejde blev fortsat i en første kliniske forsøg, der anvender [1- 13C] pyruvat og 13 CMRSI til billeddannelse af prostatacancer, og det er netop er afsluttet (NCT01229618).
Motivationen bag dette arbejde var at illustrere mere detaljeret og for et bredere publikum anvendelsen af den 13 CMRSI metoden i et præklinisk indstilling med celler. Måling af LDH-katalyseret metabolisme af [1- 13 C] pyruvat til [1- 13 C] laktat in vitro i PC3 prostata karcinom cellelinje, viser vi den mulige anvendelse af opløsning DNP i in vitro-undersøgelser og tage fat på de afgørende skridt og udfordringer under eksperimenter.
Protocol
Representative Results
Discussion
13 CMRSI med hyperpolariserede prober er en lovende metode til at overvåge metabolisme i realtid in vitro og in vivo. Et meget vigtigt aspekt, når der anvendes denne eksperimentelle fremgangsmåde er den rigtige standardisering, især hvad angår in vitro eksperimenter. Først skal gøres korrekt og konsekvent at opnå den samme koncentration af hyperpolariseret materiale i hvert eksperiment fremstillingen af prøven. Dette kræver en præcis vejning af både prøven for at …
Disclosures
The authors have nothing to disclose.
Acknowledgements
E.K. gratefully acknowledges the support of the Graduate School of Bioengineering (GSB) at Technische Universität München. This work was supported by the German Research Foundation (DFG) within the SFB Collaborative Research Center 824, “Imaging for Selection, Monitoring, and Individualization of Cancer Therapies.”
Materials
| HyperSense DNP Polariser | Oxford Instruments | 3.35 T preclinical DNP hyperpolarizer | |
| GE/Agilent MR901 | GE Healthcare/Agilent Technologies | 7 T preclinical MRI scanner, with small bore designed for experiments onrodent | |
| Spinsolve Carbon | Magritek | 1 T NMR spectrometer with permanent magnet | |
| Deuterium Oxide | Sigma Aldrich | 7789-20-0 | |
| Sodium phosphate dibasic | Sigma Aldrich | 7558-79-4 | |
| Sodium phosphate monbasic | Sigma Aldrich | 7558-80-7 | |
| Sodium hydroxide | Sigma Aldrich | 1310-73-2 | |
| Disodium edetate | Sigma Aldrich | 6381-92-6 | |
| Pyruvic acid – 13C1 | Cambridge Isotopes Laboratories | CLM-8077-1 | |
| Dotarem (0.5 mmol/L) | Guerbet | gadoterate meglumine | |
| tris (8-carboxy-2,2,6,6-tetra-(hydroxyethyl)-benzo-[1,2–4,5]-bis-(1,3)-dithiole-4-yl)-methyl sodium salt (OX063) | GE Healthcare | trityl radical used as a sourse of free electron | |
| PC3 cell line | ATCC | CRL1435 | |
| F-12K medium | ATCC | 30-2004 | |
| Fetal Bovine Serum | ATCC | SCRR-30-2020 | |
| Trypsine-EDTA Solution, 1X | ATCC | 30-2101 | |
| Sample plastic cup | Oxford Instruments | ||
| Trypan blue | Bio-Rad | 145-0013-MSDS |
References
- Rohren, E. M., Turkington, T. G., Coleman, R. E. Clinical applications of PET in oncology. Radiology. 231 (2), 305-332 (2004).
- Overhauser, A. W. Polarization of Nuclei in Metals. Phys. Rev. 92 (2), 411-415 (1953).
- Carver, T. R., Slichter, C. P. Polarization of Nuclear Spins in Metals. Phys. Rev. 92 (1), 212-213 (1953).
- Abragam, A., Proctor, W. G. Spin Temperature. Phys. Rev. 109 (5), 1441-1458 (1958).
- Abragam, a., Goldman, M. Principles of dynamic nuclear polarisation. Reports Prog. Phys. 41 (3), 395-467 (2001).
- Ardenkjaer-Larsen, J. H., Fridlund, B., et al. Increase in signal-to-noise ratio of > 10,000 times in liquid-state NMR. Proc. Natl. Acad. Sci. U. S. A. 100 (18), 10158-10163 (2003).
- Shimon, D., Hovav, Y., Feintuch, A., Goldfarb, D., Vega, S. Dynamic nuclear polarization in the solid state: a transition between the cross effect and the solid effect. Phys. Chem. Chem. Phys. 14 (16), 5729-5743 (2012).
- Serra, S. C., Rosso, A., Tedoldi, F. Electron and nuclear spin dynamics in the thermal mixing model of dynamic nuclear polarization. Phys. Chem. Chem. Phys. 14 (38), 13299-13308 (2012).
- Gallagher, F. A., Kettunen, M. I., Brindle, K. M. Biomedical applications of hyperpolarized 13C magnetic resonance imaging. Prog. Nucl. Magn. Reson. Spectrosc. 55 (4), 285-295 (2009).
- Hurd, R. E., Yen, Y. -. F., Chen, A., Ardenkjaer-Larsen, J. H. Hyperpolarized 13C metabolic imaging using dissolution dynamic nuclear polarization. J. Magn. Reson. Imaging. 36 (6), 1314-1328 (2012).
- Ardenkjaer-Larsen, J. H., Fridlund, B., et al. Increase in signal-to-noise ratio of > 10,000 times in liquid-state NMR. Proc. Natl. Acad. Sci. U. S. A. 100 (18), 10158-10163 (2003).
- Golman, K., in’t Zandt, R., Thaning, M. Real-time metabolic imaging. Proc. Natl. Acad. Sci. 103 (30), 11270-11275 (2006).
- Comment, A., Rentsch, J., et al. Producing over 100 ml of highly concentrated hyperpolarized solution by means of dissolution DNP. J. Magn. Reson. 194 (1), 152-155 (2008).
- Brindle, K. M., Bohndiek, S. E., Gallagher, F. A., Kettunen, M. I. Tumor imaging using hyperpolarized 13C magnetic resonance spectroscopy. Magn. Reson. Med. 66 (2), 505-519 (2011).
- Gallagher, F. A., Kettunen, M. I., Day, S. E., Lerche, M., Brindle, K. M. 13C MR spectroscopy measurements of glutaminase activity in human hepatocellular carcinoma cells using hyperpolarized 13C-labeled glutamine. Magn. Reson. Med. 60 (2), 253-257 (2008).
- Chen, A. P., Albers, M. J., et al. Hyperpolarized C-13 spectroscopic imaging of the TRAMP mouse at 3T-initial experience. Magn. Reson. Med. 58 (6), 1099-1106 (2007).
- Day, S. E., Kettunen, M. I., et al. Detecting tumor response to treatment using hyperpolarized 13C magnetic resonance imaging and spectroscopy. Nat. Med. 13 (11), 1382-1387 (2007).
- Schroeder, M. A., Swietach, P., et al. Measuring intracellular pH in the heart using hyperpolarized carbon dioxide and bicarbonate: a 13C and 31P magnetic resonance spectroscopy study. Cardiovasc. Res. 86 (1), 82-91 (2010).
- Hurd, R. E., Yen, Y. -. F., Tropp, J., Pfefferbaum, A., Spielman, D. M., Mayer, D. Cerebral dynamics and metabolism of hyperpolarized [1-(13)C]pyruvate using time-resolved MR spectroscopic imaging. J. Cereb. Blood Flow Metab. 30 (13), 1734-1741 (2010).
- Golman, K., Zandt, R. I., Lerche, M., Pehrson, R., Ardenkjaer-Larsen, J. H. Metabolic imaging by hyperpolarized 13C magnetic resonance imaging for in vivo tumor diagnosis. Cancer Res. 66 (22), 10855-10860 (2006).
- Park, I., Larson, P. E. Z., et al. Hyperpolarized 13C magnetic resonance metabolic imaging: application to brain tumors. Neuro. Oncol. 12 (2), 133-144 (2010).
- Albers, M. J., Bok, R., et al. Hyperpolarized 13C lactate, pyruvate, and alanine: noninvasive biomarkers for prostate cancer detection and grading. Cancer Res. 68 (20), 8607-8615 (2008).
- Yen, Y. -. F., Le Roux, P., et al. T(2) relaxation times of (13)C metabolites in a rat hepatocellular carcinoma model measured in vivo using (13)C-MRS of hyperpolarized [1-(13)C]pyruvate. NMR Biomed. 23 (4), 414-423 (2010).
- Dafni, H., Larson, P. E. Z., et al. Hyperpolarized 13C spectroscopic imaging informs on hypoxia-inducible factor-1 and myc activity downstream of platelet-derived growth factor receptor. Cancer Res. 70 (19), 7400-7410 (2010).
- Ward, C. S., Venkatesh, H. S., et al. Noninvasive detection of target modulation following phosphatidylinositol 3-kinase inhibition using hyperpolarized 13C magnetic resonance spectroscopy. Cancer Res. 70 (4), 1296-1305 (2010).
- Day, S. E., Kettunen, M. I., et al. Detecting response of rat C6 glioma tumors to radiotherapy using hyperpolarized [1- 13C]pyruvate and 13C magnetic resonance spectroscopic imaging. Magn. Reson. Med. 65 (2), 557-563 (2011).
- Johannesson, H., Macholl, S., Ardenkjaer-Larsen, J. H. Dynamic Nuclear Polarization of [1-13C]pyruvic acid at 4.6 tesla. J. Magn. Reson. 197 (2), 167-175 (2009).
- Durst, M., Koellisch, U., et al. Bolus tracking for improved metabolic imaging of hyperpolarised compounds. J. Magn. Reson. 243, 40-46 (2014).
- Khegai, O., Schulte, R. F., et al. Apparent rate constant mapping using hyperpolarized [1-(13)C]pyruvate. NMR Biomed. 27 (10), 1256-1265 (2014).
- Sogaard, L. V., Schilling, F., Janich, M. A., Menzel, M. I., Ardenkjaer-Larsen, J. H. In vivo measurement of apparent diffusion coefficients of hyperpolarized (1)(3)C-labeled metabolites. NMR Biomed. 27 (5), 561-569 (2014).
- Aquaro, G. D., Frijia, F., et al. 3D CMR mapping of metabolism by hyperpolarized 13C-pyruvate in ischemia-reperfusion. JACC. Cardiovasc. Imaging. 6 (6), 743-744 (2013).
- Menzel, M. I., Farrell, E. V., et al. Multimodal assessment of in vivo metabolism with hyperpolarized [1-13C]MR spectroscopy and 18F-FDG PET imaging in hepatocellular carcinoma tumor-bearing rats. J. Nucl. Med. 54 (7), 1113-1119 (2013).
- Schilling, F., Duwel, S., et al. Diffusion of hyperpolarized (13) C-metabolites in tumor cell spheroids using real-time NMR spectroscopy. NMR Biomed. 26 (5), 557-568 (2013).
- Schulte, R. F., Sperl, J. I., et al. Saturation-recovery metabolic-exchange rate imaging with hyperpolarized [1-13C] pyruvate using spectral-spatial excitation. Magn. Reson. Med. 69 (5), 1209-1216 (2013).
- Wiesinger, F., Weidl, E., et al. IDEAL spiral CSI for dynamic metabolic MR imaging of hyperpolarized [1-13C]pyruvate. Magn. Reson. Med. 68 (1), 8-16 (2012).
- Wilson, D. M., Keshari, K. R., et al. Multi-compound polarization by DNP allows simultaneous assessment of multiple enzymatic activities in vivo. J. Magn. Reson. 205 (1), 141-147 (2010).
- Schroeder, M. A., Atherton, H. J., et al. Real-time assessment of Krebs cycle metabolism using hyperpolarized 13C magnetic resonance spectroscopy. FASEB J. Off. Publ. Fed. Am. Soc. Exp. Biol. 23 (8), 2529-2538 (2009).
- Hurd, R. E., Yen, Y. -. F., et al. Metabolic imaging in the anesthetized rat brain using hyperpolarized [1-13C] pyruvate and [1-13C] ethyl pyruvate. Magn. Reson. Med. 63 (5), 1137-1143 (2010).
- Chen, A. P., Kurhanewicz, J., et al. Feasibility of using hyperpolarized [1-13C]lactate as a substrate for in vivo metabolic 13C MRSI studies. Magn. Reson. Imaging. 26 (6), 721-726 (2008).
- Witney, T. H., Kettunen, M. I., et al. Detecting treatment response in a model of human breast adenocarcinoma using hyperpolarised [1-(13)C]pyruvate and. Br. J. Cancer. 103 (9), 1400-1406 (2010).
- Bohndiek, S. E., Kettunen, M. I., et al. Detecting tumor response to a vascular disrupting agent using hyperpolarized (13)C magnetic resonance spectroscopy. Mol. Cancer Ther. 9 (12), 3278-3288 (2010).
- Gallagher, F. A., Kettunen, M. I., et al. Production of hyperpolarized [1,4-13C2]malate from [1,4-13C2]fumarate is a marker of cell necrosis and treatment response in tumors. Proc. Natl. Acad. Sci. U. S. A. 106 (47), 19801-19806 (2009).
- Jensen, P. R., Peitersen, T., et al. Tissue-specific short chain fatty acid metabolism and slow metabolic recovery after ischemia from hyperpolarized NMR in vivo. J. Biol. Chem. 284 (52), 36077-36082 (2009).
- Gallagher, F. A., Kettunen, M. I., et al. Magnetic resonance imaging of pH in vivo using hyperpolarized 13C-labelled bicarbonate. Nature. 453 (7197), 940-943 (2008).
- Scholz, D. J., Janich, M. A., et al. Quantified pH imaging with hyperpolarized 13C-bicarbonate. Magn. Reson. Med. 73 (6), 2274-2282 (2015).
- Koellisch, U., Gringeri, C. V., et al. Metabolic imaging of hyperpolarized [1-(13) C]acetate and [1-(13) C]acetylcarnitine – investigation of the influence of dobutamine induced stress. Magn. Reson. Med. 74 (4), 1011-1018 (2015).
- Koellisch, U., Laustsen, C., et al. Investigation of metabolic changes in STZ-induced diabetic rats with hyperpolarized [1-13C]acetate. Physiol. Rep. 3 (8), (2015).
- Jensen, P. R., Meier, S., Ardenkjaer-Larsen, J. H., Duus, J. O., Karlsson, M., Lerche, M. H. Detection of low-populated reaction intermediates with hyperpolarized NMR. Chem. Commun. (34), 5168-5170 (2009).
- Koelsch, B. L., Keshari, K. R., Peeters, T. H., Larson, P. E. Z., Wilson, D. M., Kurhanewicz, J. Diffusion MR of hyperpolarized 13C molecules in solution. Analyst. 138 (4), 1011-1014 (2013).
- Golman, K., Ardenkjaer-Larsen, J. H., Petersson, J. S., Mansson, S., Leunbach, I. Molecular imaging with endogenous substances. Proc. Natl. Acad. Sci. U. S. A. 100 (18), 10435-10439 (2003).
- von Morze, C., Larson, P. E. Z., et al. Imaging of Blood Flow Using Hyperpolarized [(13)C]Urea in Preclinical Cancer Models. J. Magn. Reson. Imaging. 33 (3), 692-697 (2011).
- Chiavazza, E., Kubala, E., et al. Earth’s magnetic field enabled scalar coupling relaxation of 13C nuclei bound to fast-relaxing quadrupolar 14N in amide groups. J. Magn. Reson. 227, 35-38 (2013).
- Jensen, P. R., Karlsson, M., Meier, S., Duus, J., Lerche, M. H. Hyperpolarized amino acids for in vivo assays of transaminase activity. Chem. – A Eur. J. 15 (39), 10010-10012 (2009).
- Gallagher, F. A., Kettunen, M. I., et al. Detection of tumor glutamate metabolism in vivo using 13C magnetic resonance spectroscopy and hyperpolarized [1-13C]glutamate. Magn. Reson. Med. 66 (1), 18-23 (2011).
- Chaumeil, M. M., Larson, P. E. Z., et al. Hyperpolarized [1-13C] glutamate: a metabolic imaging biomarker of IDH1 mutational status in glioma. Cancer Res. 74 (16), 4247-4257 (2014).
- Keshari, K. R., Wilson, D. M. Chemistry and biochemistry of 13C hyperpolarized magnetic resonance using dynamic nuclear polarization. Chem. Soc. Rev. 43 (5), 1627-1659 (2014).
- Nelson, S. J., Kurhanewicz, J., et al. Metabolic Imaging of Patients with Prostate Cancer Using Hyperpolarized [1-13C]Pyruvate. Sci. Transl. Med. 5 (198), (2013).
- Warburg, O. On the origin of cancer cells. Science. 123 (3191), 309-314 (1956).
- Warburg, O., Wind, F., Negelein, E. {Ü}ber den Stoffwechsel von Tumoren im K{ö}rper. Klin. Wochenschr. 5 (19), 829-832 (1926).
- Barnes, A. B., De Paepe, G., et al. High-Field Dynamic Nuclear Polarization for Solid and Solution. Biological NMR. Appl. Magn. Reson. 34 (3-4), 237-263 (2008).
- Koukourakis, M. I., Giatromanolaki, A., Sivridis, E., Gatter, K. C., Harris, A. L. Pyruvate dehydrogenase and pyruvate dehydrogenase kinase expression in non small cell lung cancer and tumor-associated stroma. Neoplasia. 7 (1), 1-6 (2005).
- Golman, K., Petersson, J. S. Metabolic Imaging and Other Applications of Hyperpolarized 13C1. Acad. Radiol. 13 (8), 932-942 (2016).
- Golman, K., Petersson, J. S., et al. Cardiac metabolism measured noninvasively by hyperpolarized 13C MRI. Magn. Reson. Med. 59 (5), 1005-1013 (2008).
- Merritt, M. E., Harrison, C., Storey, C., Jeffrey, F. M., Sherry, A. D., Malloy, C. R. Hyperpolarized 13C allows a direct measure of flux through a single enzyme-catalyzed step by NMR. Proc. Natl. Acad. Sci. U. S. A. 104 (50), 19773-19777 (2007).
- Merritt, M. E., Harrison, C., Storey, C., Sherry, A. D., Malloy, C. R. Inhibition of carbohydrate oxidation during the first minute of reperfusion after brief ischemia NMR detection of hyperpolarized 13CO2 and H13CO3-. Magn. Reson. Med. 60 (5), 1029-1036 (2008).
- Hu, S., Chen, A. P., et al. In vivo carbon-13 dynamic MRS and MRSI of normal and fasted rat liver with hyperpolarized 13C-pyruvate. Mol. imaging Biol. MIB Off. Publ. Acad. Mol. Imaging. 11 (6), 399-407 (2009).
- Kohler, S. J., Yen, Y., et al. In vivo 13 carbon metabolic imaging at 3T with hyperpolarized 13C-1-pyruvate. Magn. Reson. Med. 58 (1), 65-69 (2007).
- Hu, S., Lustig, M., et al. 3D compressed sensing for highly accelerated hyperpolarized (13)C MRSI with in vivo applications to transgenic mouse models of cancer. Magn. Reson. Med. 63 (2), 312-321 (2010).
- Kurhanewicz, J., Vigneron, D. B., et al. Analysis of cancer metabolism by imaging hyperpolarized nuclei: prospects for translation to clinical research. Neoplasia. 13 (2), 81-97 (2011).
- Schroeder, M. A., Cochlin, L. E., Heather, L. C., Clarke, K., Radda, G. K., Tyler, D. J. In vivo assessment of pyruvate dehydrogenase flux in the heart using hyperpolarized carbon-13 magnetic resonance. Proc. Natl. Acad. Sci. U. S. A. 105 (33), 12051-12056 (2008).
- Zierhut, M. L., Yen, Y. -. F., et al. Kinetic modeling of hyperpolarized 13C1-pyruvate metabolism in normal rats and TRAMP mice. J. Magn. Reson. 202 (1), 85-92 (2010).
- Dennis, L. K., Resnick, M. I. Analysis of recent trends in prostate cancer incidence and mortality. Prostate. 42 (4), 247-252 (2000).
- Jambor, I., Borra, R., et al. Functional imaging of localized prostate cancer aggressiveness using 11C-acetate PET/CT and 1H-MR spectroscopy. J. Nucl. Med. 51 (11), 1676-1683 (2010).
- Presti, J. C. J., Hricak, H., Narayan, P. A., Shinohara, K., White, S., Carroll, P. R. Local staging of prostatic carcinoma: comparison of transrectal sonography and endorectal MR imaging. AJR. Am. J. Roentgenol. 166 (1), 103-108 (1996).
- Schulte, R. F., Sacolick, L., et al. Transmit gain calibration for nonproton MR using the Bloch-Siegert shift. NMR Biomed. 24 (9), 1068-1072 (2011).
- Durst, M., Koellisch, U., et al. Comparison of acquisition schemes for hyperpolarised (1)(3)C imaging. NMR Biomed. 28 (6), 715-725 (2015).
- Janich, M. A., Menzel, M. I., et al. Effects of pyruvate dose on in vivo metabolism and quantification of hyperpolarized (1)(3)C spectra. NMR Biomed. 25 (1), 142-151 (2012).
- Harrison, C., Yang, C., et al. Comparison of kinetic models for analysis of pyruvate-to-lactate exchange by hyperpolarized 13 C NMR. NMR Biomed. 25 (11), 1286-1294 (2012).
- Gómez Damián, P. A., Sperl, J. I., et al. Multisite Kinetic Modeling of (13)C Metabolic MR Using [1-(13)C]Pyruvate. Radiol. Res. Pract. 2014, (2014).
- Talbot, J. -. N., Gutman, F., et al. PET/CT in patients with hepatocellular carcinoma using [(18)F]fluorocholine: preliminary comparison with [(18)F]FDG PET/CT. Eur. J. Nucl. Med. Mol. Imaging. 33 (11), 1285-1289 (2006).
- Reeder, S. B., Pineda, A. R., et al. Iterative decomposition of water and fat with echo asymmetry and least-squares estimation (IDEAL): application with fast spin-echo imaging. Magn. Reson. Med. 54 (3), 636-644 (2005).
- Laustsen, C., Ostergaard, J. A., et al. Assessment of early diabetic renal changes with hyperpolarized [1-(13) C]pyruvate. Diabetes. Metab. Res. Rev. 29 (2), 125-129 (2013).
- Serrao, E. M., Brindle, K. M. Potential Clinical Roles for Metabolic Imaging with Hyperpolarized [1-(13)C]Pyruvate. Front. Oncol. 6, 59 (2016).

