hyperpolarisiertem<sup> 13</sup> C Metabolic Magnetic Resonance Spectroscopy and Imaging
Summary
Dynamic nuclear polarization with subsequent sample dissolution has enabled real-time studies of metabolism in biological systems. Hyperpolarized [1-13C]pyruvate was used to study lactate dehydrogenase activity in a prostate carcinoma cell line in vitro.
Abstract
In den vergangenen Jahrzehnten wurden neue Methoden zur Tumor – Staging, Restaging, Ansprechen auf die Behandlung Überwachung, und ein erneutes Auftreten Nachweis einer Vielzahl von Krebserkrankungen haben in Verbindung mit dem state-of-the-art – Positronen – Emissions – Tomographie mit 18 F-fluorodeoxyglucose ([18 F entstanden ] -FDG PET). 13 C – Magnetresonanz – spektroskopischen Bildgebung (13 CMRSI) ist eine minimal invasive Bildgebungsverfahren, das die Überwachung des Stoffwechsels in vivo und in Echtzeit ermöglicht. Wie bei jedem anderen Verfahren , basierend auf 13 C kernmagnetische Resonanz (NMR), steht sie vor der Herausforderung mit niedriger thermischer Polarisation und einer anschließenden geringen Signal-zu-Rausch – Verhältnis aufgrund des relativ niedrigen gyromagnetische Verhältnis von 13 C und seiner geringen natürlichen Häufigkeit in biologischen Proben. Durch Überwindung hat diese Beschränkungen, dynamische Kernpolarisation (DNP) mit anschließender Probenauflösungs kürzlich häufig verwendeten NMR und Kernspintomographie (MRI) -Systeme zur Messung aktiviert, Studium und Bild Schlüssel Stoffwechselwege in verschiedenen biologischen Systemen. Ein besonders interessantes und vielversprechendes Molekül in 13 CMRSI verwendete [1- 13 C] Pyruvat, die in den letzten zehn Jahren wurde für in vitro, preclinical weithin verwendet worden, und in jüngster Zeit , klinische Studien der zellulären Energiestoffwechsels zu untersuchen bei Krebs und anderen Krankheiten. In diesem Artikel erläutern wir die Technik der Auflösung DNP unter Verwendung eines 3,35 T präklinische DNP Hyperpolarisierer und zeigen seine Verwendung in In – vitro – Studien. Ein ähnliches Protokoll für die Hyperpolarisation kann auch zum größten Teil in in – vivo – Untersuchungen angewendet werden. Dazu verwendeten wir Lactat – Dehydrogenase (LDH) und katalysiert die metabolische Reaktion von [1- 13 C] Pyruvat [1- 13 C] Lactat in einer Prostatakarzinomzelllinie PC3, in vitro unter Verwendung von 13 CMRSI.
Introduction
Gegenwärtig ist die am weitesten verbreitete klinische Methode für Tumor – Staging, Restaging, Ansprechen auf die Behandlung Überwachung und Rezidiverkennung von einer Vielzahl von Krebserkrankungen [18 F] -FDG PET. 1 jedoch in jüngster Zeit mehrere neue und alternative Ansätze entstanden. Eine dieser Methoden ist 13 CMRSI. Diese Technik beinhaltet die Einführung des 13 C-Moleküls in einer biologischen Probe, durch minimal invasive MRI folgte dem Stoffwechsel in vitro oder in vivo in Echtzeit zu bewerten. Dennoch ist die größte Herausforderung von 13 CMRSI, im Vergleich zu den anderen Verfahren, wie [18 F] -FDG PET oder Computertomographie, ist seine niedrige Signal-zu-Rausch – Verhältnis.
Das NMR – Signal ist direkt proportional zu der Ebene der Polarisation, ein Verhältnis der Spin ½ Keimpopulation Differenz in zwei Energiezustände an der Gesamtbevölkerung (1A). Die Polarisation ist ein Produkt der the gyromagnetische Verhältnis (γ) der Kerne und das Magnetfeld angelegt Festigkeit über der Temperatur. Eine typische Polarisations von 1 H – Kerne ist in der Größenordnung von 0,001% bis 0,005% bei 3 T, das ein relativ schlechtes Signal-Rausch – Verhältnis ergibt. Heutigen state-of-the-art MRI hat nur eine erfolgreiche Bildgebungsverfahren gewesen aufgrund der hohen Fülle von 1 H in biologischen Proben und der hohen gyromagnetischen Verhältnis von 1 H (& gamma; 1H = 42,576 MHz / T). Jedoch beobachtet andere Kerne, wie beispielsweise Kohlenstoff, ist anspruchsvoller. Der einzige stabile, magnetisch aktiven Kohlenstoffisotops 13 C, macht nur 1,1% aller Kohlenstoffatome. Darüber hinaus ist die gyromagnetische Verhältnis von 13 C (γ 13C = 10,705 MHz / T) ist viermal geringer als die von 1 H, zu einer niedrigeren Nachweiseffizienz führt. Insgesamt verursachen die niedrigen 13 C Fülle und niedrige γ 13C Wärme 13 C – Messungen 0,0176% der Empfindlichkeit eines 1 zu erreichen ,H-NMR – Messung in vivo.
Dynamische Kernpolarisation
Eine Methode , um die relativ geringe Empfindlichkeit von 13 C – Messungen zu überwinden , ist DNP. Es wurde ursprünglich im Jahre 1953 von Albert W. Overhauser- für Metalle beschrieben. In seinem Artikel, er sagte: "Es wird gezeigt , dass , wenn die Elektronenspinresonanz der Leitungselektronen gesättigt ist, werden die Kerne in gleichem Maße polarisiert werden sie , wenn ihr gyromagnetische Verhältnis , dass waren der Elektronenspin sein würde." 2 Später in diesem Jahr, Carver und Slichter experimentell bestätigt Overhauser- Hypothese 3. Im Jahr 1958 beschrieben Abragam und Proctor diesen Effekt für Elektronen in Flüssigkeiten und nannte sie die "solid-Effekt." Bei Temperaturen unterhalb von 4 K, Elektronenspinpolarisation erreicht fast 100% und mehr als drei Grßenordnungen höher als die Kernspinpolarisation (1B) 4. Tseine tritt auf, weil das gyromagnetische Verhältnis des Elektrons (γ e = 28.024,944 MHz / T) um drei Größenordnungen höher ist als die Kern gyromagnetischen Verhältnisse. Die schwachen Wechselwirkungen zwischen Elektronen und Kernen, wie beispielsweise die Overhauser-Effekt, der festen Wirkung, den Quereffekt und der thermischen Mischwirkung ermöglichen die Übertragung der Polarisation von Elektronen an Kernspins dreht unter Verwendung von Mikrowellenbestrahlung mit einer Frequenz nahe der entsprechenden Elektronen Spinresonanz (EPR) Frequenz 5,6. DNP Theorie wurde weiterentwickelt mehr Elektronen und thermische Vermischung einzubeziehen. Trotzdem bisher wurde 7,8 veröffentlicht keine einheitliche quantitative theoretische Beschreibung von DNP.
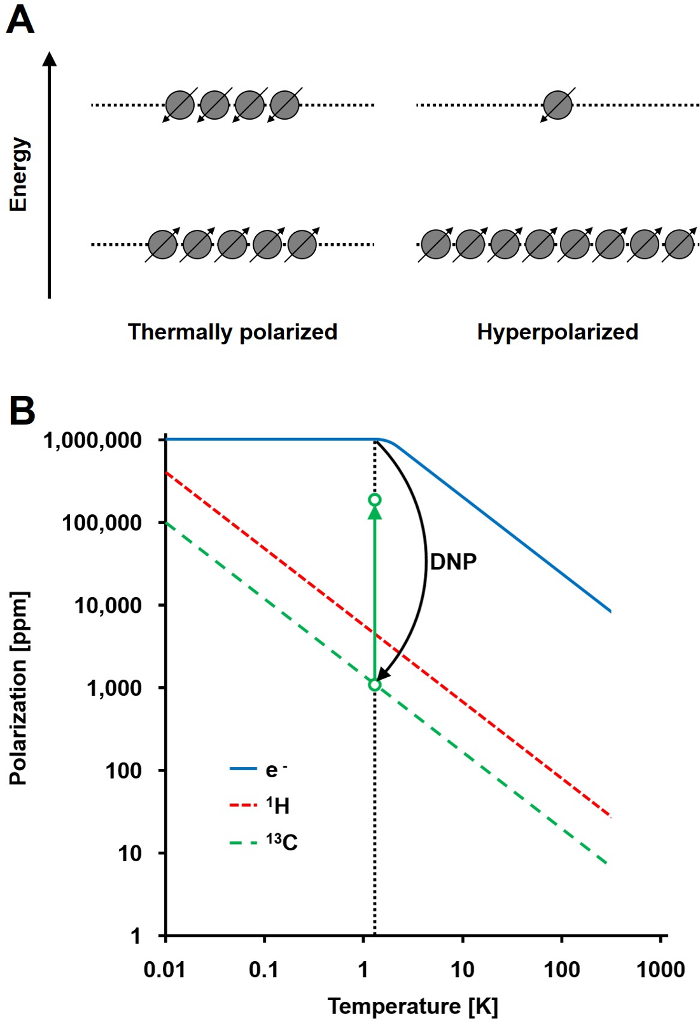
Abbildung 1: Dynamische Kernpolarisation und Hyperpolarisation zu verstehen. A) Ein schematischer Vergleich der Spinpopulationim thermischen Gleichgewicht Polarisationszustand und dem hyperpolarisierten Zustand. B) Die Polarisation ist abhängig von der Temperatur. Die Polarisation eines Elektrons (e -) erreicht 100% unter 1,4 K. Die DNP ermöglicht den Transfer der Polarisation von dem e- an die 13 C – Kerne, die bis zu 10 5 -fache ihrer Polarisation erhöht. Bitte klicken Sie hier , um eine größere Version dieser Figur zu sehen.
DNP in Studien von biologischen Systemen Auflösung entwickelt hatte , werden unter Verwendung von 13 C – NMR, anschließende schnelle Probe einzuführen. 50 Jahre nach Overhauser- Hypothese, Jan H. Ardenkjaer-Larsen et al. löste das technisch anspruchsvolle Ausgabe 6 das hyperpolarisierte gefrorene Probe in den flüssigen Zustand mit einem minimalen Verlust von Hyperpolarisation zu bringen. Die Auflösung DNP eröffnet ein neues Forschungsgebiet 13 CMRS genanntI, die Bereitstellung eines neuen Verfahrens zu untersuchen und zu verschiedenen Krankheitszuständen 9,10 charakterisieren. Als stabile Träger eines ungepaarten Elektrons, ein Tritylrest Tris (8-carboxy-2,2,6,6-tetra (hydroxyethyl) -benzo- [1,2-4,5] -bis- (1,3) -dithiole-4-yl) methyl-Natriumsalz (OX063) oder (2,2,6,6-tetramethylpiperidin-1-yl) oxyl (TEMPO) wird üblicherweise verwendet. Diese werden mit der gewünschten 13 C-markiertes Molekül vermischt und ausgesetzt einer Mikrowellenbestrahlung mit einer Frequenz nahe der entsprechenden EPR – Frequenz. Unter Verwendung dieser Technik kann die Polarisation von 13 C – Kerne erhöht werden bis zu 37% 11. Dies führt zu einem 10 5 -fachen Polarisations Verbesserung gegenüber dem thermischen Gleichgewicht Polarisations 11,12. Jedoch, sobald die Mikrowellenbestrahlung gestoppt wird und / oder dem 13 C-Molekül in den flüssigen Zustand überführt wird, fällt die Polarisations mit der longitudinalen Relaxationszeit (T 1) des 13 C – Kern , die polarisiert wurde. Und so kam es dass derErfindung der schnellen Auflösung Techniken oder jede nachfolgende Technik die Zeit vor dem experimentellen Messung Verkürzung (dh Injektion) für biologische Anwendungen 13 von entscheidender Bedeutung ist.
Es gibt drei wichtige Anforderungen , die das Kandidatenmolekül für eine erfolgreiche 13 CMRSI Studien erfüllen muss. Erstens hat der 13 C – Kern von Interesse eine ausreichend lange T 1 haben (> 10 s). Die Wahl der 13 C-Markierung ist von entscheidender Bedeutung. Die besten Kandidaten Kerne sind Kohlenstoffe ohne direkten Kontakt mit 1 H-Kerne über eine Bindung. Es muss auch schnell innerhalb von 2 metabolisiert werden – 3 T 1 Mal in einem nachgeschalteten Stoffwechselprodukt entstehende mit deutlich unterschiedlichen chemischen Verschiebung von der ursprünglichen Substanz. Das Gemisch Probe muss auch ein amorphes Glas , wenn es in einem festen Zustand bilden , so daß die räumliche Verteilung des Abstandes zwischen dem Elektron und 13 C abnimmt, so dass die transfer der Polarisation. Wenn das Kandidatenmolekül natürlicherweise nicht amorphes Glas bilden, muss sie sehr gut löslich in einem Verglasungsmittel sein, wie Glycerin oder Dimethylsulfoxid 14. Diese Anforderungen führen zu einer relativ geringen Anzahl von Kandidatenmolekülen. Aber auch nach dem erfolgreichen Entdeckung eines geeigneten Moleküls kann ein Arbeitsprotokoll für Hyperpolarisation der Entwicklung technisch anspruchs 9,14,15.
Erfolgreich polarisiert, wie [1- 13 C] Pyruvat 12,16 In den letzten Jahren wurden mehrere Substrate gewesen – 36 [2- 13 C] Pyruvat – 37, [1- 13 C] Ethylpyruvat 38, [1- 13 C ] Lactat 39, [1- 13 C] Fumarat 40-43, 13 C-Bicarbonat 36,44,45, [1- 13 C] Natriumacetat 43,46 – 49, 13 C-Harnstoff – 6,36,50,51 [5- 13 C] glutamine 15,52,53, [1- 13 C] Glutamat 53,54, [1- 13 C] 2-Oxoglutarat 55, [1- 13 C] Alanin und andere 14,56. Eine besonders interessante und häufig verwendete Substrat für die Hyperpolarisation ist [1- 13 C] Pyruvat. Es ist weit verbreitet in der präklinischen Studien 14,17,22 der zellulären Energiestoffwechsel bei verschiedenen Erkrankungen zu untersuchen. [1- 13 C] Pyruvat erfüllt alle Anforderungen für eine erfolgreiche Hyperpolarisation, einschließlich einer relativ langen T 1 und schnellen Transport über die Zellmembran , bevor anschließend metabolisiert wird. Präklinische Studien mit [1- 13 C] Pyruvat sind zur Zeit in der Klinik 57 übersetzt.
Metabolismus von Pyruvat
Es ist bekannt, dass es eine direkte Verbindung zwischen Mutationen in einem Krebszellen DNA und Veränderungen in ihrer Stoffwechselwege ist. Bereits in den 1920er Jahren, Otto Warburg DiscovEred , dass es in Tumoren im Vergleich zu gesundem Gewebe 58 einen erhöhten Stoffwechsel von Glukose und Produktion von Laktat – 60. Anschließend verschiedene Änderungen in anderen Stoffwechselwegen, wie dem Pentose-Phosphat-Weg, den Tricarbonsäurezyklus, oxidative Phosphorylierung und die Synthese von Nukleotiden und Lipiden, sind beschrieben worden.
Pyruvat ist das Endprodukt der Glykolyse. Im Tumor, erfährt er anaerobe Glycolyse von LDH katalysierte 61 und reagiert mit der reduzierten Form des Nicotinamid – adenin – dinucleotid – Coenzym (NADH), was zu Laktat und der oxidierten Form des Coenzyms (NAD +). Alternativ erfährt Pyruvat eine Transaminierung mit Glutamat Alanin zu bilden, durch die Alanin-Transaminase katalysierte (ALT). Beide Reaktionen sind leicht reversibel. Pyruvat erfährt auch Decarboxylierung von Pyruvat-Dehydrogenase katalysiert (PDH) zu Kohlendioxid und Acetyl-CoA, reine irreversible Reaktion in diesem Schritt epresenting. Abwechslungen in diesen Reaktionsraten können auf Tumormetabolismus 17,21,22,25,62 verknüpft werden. Die Stoffwechselwege sind in Figur 2 zusammengefasst.

Abbildung 2: Schematische Darstellung der wichtigsten Stoffwechselreaktion von Pyruvat. Pyruvat / Laktat-Umwandlung wird durch LDH katalysiert, und Pyruvat / Alanin Umwandlung wird durch ALT katalysiert. Pyruvat wird irreversibel an Acetyl-CoA und CO 2 durch PDH umgewandelt und CO 2 in einem pH-abhängigen Gleichgewicht mit Bicarbonat 80. Bitte klicken Sie hier , um eine größere Version dieser Figur zu sehen.
Der Nachweis von hyperpolarisiertem [1- 13 C] Pyruvats und seiner Metaboliten wurde in der Ratte zuvor gezeigt erKunst 37,63 – 65, Leber 66, Muskel und Niere 62,67. Eine Studie zeigte signifikante Unterschiede in der Lactat-zu-Alanin – Verhältnis zwischen der normalen und fasteten Rattenleber 66 und zeigten eine stark erhöhte und hyperpolarisiertem [1- 13 C] Laktatspiegel in Leberkrebs 68,69. Es gibt Anzeichen dafür , dass die Tumorgrad kann in einem transgenen Maus – Adenokarzinom der Prostata (TRAMP) unter Verwendung von hyperpolarisiertem [1- 13 C] Pyruvat – 22, mit dem hyperpolarisierten Laktatspiegel zeigt , die eine hohe Korrelation mit dem histologischen Grad der herausgeschnittenen Tumoren identifiziert werden. Das Alanin aus Pyruvat durch ALT katalysiert wurde auch als ein nützlicher Marker in rat hepatozellulären Karzinoms 23 vorgeschlagen.
Messung der Pyruvat-Lactat metabolischen Flusses wurde zur Überwachung Ischämie 63,65,70 und als Reaktion auf die Behandlung mit einer zytotoxischen Chemotherapie 17,40, zielgerichtete Medikamente verwendet <sup> 24,25,41 oder Strahlentherapie 26 in Tiermodellen. Es wurde auch für den Nachweis der Phosphatidylinositol – 3-Kinase (PI3K) -Inhibitor LY294002 Reaktion in Glioblastom und Brustkrebs Mausmodellen 25 verwendet. Veränderungen im Pyruvatstoffwechsels bei Hirntumoren 26 und Prostatakrebs 24,71 haben auch nach der Behandlung beobachtet.
Prostatakarzinom
Das Prostatakarzinom ist die vorherrschende Krebs bei älteren Männern und der zweite bei Männern weltweit 72 zum Tode im Zusammenhang mit führenden Krebs. Bisher wurden keine zuverlässigen, nicht-invasive Methoden zur Verfügung , für eine frühe Diagnose und Charakterisierung von Prostata – Krebs 73,74, die dringende Notwendigkeit für neuartige metabolische Bildgebung Techniken betont strenge Erkennung und Durchführung von Patienten zu ermöglichen. Das Prostatakarzinom wurde als Modell verwendet , mit 13 CMRSI in Patienten kombiniert die Möglichkeiten der Auflösung DNP zu demonstrierens 57. Diese Arbeit wurde in einer ersten klinischen Studie unter Verwendung fortgesetzt [1- 13 C] Pyruvat und 13 CMRSI für die Abbildung von Prostatakrebs, und es hat gerade abgeschlossen kürzlich (NCT01229618).
Die Motivation hinter dieser Arbeit war die Anwendung der 13 CMRSI Methode in einer präklinischen Einstellung mit Zellen im Detail und für ein breiteres Publikum zu illustrieren. Messung der LDH-katalysierten Metabolismus von [1- 13 C] Pyruvat [1- 13 C] Lactat in vitro in der PC3 Prostata – Karzinom – Zelllinie, zeigen wir die mögliche Anwendung der Auflösungs DNP in in vitro – Studien und adressieren die entscheidenden Schritte und Herausforderungen während der Experimente.
Protocol
Representative Results
Discussion
13 CMRSI mit hyperpolarisiertem Sonden ist ein vielversprechendes Verfahren Metabolismus in Echtzeit in vitro zu überwachen und in vivo. Ein sehr wichtiger Aspekt , wenn dieses experimentelle Verfahren verwendet , ist die richtige Standardisierung, insbesondere in – vitro – Experimente in Bezug auf . Erstens muss die Vorbereitung der Probe richtig durchgeführt werden, und stets die gleiche Konzentration von hyperpolarisiertem Material in jedem Versuch zu erzielen. Dies er…
Disclosures
The authors have nothing to disclose.
Acknowledgements
E.K. gratefully acknowledges the support of the Graduate School of Bioengineering (GSB) at Technische Universität München. This work was supported by the German Research Foundation (DFG) within the SFB Collaborative Research Center 824, “Imaging for Selection, Monitoring, and Individualization of Cancer Therapies.”
Materials
| HyperSense DNP Polariser | Oxford Instruments | 3.35 T preclinical DNP hyperpolarizer | |
| GE/Agilent MR901 | GE Healthcare/Agilent Technologies | 7 T preclinical MRI scanner, with small bore designed for experiments onrodent | |
| Spinsolve Carbon | Magritek | 1 T NMR spectrometer with permanent magnet | |
| Deuterium Oxide | Sigma Aldrich | 7789-20-0 | |
| Sodium phosphate dibasic | Sigma Aldrich | 7558-79-4 | |
| Sodium phosphate monbasic | Sigma Aldrich | 7558-80-7 | |
| Sodium hydroxide | Sigma Aldrich | 1310-73-2 | |
| Disodium edetate | Sigma Aldrich | 6381-92-6 | |
| Pyruvic acid – 13C1 | Cambridge Isotopes Laboratories | CLM-8077-1 | |
| Dotarem (0.5 mmol/L) | Guerbet | gadoterate meglumine | |
| tris (8-carboxy-2,2,6,6-tetra-(hydroxyethyl)-benzo-[1,2–4,5]-bis-(1,3)-dithiole-4-yl)-methyl sodium salt (OX063) | GE Healthcare | trityl radical used as a sourse of free electron | |
| PC3 cell line | ATCC | CRL1435 | |
| F-12K medium | ATCC | 30-2004 | |
| Fetal Bovine Serum | ATCC | SCRR-30-2020 | |
| Trypsine-EDTA Solution, 1X | ATCC | 30-2101 | |
| Sample plastic cup | Oxford Instruments | ||
| Trypan blue | Bio-Rad | 145-0013-MSDS |
References
- Rohren, E. M., Turkington, T. G., Coleman, R. E. Clinical applications of PET in oncology. Radiology. 231 (2), 305-332 (2004).
- Overhauser, A. W. Polarization of Nuclei in Metals. Phys. Rev. 92 (2), 411-415 (1953).
- Carver, T. R., Slichter, C. P. Polarization of Nuclear Spins in Metals. Phys. Rev. 92 (1), 212-213 (1953).
- Abragam, A., Proctor, W. G. Spin Temperature. Phys. Rev. 109 (5), 1441-1458 (1958).
- Abragam, a., Goldman, M. Principles of dynamic nuclear polarisation. Reports Prog. Phys. 41 (3), 395-467 (2001).
- Ardenkjaer-Larsen, J. H., Fridlund, B., et al. Increase in signal-to-noise ratio of > 10,000 times in liquid-state NMR. Proc. Natl. Acad. Sci. U. S. A. 100 (18), 10158-10163 (2003).
- Shimon, D., Hovav, Y., Feintuch, A., Goldfarb, D., Vega, S. Dynamic nuclear polarization in the solid state: a transition between the cross effect and the solid effect. Phys. Chem. Chem. Phys. 14 (16), 5729-5743 (2012).
- Serra, S. C., Rosso, A., Tedoldi, F. Electron and nuclear spin dynamics in the thermal mixing model of dynamic nuclear polarization. Phys. Chem. Chem. Phys. 14 (38), 13299-13308 (2012).
- Gallagher, F. A., Kettunen, M. I., Brindle, K. M. Biomedical applications of hyperpolarized 13C magnetic resonance imaging. Prog. Nucl. Magn. Reson. Spectrosc. 55 (4), 285-295 (2009).
- Hurd, R. E., Yen, Y. -. F., Chen, A., Ardenkjaer-Larsen, J. H. Hyperpolarized 13C metabolic imaging using dissolution dynamic nuclear polarization. J. Magn. Reson. Imaging. 36 (6), 1314-1328 (2012).
- Ardenkjaer-Larsen, J. H., Fridlund, B., et al. Increase in signal-to-noise ratio of > 10,000 times in liquid-state NMR. Proc. Natl. Acad. Sci. U. S. A. 100 (18), 10158-10163 (2003).
- Golman, K., in’t Zandt, R., Thaning, M. Real-time metabolic imaging. Proc. Natl. Acad. Sci. 103 (30), 11270-11275 (2006).
- Comment, A., Rentsch, J., et al. Producing over 100 ml of highly concentrated hyperpolarized solution by means of dissolution DNP. J. Magn. Reson. 194 (1), 152-155 (2008).
- Brindle, K. M., Bohndiek, S. E., Gallagher, F. A., Kettunen, M. I. Tumor imaging using hyperpolarized 13C magnetic resonance spectroscopy. Magn. Reson. Med. 66 (2), 505-519 (2011).
- Gallagher, F. A., Kettunen, M. I., Day, S. E., Lerche, M., Brindle, K. M. 13C MR spectroscopy measurements of glutaminase activity in human hepatocellular carcinoma cells using hyperpolarized 13C-labeled glutamine. Magn. Reson. Med. 60 (2), 253-257 (2008).
- Chen, A. P., Albers, M. J., et al. Hyperpolarized C-13 spectroscopic imaging of the TRAMP mouse at 3T-initial experience. Magn. Reson. Med. 58 (6), 1099-1106 (2007).
- Day, S. E., Kettunen, M. I., et al. Detecting tumor response to treatment using hyperpolarized 13C magnetic resonance imaging and spectroscopy. Nat. Med. 13 (11), 1382-1387 (2007).
- Schroeder, M. A., Swietach, P., et al. Measuring intracellular pH in the heart using hyperpolarized carbon dioxide and bicarbonate: a 13C and 31P magnetic resonance spectroscopy study. Cardiovasc. Res. 86 (1), 82-91 (2010).
- Hurd, R. E., Yen, Y. -. F., Tropp, J., Pfefferbaum, A., Spielman, D. M., Mayer, D. Cerebral dynamics and metabolism of hyperpolarized [1-(13)C]pyruvate using time-resolved MR spectroscopic imaging. J. Cereb. Blood Flow Metab. 30 (13), 1734-1741 (2010).
- Golman, K., Zandt, R. I., Lerche, M., Pehrson, R., Ardenkjaer-Larsen, J. H. Metabolic imaging by hyperpolarized 13C magnetic resonance imaging for in vivo tumor diagnosis. Cancer Res. 66 (22), 10855-10860 (2006).
- Park, I., Larson, P. E. Z., et al. Hyperpolarized 13C magnetic resonance metabolic imaging: application to brain tumors. Neuro. Oncol. 12 (2), 133-144 (2010).
- Albers, M. J., Bok, R., et al. Hyperpolarized 13C lactate, pyruvate, and alanine: noninvasive biomarkers for prostate cancer detection and grading. Cancer Res. 68 (20), 8607-8615 (2008).
- Yen, Y. -. F., Le Roux, P., et al. T(2) relaxation times of (13)C metabolites in a rat hepatocellular carcinoma model measured in vivo using (13)C-MRS of hyperpolarized [1-(13)C]pyruvate. NMR Biomed. 23 (4), 414-423 (2010).
- Dafni, H., Larson, P. E. Z., et al. Hyperpolarized 13C spectroscopic imaging informs on hypoxia-inducible factor-1 and myc activity downstream of platelet-derived growth factor receptor. Cancer Res. 70 (19), 7400-7410 (2010).
- Ward, C. S., Venkatesh, H. S., et al. Noninvasive detection of target modulation following phosphatidylinositol 3-kinase inhibition using hyperpolarized 13C magnetic resonance spectroscopy. Cancer Res. 70 (4), 1296-1305 (2010).
- Day, S. E., Kettunen, M. I., et al. Detecting response of rat C6 glioma tumors to radiotherapy using hyperpolarized [1- 13C]pyruvate and 13C magnetic resonance spectroscopic imaging. Magn. Reson. Med. 65 (2), 557-563 (2011).
- Johannesson, H., Macholl, S., Ardenkjaer-Larsen, J. H. Dynamic Nuclear Polarization of [1-13C]pyruvic acid at 4.6 tesla. J. Magn. Reson. 197 (2), 167-175 (2009).
- Durst, M., Koellisch, U., et al. Bolus tracking for improved metabolic imaging of hyperpolarised compounds. J. Magn. Reson. 243, 40-46 (2014).
- Khegai, O., Schulte, R. F., et al. Apparent rate constant mapping using hyperpolarized [1-(13)C]pyruvate. NMR Biomed. 27 (10), 1256-1265 (2014).
- Sogaard, L. V., Schilling, F., Janich, M. A., Menzel, M. I., Ardenkjaer-Larsen, J. H. In vivo measurement of apparent diffusion coefficients of hyperpolarized (1)(3)C-labeled metabolites. NMR Biomed. 27 (5), 561-569 (2014).
- Aquaro, G. D., Frijia, F., et al. 3D CMR mapping of metabolism by hyperpolarized 13C-pyruvate in ischemia-reperfusion. JACC. Cardiovasc. Imaging. 6 (6), 743-744 (2013).
- Menzel, M. I., Farrell, E. V., et al. Multimodal assessment of in vivo metabolism with hyperpolarized [1-13C]MR spectroscopy and 18F-FDG PET imaging in hepatocellular carcinoma tumor-bearing rats. J. Nucl. Med. 54 (7), 1113-1119 (2013).
- Schilling, F., Duwel, S., et al. Diffusion of hyperpolarized (13) C-metabolites in tumor cell spheroids using real-time NMR spectroscopy. NMR Biomed. 26 (5), 557-568 (2013).
- Schulte, R. F., Sperl, J. I., et al. Saturation-recovery metabolic-exchange rate imaging with hyperpolarized [1-13C] pyruvate using spectral-spatial excitation. Magn. Reson. Med. 69 (5), 1209-1216 (2013).
- Wiesinger, F., Weidl, E., et al. IDEAL spiral CSI for dynamic metabolic MR imaging of hyperpolarized [1-13C]pyruvate. Magn. Reson. Med. 68 (1), 8-16 (2012).
- Wilson, D. M., Keshari, K. R., et al. Multi-compound polarization by DNP allows simultaneous assessment of multiple enzymatic activities in vivo. J. Magn. Reson. 205 (1), 141-147 (2010).
- Schroeder, M. A., Atherton, H. J., et al. Real-time assessment of Krebs cycle metabolism using hyperpolarized 13C magnetic resonance spectroscopy. FASEB J. Off. Publ. Fed. Am. Soc. Exp. Biol. 23 (8), 2529-2538 (2009).
- Hurd, R. E., Yen, Y. -. F., et al. Metabolic imaging in the anesthetized rat brain using hyperpolarized [1-13C] pyruvate and [1-13C] ethyl pyruvate. Magn. Reson. Med. 63 (5), 1137-1143 (2010).
- Chen, A. P., Kurhanewicz, J., et al. Feasibility of using hyperpolarized [1-13C]lactate as a substrate for in vivo metabolic 13C MRSI studies. Magn. Reson. Imaging. 26 (6), 721-726 (2008).
- Witney, T. H., Kettunen, M. I., et al. Detecting treatment response in a model of human breast adenocarcinoma using hyperpolarised [1-(13)C]pyruvate and. Br. J. Cancer. 103 (9), 1400-1406 (2010).
- Bohndiek, S. E., Kettunen, M. I., et al. Detecting tumor response to a vascular disrupting agent using hyperpolarized (13)C magnetic resonance spectroscopy. Mol. Cancer Ther. 9 (12), 3278-3288 (2010).
- Gallagher, F. A., Kettunen, M. I., et al. Production of hyperpolarized [1,4-13C2]malate from [1,4-13C2]fumarate is a marker of cell necrosis and treatment response in tumors. Proc. Natl. Acad. Sci. U. S. A. 106 (47), 19801-19806 (2009).
- Jensen, P. R., Peitersen, T., et al. Tissue-specific short chain fatty acid metabolism and slow metabolic recovery after ischemia from hyperpolarized NMR in vivo. J. Biol. Chem. 284 (52), 36077-36082 (2009).
- Gallagher, F. A., Kettunen, M. I., et al. Magnetic resonance imaging of pH in vivo using hyperpolarized 13C-labelled bicarbonate. Nature. 453 (7197), 940-943 (2008).
- Scholz, D. J., Janich, M. A., et al. Quantified pH imaging with hyperpolarized 13C-bicarbonate. Magn. Reson. Med. 73 (6), 2274-2282 (2015).
- Koellisch, U., Gringeri, C. V., et al. Metabolic imaging of hyperpolarized [1-(13) C]acetate and [1-(13) C]acetylcarnitine – investigation of the influence of dobutamine induced stress. Magn. Reson. Med. 74 (4), 1011-1018 (2015).
- Koellisch, U., Laustsen, C., et al. Investigation of metabolic changes in STZ-induced diabetic rats with hyperpolarized [1-13C]acetate. Physiol. Rep. 3 (8), (2015).
- Jensen, P. R., Meier, S., Ardenkjaer-Larsen, J. H., Duus, J. O., Karlsson, M., Lerche, M. H. Detection of low-populated reaction intermediates with hyperpolarized NMR. Chem. Commun. (34), 5168-5170 (2009).
- Koelsch, B. L., Keshari, K. R., Peeters, T. H., Larson, P. E. Z., Wilson, D. M., Kurhanewicz, J. Diffusion MR of hyperpolarized 13C molecules in solution. Analyst. 138 (4), 1011-1014 (2013).
- Golman, K., Ardenkjaer-Larsen, J. H., Petersson, J. S., Mansson, S., Leunbach, I. Molecular imaging with endogenous substances. Proc. Natl. Acad. Sci. U. S. A. 100 (18), 10435-10439 (2003).
- von Morze, C., Larson, P. E. Z., et al. Imaging of Blood Flow Using Hyperpolarized [(13)C]Urea in Preclinical Cancer Models. J. Magn. Reson. Imaging. 33 (3), 692-697 (2011).
- Chiavazza, E., Kubala, E., et al. Earth’s magnetic field enabled scalar coupling relaxation of 13C nuclei bound to fast-relaxing quadrupolar 14N in amide groups. J. Magn. Reson. 227, 35-38 (2013).
- Jensen, P. R., Karlsson, M., Meier, S., Duus, J., Lerche, M. H. Hyperpolarized amino acids for in vivo assays of transaminase activity. Chem. – A Eur. J. 15 (39), 10010-10012 (2009).
- Gallagher, F. A., Kettunen, M. I., et al. Detection of tumor glutamate metabolism in vivo using 13C magnetic resonance spectroscopy and hyperpolarized [1-13C]glutamate. Magn. Reson. Med. 66 (1), 18-23 (2011).
- Chaumeil, M. M., Larson, P. E. Z., et al. Hyperpolarized [1-13C] glutamate: a metabolic imaging biomarker of IDH1 mutational status in glioma. Cancer Res. 74 (16), 4247-4257 (2014).
- Keshari, K. R., Wilson, D. M. Chemistry and biochemistry of 13C hyperpolarized magnetic resonance using dynamic nuclear polarization. Chem. Soc. Rev. 43 (5), 1627-1659 (2014).
- Nelson, S. J., Kurhanewicz, J., et al. Metabolic Imaging of Patients with Prostate Cancer Using Hyperpolarized [1-13C]Pyruvate. Sci. Transl. Med. 5 (198), (2013).
- Warburg, O. On the origin of cancer cells. Science. 123 (3191), 309-314 (1956).
- Warburg, O., Wind, F., Negelein, E. {Ü}ber den Stoffwechsel von Tumoren im K{ö}rper. Klin. Wochenschr. 5 (19), 829-832 (1926).
- Barnes, A. B., De Paepe, G., et al. High-Field Dynamic Nuclear Polarization for Solid and Solution. Biological NMR. Appl. Magn. Reson. 34 (3-4), 237-263 (2008).
- Koukourakis, M. I., Giatromanolaki, A., Sivridis, E., Gatter, K. C., Harris, A. L. Pyruvate dehydrogenase and pyruvate dehydrogenase kinase expression in non small cell lung cancer and tumor-associated stroma. Neoplasia. 7 (1), 1-6 (2005).
- Golman, K., Petersson, J. S. Metabolic Imaging and Other Applications of Hyperpolarized 13C1. Acad. Radiol. 13 (8), 932-942 (2016).
- Golman, K., Petersson, J. S., et al. Cardiac metabolism measured noninvasively by hyperpolarized 13C MRI. Magn. Reson. Med. 59 (5), 1005-1013 (2008).
- Merritt, M. E., Harrison, C., Storey, C., Jeffrey, F. M., Sherry, A. D., Malloy, C. R. Hyperpolarized 13C allows a direct measure of flux through a single enzyme-catalyzed step by NMR. Proc. Natl. Acad. Sci. U. S. A. 104 (50), 19773-19777 (2007).
- Merritt, M. E., Harrison, C., Storey, C., Sherry, A. D., Malloy, C. R. Inhibition of carbohydrate oxidation during the first minute of reperfusion after brief ischemia NMR detection of hyperpolarized 13CO2 and H13CO3-. Magn. Reson. Med. 60 (5), 1029-1036 (2008).
- Hu, S., Chen, A. P., et al. In vivo carbon-13 dynamic MRS and MRSI of normal and fasted rat liver with hyperpolarized 13C-pyruvate. Mol. imaging Biol. MIB Off. Publ. Acad. Mol. Imaging. 11 (6), 399-407 (2009).
- Kohler, S. J., Yen, Y., et al. In vivo 13 carbon metabolic imaging at 3T with hyperpolarized 13C-1-pyruvate. Magn. Reson. Med. 58 (1), 65-69 (2007).
- Hu, S., Lustig, M., et al. 3D compressed sensing for highly accelerated hyperpolarized (13)C MRSI with in vivo applications to transgenic mouse models of cancer. Magn. Reson. Med. 63 (2), 312-321 (2010).
- Kurhanewicz, J., Vigneron, D. B., et al. Analysis of cancer metabolism by imaging hyperpolarized nuclei: prospects for translation to clinical research. Neoplasia. 13 (2), 81-97 (2011).
- Schroeder, M. A., Cochlin, L. E., Heather, L. C., Clarke, K., Radda, G. K., Tyler, D. J. In vivo assessment of pyruvate dehydrogenase flux in the heart using hyperpolarized carbon-13 magnetic resonance. Proc. Natl. Acad. Sci. U. S. A. 105 (33), 12051-12056 (2008).
- Zierhut, M. L., Yen, Y. -. F., et al. Kinetic modeling of hyperpolarized 13C1-pyruvate metabolism in normal rats and TRAMP mice. J. Magn. Reson. 202 (1), 85-92 (2010).
- Dennis, L. K., Resnick, M. I. Analysis of recent trends in prostate cancer incidence and mortality. Prostate. 42 (4), 247-252 (2000).
- Jambor, I., Borra, R., et al. Functional imaging of localized prostate cancer aggressiveness using 11C-acetate PET/CT and 1H-MR spectroscopy. J. Nucl. Med. 51 (11), 1676-1683 (2010).
- Presti, J. C. J., Hricak, H., Narayan, P. A., Shinohara, K., White, S., Carroll, P. R. Local staging of prostatic carcinoma: comparison of transrectal sonography and endorectal MR imaging. AJR. Am. J. Roentgenol. 166 (1), 103-108 (1996).
- Schulte, R. F., Sacolick, L., et al. Transmit gain calibration for nonproton MR using the Bloch-Siegert shift. NMR Biomed. 24 (9), 1068-1072 (2011).
- Durst, M., Koellisch, U., et al. Comparison of acquisition schemes for hyperpolarised (1)(3)C imaging. NMR Biomed. 28 (6), 715-725 (2015).
- Janich, M. A., Menzel, M. I., et al. Effects of pyruvate dose on in vivo metabolism and quantification of hyperpolarized (1)(3)C spectra. NMR Biomed. 25 (1), 142-151 (2012).
- Harrison, C., Yang, C., et al. Comparison of kinetic models for analysis of pyruvate-to-lactate exchange by hyperpolarized 13 C NMR. NMR Biomed. 25 (11), 1286-1294 (2012).
- Gómez Damián, P. A., Sperl, J. I., et al. Multisite Kinetic Modeling of (13)C Metabolic MR Using [1-(13)C]Pyruvate. Radiol. Res. Pract. 2014, (2014).
- Talbot, J. -. N., Gutman, F., et al. PET/CT in patients with hepatocellular carcinoma using [(18)F]fluorocholine: preliminary comparison with [(18)F]FDG PET/CT. Eur. J. Nucl. Med. Mol. Imaging. 33 (11), 1285-1289 (2006).
- Reeder, S. B., Pineda, A. R., et al. Iterative decomposition of water and fat with echo asymmetry and least-squares estimation (IDEAL): application with fast spin-echo imaging. Magn. Reson. Med. 54 (3), 636-644 (2005).
- Laustsen, C., Ostergaard, J. A., et al. Assessment of early diabetic renal changes with hyperpolarized [1-(13) C]pyruvate. Diabetes. Metab. Res. Rev. 29 (2), 125-129 (2013).
- Serrao, E. M., Brindle, K. M. Potential Clinical Roles for Metabolic Imaging with Hyperpolarized [1-(13)C]Pyruvate. Front. Oncol. 6, 59 (2016).

