hiperpolarizado<sup> 13</sup> C Metabolic Espectroscopia de Ressonância Magnética e imagem
Summary
Dynamic nuclear polarization with subsequent sample dissolution has enabled real-time studies of metabolism in biological systems. Hyperpolarized [1-13C]pyruvate was used to study lactate dehydrogenase activity in a prostate carcinoma cell line in vitro.
Abstract
Nas últimas décadas, novos métodos para o estadiamento do tumor, reestadiamento, a monitorização da resposta ao tratamento e detecção de recorrência de uma variedade de cânceres têm surgido em conjunto com a tomografia por emissão de positrões state-of-the-art com 18 F-fluorodeoxyglucose ([18 F ] -FDG PET). 13 C espectroscópica imagiologia de ressonância magnética (13 CMRSI) é um método de imagem minimamente invasivo que permite o controlo do metabolismo in vivo e em tempo real. Tal como acontece com qualquer outro método com base em 13 C ressonância magnética nuclear (RMN), que enfrenta o desafio de baixa polarização térmica e uma subsequente baixa relação de sinal-para-ruído devido ao relativamente baixo rácio giromagnético de 13 C e a sua baixa abundância natural em amostras biológicas. Ao superar estas limitações, a polarização nuclear dinâmica (DNP) com a dissolução da amostra subsequente recentemente habilitado comumente usados sistemas de imagem por ressonância magnética (MRI) RMN e medir, Estudo, e chave vias metabólicas em vários sistemas biológicos. Uma molécula particularmente interessantes e promissoras utilizado em 13 CMRSI é [1- 13 C] piruvato, que, nos últimos dez anos, tem sido amplamente utilizada para in vitro, pré-clínicos, e, mais recentemente, estudos clínicos para investigar o metabolismo da energia celular em câncer e outras doenças. Neste artigo, vamos delinear a técnica de dissolução DNP usando um pré-clínico hiperpolarizadora DNP 3.35 T e demonstrar seu uso em estudos in vitro. Um protocolo semelhante para a hiperpolarização pode ser aplicado para a maior parte, em estudos in vivo, bem. Para isso, utilizou-se lactato desidrogenase (LDH) e a reacção catalisada metabólica de [1- 13 C] piruvato em lactato [1- 13 C] em uma linha de células de carcinoma da próstata, PC3, in vitro, utilizando 13 CMRSI.
Introduction
Presentemente, o método clínica mais amplamente utilizada para estadiamento do tumor, Reestadiamento, a monitorização da resposta ao tratamento e detecção de recorrência de uma ampla variedade de cancros é [18F] -FDG PET. 1 No entanto, recentemente, várias abordagens novas e alternativas têm surgido. Um desses métodos é de 13 CMRSI. Esta técnica envolve a introdução da molécula de C-13 em uma amostra biológica, seguido por MRI minimamente invasivo para avaliar o metabolismo in vitro ou in vivo em tempo real. No entanto, o maior desafio de 13 CMRSI, em comparação com os outros métodos, tais como [18F] -FDG PET ou tomografia computadorizada, é a sua baixa razão sinal-ruído.
O sinal de NMR é directamente proporcional ao nível de polarização, um rácio da diferença população spin ½ núcleos em dois estados de energia à população total (Figura 1A). A polarização é um produto do thrazão E giromagnético (γ) dos núcleos e a intensidade do campo magnético aplicado sobre a temperatura. Um típico de polarização 1H núcleos é na ordem de 0,001% para 0,005% a 3 T, o que dá uma proporção relativamente baixa de sinal-para-ruído. Hoje MRI state-of-the-art tem sido um método de imagem sucesso apenas devido à grande abundância de 1 H em amostras biológicas ea relação gyromagnetic alta de 1 H (y 1H = 42,576 MHz / T). No entanto, observando outros núcleos, tais como o carbono, é mais exigente. A única, de isótopos de carbono magneticamente ativo estável, 13 C, torna-se apenas 1,1% de todos os átomos de carbono. Além disso, o rácio giromagnético de 13 C (13C γ = 10,705 MHz / T) é quatro vezes menor do que a de um H, conduzindo a uma eficiência de detecção mais baixo. Em resumo, a baixa abundância de 13 C e 13 C γ baixo conduzir a medições 13 C térmicos para atingir 0,0176% da sensibilidade de um 1Medição H-RMN in vivo.
Polarização Nuclear dinâmica
Um método para ultrapassar a sensibilidade relativamente fraca de 13 medições C é DNP. Foi originalmente descrita para os metais em 1953 por Albert W. Overhauser. No seu artigo, ele afirma: "Verificou-se que, se a ressonância de spin electrónico dos electrões de condução é saturada, os núcleos irão ser polarizadas no mesmo grau que seria se a sua proporção giromagnética fosse o do spin do electrão." 2 Mais tarde Naquele ano, Carver e Slichter confirmada experimentalmente a hipótese de Overhauser 3. Em 1958, Abragam e Proctor descreveu este efeito para os elétrons em líquidos e nomeou-o "efeito sólido". A temperaturas inferiores a 4 K,-spin do electrão polarização atinge cerca de 100% e é mais do que três ordens de magnitude maior do que a polarização-spin nuclear (Figura 1B) 4. Tsua ocorre porque o rácio giromagnético do electrão (γ e = 28024,944 MHz / T) é três ordens de grandeza maior do que os rácios gyromagnetic nucleares. As interacções fracas entre electrões e núcleos, tais como o efeito de Overhauser, o efeito sólido, o efeito transversal, e o efeito de mistura térmica, permitir a transferência de polarização de electrões gira para spins nucleares utilizando a irradiação de microondas com uma frequência perto do electrão correspondente ressonância paramagnética (EPR) 5,6 frequência. teoria DNP tem sido desenvolvido para envolver mais elétrons e mistura térmica. No entanto, até à data, nenhuma descrição teórica quantitativa unificado de DNP foi publicado 7,8.
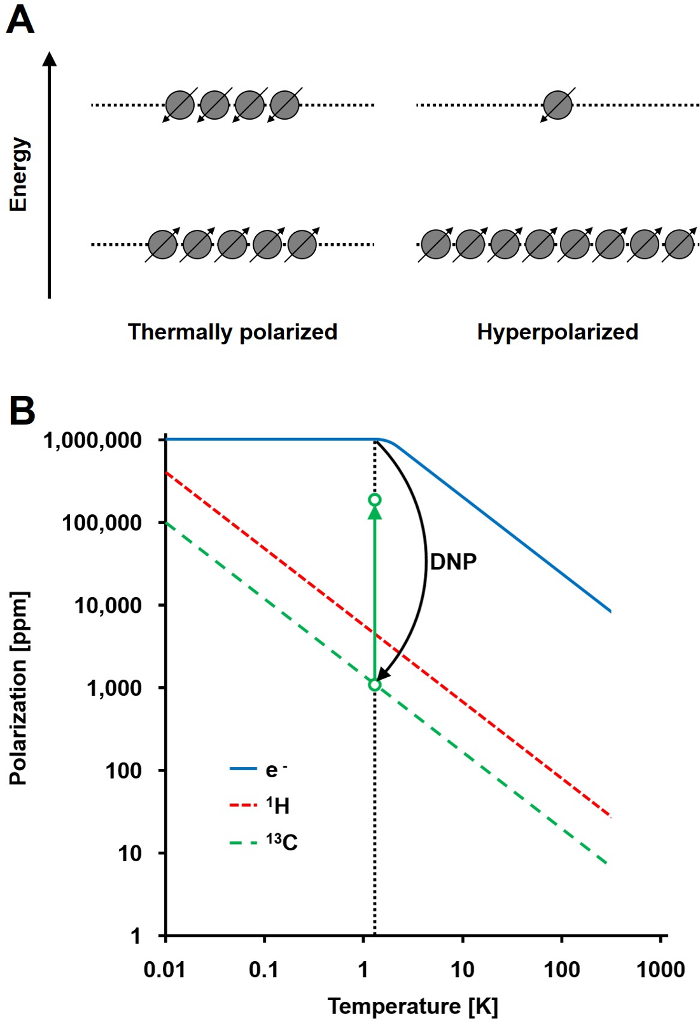
Figura 1: compreensão dinâmica Polarização Nuclear e Hiperpolarização. A) Uma comparação esquemática da população de spinno estado de equilíbrio polarização térmica e o estado hiperpolarizado. B) A polarização é dependente da temperatura. A polarização de um electrão (e -) atinge 100% abaixo de 1.4 K. O DNP permite a transferência da polarização do electrónico para os núcleos de 13 C, o que aumenta a sua polarização até 10 vezes de 5. Por favor clique aqui para ver uma versão maior desta figura.
Para introduzir DNP em estudos de sistemas biológicos utilizando 13 C RMN, subsequente dissolução rápida amostra tinha de ser desenvolvido. 50 anos após a hipótese de Overhauser, Jan H. Ardenkjaer-Larsen et al. resolveu a questão tecnicamente difícil de levar a amostra congelada hyperpolarized no estado líquido com perda mínima hiperpolarização 6. Dissolução DNP abriu um novo campo de pesquisa chamado 13 CMRSI, fornecendo um novo método para investigar e caracterizar vários estados de doença 9,10. como portadores estáveis de um elétron não emparelhado, a tritil tris radical (8-carboxi-2,2,6,6-tetra- (hidroxietil) -benzo- [1,2-4,5] -bis- (1,3) -dithiole-4-il) -metil sal de sódio (OX063) ou (2,2,6,6-tetrametilpiperidin-1-il) oxilo (TEMPO) é normalmente utilizado. Estes são misturados com a molécula desejada marcada com 13 C e exposto a irradiação de microondas com uma frequência perto da frequência de EPR correspondente. Usando esta técnica, a polarização dos núcleos de 13 C pode ser aumentada até 37% 11. Isto resulta num aumento de polarização 10 vezes de 5 em comparação com a polarização equilíbrio térmico 11,12. No entanto, logo que a irradiação de microondas é parado e / ou o C-13 molécula é transferida para o estado líquido, a polarização decai com o tempo de relaxamento longitudinal (T1) do núcleo 13 C, que foi polarizada. Assim, oinvenção de técnicas de rápida dissolução ou qualquer técnica subsequente redução do tempo antes da medição experimental (isto é, injecção) é crucial para aplicações biológicas 13.
Há três requisitos principais que a molécula candidato precisa cumprir para bem sucedidos 13 estudos CMRSI. Em primeiro lugar, o núcleo 13 C de interesse tem de ter um tempo suficientemente longo T 1 (> 10 s). A escolha da etiqueta C-13 é crucial. Os melhores núcleos candidatos são carbonos sem contacto directo com 1 H-núcleos através de uma ligação. Também tem de ser rapidamente metabolizado dentro de 2 – 3 vezes 1 T, resultando em um produto metabólico a jusante com um desvio químico muito diferente da substância original. A mistura da amostra deve também formar um vidro amorfo quando em estado sólido de modo a que a distribuição espacial diminui a distância entre o electrão e 13 C, permitindo que o transfer de polarização. Se a molécula candidata não formar vidro amorfo, naturalmente, que deve ser altamente solúvel em um agente de envidraçamento, tal como o glicerol ou o sulfóxido de dimetilo 14. Estes requisitos resultar num número relativamente pequeno de moléculas candidatas. No entanto, mesmo depois da descoberta bem sucedida de uma molécula adequada, o desenvolvimento de um protocolo de trabalho para a hiperpolarização pode ser tecnicamente exigente 9,14,15.
Nos últimos anos, vários substratos foram com sucesso polarizada, tal como [1- 13 C] piruvato 12,16 – 36, [2- 13 C] piruvato 37, [1- 13 C] etil piruvato 38, [1- 13 C ] lactato 39, [1- 13 C] fumarato 40 – 43, 13 C-bicarbonato 36,44,45, [1- 13 C] acetato de sódio 43,46 – 49, 13 C-ureia 6,36,50,51 , [5- 13 C] glutami15,52,53 NE, [1- 13 C] glutamato 53,54, [1- 13 C] 2-oxoglutarato 55, [1- 13 C] alanina, e outros 14,56. Um substrato particularmente interessante e utilizada para hiperpolarização é [1- 13 C] piruvato. É amplamente utilizada em estudos pré-clínicos para investigar a energia do metabolismo celular em várias doenças 14,17,22. [1- 13 C] piruvato preenche todos os requisitos para hiperpolarização bem sucedida, incluindo um transporte relativamente longo T 1 e rápida através da membrana celular antes posteriormente ser metabolizado. Estudos pré-clínicos com piruvato [1- 13 C] estão actualmente a ser traduzido para a clínica 57.
Metabolismo do piruvato
É bem conhecido que existe uma relação directa entre as mutações no DNA e alterações nas suas vias metabólicas de células cancerosas. Já na década de 1920, Otto Warburg Discovrado que há um aumento do metabolismo de glucose e produção de lactato em tumores em comparação com tecidos saudáveis 58-60. Subsequentemente, várias alternâncias em outras vias metabólicas, tais como a via de pentoses fosfato, o ciclo de ácido tricarboxílico, fosforilação oxidativa e da síntese de nucleótidos e lípidos, têm sido descritas.
O piruvato é o produto final da glicólise. No tumor, ele sofre da glicólise anaeróbia catalisada pela LDH 61 e reage com a forma reduzida da nicotinamida adenina dinucleótido coenzima (NADH), o que resulta em lactato e a forma oxidada da coenzima (NAD +). Alternativamente, o piruvato é submetido a uma reacção de transaminação com o glutamato para formar alanina, catalisada por transaminase alanina (ALT). Ambas as reacções são prontamente reversível. Piruvato também sofre descarboxilação catalisada pela desidrogenase de piruvato (PDH) para dióxido de carbono e acetil-CoA, representing uma reacção irreversível neste passo. Alternâncias nestas taxas de reacção pode ser ligada ao metabolismo do tumor 17,21,22,25,62. As vias metabólicas estão resumidos na Figura 2.

Figura 2: Diagrama das principais reacção metabólica do piruvato. / Conversão de lactato piruvato é catalisada pela LDH, e conversão de piruvato / alanina é catalisada por ALT. O piruvato é irreversivelmente convertida a acetil-CoA e de CO 2 por PDH, e CO 2 está num equilíbrio dependente do pH com bicarbonato de 80. Por favor clique aqui para ver uma versão maior desta figura.
A detecção de hiperpolarizado [1- 13 C] piruvato e seus metabolitos foi previamente demonstrada no rato, elearte 37,63 – 65, 66 fígado, músculo, rim e 62,67. Um estudo demonstrou diferenças significativas na relação lactato-to-alanina entre o fígado normal e em jejum de rato 66 e demonstraram um [1- 13 C] nível de lactato altamente elevada e hyperpolarized no cancro do fígado 68,69. Há evidências de que o grau do tumor pode ser identificada num adenocarcinoma transgénico da próstata de ratinho (TRAMP) usando hiperpolarizado piruvato [1- 13 C] 22, com os níveis de lactato hiperpolarizados que mostram uma elevada correlação com o grau histológico dos tumores excisados. A alanina a partir do piruvato catalisada por ALT foi também sugerida como um marcador útil no rato carcinoma hepatocelular 23.
Medindo o fluxo metabólico piruvato-lactato foi usado para monitorização isquemia 63,65,70 e como uma resposta ao tratamento com drogas citotóxicas quimioterapia 17,40, segmentados <sup> 24,25,41, 26 ou radioterapia em modelos animais. Também tem sido utilizado para a detecção do fosfatidilinositol 3-quinase (PI3K) inibidor da resposta LY294002 em glioblastoma e o cancro da mama modelos de ratos 25. Alterações no metabolismo do piruvato em tumores cerebrais 26 e o cancro da próstata 24,71 também foram observadas após o tratamento.
próstata Carcinoma
Carcinoma da próstata é o cancro predominante em homens idosos e o segundo câncer líder envolvidos na morte de homens em todo o mundo 72. Até o momento, não há métodos confiáveis e não-invasivos estão disponíveis para o diagnóstico precoce e caracterização de câncer de próstata 73,74, enfatizando a necessidade urgente de técnicas de imagem metabólica novos para permitir a detecção rigorosa e estadiamento dos pacientes. Carcinoma da próstata foi usado como um modelo para demonstrar as possibilidades da DNP dissolução combinados com 13 CMRSI no pacienteS 57. Este trabalho foi continuado em um primeiro ensaio clínico utilizando [1- 13 C] piruvato e 13 CMRSI para a imagem do câncer de próstata, e tem apenas recentemente foi concluída (NCT01229618).
A motivação por trás deste trabalho foi ilustrar em mais detalhe e para um público mais amplo a aplicação do método CMRSI 13 em um cenário pré-clínico com células. Medir o metabolismo catalisado-LDH de [1- 13 C] piruvato para [1- 13 C] lactato in vitro na linha de células de carcinoma da próstata PC3, demonstramos a eventual aplicação do DNP dissolução em estudos in vitro e abordar os passos cruciais e desafios durante os experimentos.
Protocol
Representative Results
Discussion
13 CMRSI com sondas hiperpolarizados é um método promissor para monitorizar em tempo real o metabolismo in vitro e in vivo. Um aspecto muito importante quando se emprega este processo experimental é a padronização adequada, especialmente em relação experimentos in vitro. Em primeiro lugar, a preparação da amostra tem de ser feito de forma adequada e consistente para conseguir a mesma concentração de material hiperpolarizado em cada experiência. Isto requer uma pesagem pr…
Disclosures
The authors have nothing to disclose.
Acknowledgements
E.K. gratefully acknowledges the support of the Graduate School of Bioengineering (GSB) at Technische Universität München. This work was supported by the German Research Foundation (DFG) within the SFB Collaborative Research Center 824, “Imaging for Selection, Monitoring, and Individualization of Cancer Therapies.”
Materials
| HyperSense DNP Polariser | Oxford Instruments | 3.35 T preclinical DNP hyperpolarizer | |
| GE/Agilent MR901 | GE Healthcare/Agilent Technologies | 7 T preclinical MRI scanner, with small bore designed for experiments onrodent | |
| Spinsolve Carbon | Magritek | 1 T NMR spectrometer with permanent magnet | |
| Deuterium Oxide | Sigma Aldrich | 7789-20-0 | |
| Sodium phosphate dibasic | Sigma Aldrich | 7558-79-4 | |
| Sodium phosphate monbasic | Sigma Aldrich | 7558-80-7 | |
| Sodium hydroxide | Sigma Aldrich | 1310-73-2 | |
| Disodium edetate | Sigma Aldrich | 6381-92-6 | |
| Pyruvic acid – 13C1 | Cambridge Isotopes Laboratories | CLM-8077-1 | |
| Dotarem (0.5 mmol/L) | Guerbet | gadoterate meglumine | |
| tris (8-carboxy-2,2,6,6-tetra-(hydroxyethyl)-benzo-[1,2–4,5]-bis-(1,3)-dithiole-4-yl)-methyl sodium salt (OX063) | GE Healthcare | trityl radical used as a sourse of free electron | |
| PC3 cell line | ATCC | CRL1435 | |
| F-12K medium | ATCC | 30-2004 | |
| Fetal Bovine Serum | ATCC | SCRR-30-2020 | |
| Trypsine-EDTA Solution, 1X | ATCC | 30-2101 | |
| Sample plastic cup | Oxford Instruments | ||
| Trypan blue | Bio-Rad | 145-0013-MSDS |
References
- Rohren, E. M., Turkington, T. G., Coleman, R. E. Clinical applications of PET in oncology. Radiology. 231 (2), 305-332 (2004).
- Overhauser, A. W. Polarization of Nuclei in Metals. Phys. Rev. 92 (2), 411-415 (1953).
- Carver, T. R., Slichter, C. P. Polarization of Nuclear Spins in Metals. Phys. Rev. 92 (1), 212-213 (1953).
- Abragam, A., Proctor, W. G. Spin Temperature. Phys. Rev. 109 (5), 1441-1458 (1958).
- Abragam, a., Goldman, M. Principles of dynamic nuclear polarisation. Reports Prog. Phys. 41 (3), 395-467 (2001).
- Ardenkjaer-Larsen, J. H., Fridlund, B., et al. Increase in signal-to-noise ratio of > 10,000 times in liquid-state NMR. Proc. Natl. Acad. Sci. U. S. A. 100 (18), 10158-10163 (2003).
- Shimon, D., Hovav, Y., Feintuch, A., Goldfarb, D., Vega, S. Dynamic nuclear polarization in the solid state: a transition between the cross effect and the solid effect. Phys. Chem. Chem. Phys. 14 (16), 5729-5743 (2012).
- Serra, S. C., Rosso, A., Tedoldi, F. Electron and nuclear spin dynamics in the thermal mixing model of dynamic nuclear polarization. Phys. Chem. Chem. Phys. 14 (38), 13299-13308 (2012).
- Gallagher, F. A., Kettunen, M. I., Brindle, K. M. Biomedical applications of hyperpolarized 13C magnetic resonance imaging. Prog. Nucl. Magn. Reson. Spectrosc. 55 (4), 285-295 (2009).
- Hurd, R. E., Yen, Y. -. F., Chen, A., Ardenkjaer-Larsen, J. H. Hyperpolarized 13C metabolic imaging using dissolution dynamic nuclear polarization. J. Magn. Reson. Imaging. 36 (6), 1314-1328 (2012).
- Ardenkjaer-Larsen, J. H., Fridlund, B., et al. Increase in signal-to-noise ratio of > 10,000 times in liquid-state NMR. Proc. Natl. Acad. Sci. U. S. A. 100 (18), 10158-10163 (2003).
- Golman, K., in’t Zandt, R., Thaning, M. Real-time metabolic imaging. Proc. Natl. Acad. Sci. 103 (30), 11270-11275 (2006).
- Comment, A., Rentsch, J., et al. Producing over 100 ml of highly concentrated hyperpolarized solution by means of dissolution DNP. J. Magn. Reson. 194 (1), 152-155 (2008).
- Brindle, K. M., Bohndiek, S. E., Gallagher, F. A., Kettunen, M. I. Tumor imaging using hyperpolarized 13C magnetic resonance spectroscopy. Magn. Reson. Med. 66 (2), 505-519 (2011).
- Gallagher, F. A., Kettunen, M. I., Day, S. E., Lerche, M., Brindle, K. M. 13C MR spectroscopy measurements of glutaminase activity in human hepatocellular carcinoma cells using hyperpolarized 13C-labeled glutamine. Magn. Reson. Med. 60 (2), 253-257 (2008).
- Chen, A. P., Albers, M. J., et al. Hyperpolarized C-13 spectroscopic imaging of the TRAMP mouse at 3T-initial experience. Magn. Reson. Med. 58 (6), 1099-1106 (2007).
- Day, S. E., Kettunen, M. I., et al. Detecting tumor response to treatment using hyperpolarized 13C magnetic resonance imaging and spectroscopy. Nat. Med. 13 (11), 1382-1387 (2007).
- Schroeder, M. A., Swietach, P., et al. Measuring intracellular pH in the heart using hyperpolarized carbon dioxide and bicarbonate: a 13C and 31P magnetic resonance spectroscopy study. Cardiovasc. Res. 86 (1), 82-91 (2010).
- Hurd, R. E., Yen, Y. -. F., Tropp, J., Pfefferbaum, A., Spielman, D. M., Mayer, D. Cerebral dynamics and metabolism of hyperpolarized [1-(13)C]pyruvate using time-resolved MR spectroscopic imaging. J. Cereb. Blood Flow Metab. 30 (13), 1734-1741 (2010).
- Golman, K., Zandt, R. I., Lerche, M., Pehrson, R., Ardenkjaer-Larsen, J. H. Metabolic imaging by hyperpolarized 13C magnetic resonance imaging for in vivo tumor diagnosis. Cancer Res. 66 (22), 10855-10860 (2006).
- Park, I., Larson, P. E. Z., et al. Hyperpolarized 13C magnetic resonance metabolic imaging: application to brain tumors. Neuro. Oncol. 12 (2), 133-144 (2010).
- Albers, M. J., Bok, R., et al. Hyperpolarized 13C lactate, pyruvate, and alanine: noninvasive biomarkers for prostate cancer detection and grading. Cancer Res. 68 (20), 8607-8615 (2008).
- Yen, Y. -. F., Le Roux, P., et al. T(2) relaxation times of (13)C metabolites in a rat hepatocellular carcinoma model measured in vivo using (13)C-MRS of hyperpolarized [1-(13)C]pyruvate. NMR Biomed. 23 (4), 414-423 (2010).
- Dafni, H., Larson, P. E. Z., et al. Hyperpolarized 13C spectroscopic imaging informs on hypoxia-inducible factor-1 and myc activity downstream of platelet-derived growth factor receptor. Cancer Res. 70 (19), 7400-7410 (2010).
- Ward, C. S., Venkatesh, H. S., et al. Noninvasive detection of target modulation following phosphatidylinositol 3-kinase inhibition using hyperpolarized 13C magnetic resonance spectroscopy. Cancer Res. 70 (4), 1296-1305 (2010).
- Day, S. E., Kettunen, M. I., et al. Detecting response of rat C6 glioma tumors to radiotherapy using hyperpolarized [1- 13C]pyruvate and 13C magnetic resonance spectroscopic imaging. Magn. Reson. Med. 65 (2), 557-563 (2011).
- Johannesson, H., Macholl, S., Ardenkjaer-Larsen, J. H. Dynamic Nuclear Polarization of [1-13C]pyruvic acid at 4.6 tesla. J. Magn. Reson. 197 (2), 167-175 (2009).
- Durst, M., Koellisch, U., et al. Bolus tracking for improved metabolic imaging of hyperpolarised compounds. J. Magn. Reson. 243, 40-46 (2014).
- Khegai, O., Schulte, R. F., et al. Apparent rate constant mapping using hyperpolarized [1-(13)C]pyruvate. NMR Biomed. 27 (10), 1256-1265 (2014).
- Sogaard, L. V., Schilling, F., Janich, M. A., Menzel, M. I., Ardenkjaer-Larsen, J. H. In vivo measurement of apparent diffusion coefficients of hyperpolarized (1)(3)C-labeled metabolites. NMR Biomed. 27 (5), 561-569 (2014).
- Aquaro, G. D., Frijia, F., et al. 3D CMR mapping of metabolism by hyperpolarized 13C-pyruvate in ischemia-reperfusion. JACC. Cardiovasc. Imaging. 6 (6), 743-744 (2013).
- Menzel, M. I., Farrell, E. V., et al. Multimodal assessment of in vivo metabolism with hyperpolarized [1-13C]MR spectroscopy and 18F-FDG PET imaging in hepatocellular carcinoma tumor-bearing rats. J. Nucl. Med. 54 (7), 1113-1119 (2013).
- Schilling, F., Duwel, S., et al. Diffusion of hyperpolarized (13) C-metabolites in tumor cell spheroids using real-time NMR spectroscopy. NMR Biomed. 26 (5), 557-568 (2013).
- Schulte, R. F., Sperl, J. I., et al. Saturation-recovery metabolic-exchange rate imaging with hyperpolarized [1-13C] pyruvate using spectral-spatial excitation. Magn. Reson. Med. 69 (5), 1209-1216 (2013).
- Wiesinger, F., Weidl, E., et al. IDEAL spiral CSI for dynamic metabolic MR imaging of hyperpolarized [1-13C]pyruvate. Magn. Reson. Med. 68 (1), 8-16 (2012).
- Wilson, D. M., Keshari, K. R., et al. Multi-compound polarization by DNP allows simultaneous assessment of multiple enzymatic activities in vivo. J. Magn. Reson. 205 (1), 141-147 (2010).
- Schroeder, M. A., Atherton, H. J., et al. Real-time assessment of Krebs cycle metabolism using hyperpolarized 13C magnetic resonance spectroscopy. FASEB J. Off. Publ. Fed. Am. Soc. Exp. Biol. 23 (8), 2529-2538 (2009).
- Hurd, R. E., Yen, Y. -. F., et al. Metabolic imaging in the anesthetized rat brain using hyperpolarized [1-13C] pyruvate and [1-13C] ethyl pyruvate. Magn. Reson. Med. 63 (5), 1137-1143 (2010).
- Chen, A. P., Kurhanewicz, J., et al. Feasibility of using hyperpolarized [1-13C]lactate as a substrate for in vivo metabolic 13C MRSI studies. Magn. Reson. Imaging. 26 (6), 721-726 (2008).
- Witney, T. H., Kettunen, M. I., et al. Detecting treatment response in a model of human breast adenocarcinoma using hyperpolarised [1-(13)C]pyruvate and. Br. J. Cancer. 103 (9), 1400-1406 (2010).
- Bohndiek, S. E., Kettunen, M. I., et al. Detecting tumor response to a vascular disrupting agent using hyperpolarized (13)C magnetic resonance spectroscopy. Mol. Cancer Ther. 9 (12), 3278-3288 (2010).
- Gallagher, F. A., Kettunen, M. I., et al. Production of hyperpolarized [1,4-13C2]malate from [1,4-13C2]fumarate is a marker of cell necrosis and treatment response in tumors. Proc. Natl. Acad. Sci. U. S. A. 106 (47), 19801-19806 (2009).
- Jensen, P. R., Peitersen, T., et al. Tissue-specific short chain fatty acid metabolism and slow metabolic recovery after ischemia from hyperpolarized NMR in vivo. J. Biol. Chem. 284 (52), 36077-36082 (2009).
- Gallagher, F. A., Kettunen, M. I., et al. Magnetic resonance imaging of pH in vivo using hyperpolarized 13C-labelled bicarbonate. Nature. 453 (7197), 940-943 (2008).
- Scholz, D. J., Janich, M. A., et al. Quantified pH imaging with hyperpolarized 13C-bicarbonate. Magn. Reson. Med. 73 (6), 2274-2282 (2015).
- Koellisch, U., Gringeri, C. V., et al. Metabolic imaging of hyperpolarized [1-(13) C]acetate and [1-(13) C]acetylcarnitine – investigation of the influence of dobutamine induced stress. Magn. Reson. Med. 74 (4), 1011-1018 (2015).
- Koellisch, U., Laustsen, C., et al. Investigation of metabolic changes in STZ-induced diabetic rats with hyperpolarized [1-13C]acetate. Physiol. Rep. 3 (8), (2015).
- Jensen, P. R., Meier, S., Ardenkjaer-Larsen, J. H., Duus, J. O., Karlsson, M., Lerche, M. H. Detection of low-populated reaction intermediates with hyperpolarized NMR. Chem. Commun. (34), 5168-5170 (2009).
- Koelsch, B. L., Keshari, K. R., Peeters, T. H., Larson, P. E. Z., Wilson, D. M., Kurhanewicz, J. Diffusion MR of hyperpolarized 13C molecules in solution. Analyst. 138 (4), 1011-1014 (2013).
- Golman, K., Ardenkjaer-Larsen, J. H., Petersson, J. S., Mansson, S., Leunbach, I. Molecular imaging with endogenous substances. Proc. Natl. Acad. Sci. U. S. A. 100 (18), 10435-10439 (2003).
- von Morze, C., Larson, P. E. Z., et al. Imaging of Blood Flow Using Hyperpolarized [(13)C]Urea in Preclinical Cancer Models. J. Magn. Reson. Imaging. 33 (3), 692-697 (2011).
- Chiavazza, E., Kubala, E., et al. Earth’s magnetic field enabled scalar coupling relaxation of 13C nuclei bound to fast-relaxing quadrupolar 14N in amide groups. J. Magn. Reson. 227, 35-38 (2013).
- Jensen, P. R., Karlsson, M., Meier, S., Duus, J., Lerche, M. H. Hyperpolarized amino acids for in vivo assays of transaminase activity. Chem. – A Eur. J. 15 (39), 10010-10012 (2009).
- Gallagher, F. A., Kettunen, M. I., et al. Detection of tumor glutamate metabolism in vivo using 13C magnetic resonance spectroscopy and hyperpolarized [1-13C]glutamate. Magn. Reson. Med. 66 (1), 18-23 (2011).
- Chaumeil, M. M., Larson, P. E. Z., et al. Hyperpolarized [1-13C] glutamate: a metabolic imaging biomarker of IDH1 mutational status in glioma. Cancer Res. 74 (16), 4247-4257 (2014).
- Keshari, K. R., Wilson, D. M. Chemistry and biochemistry of 13C hyperpolarized magnetic resonance using dynamic nuclear polarization. Chem. Soc. Rev. 43 (5), 1627-1659 (2014).
- Nelson, S. J., Kurhanewicz, J., et al. Metabolic Imaging of Patients with Prostate Cancer Using Hyperpolarized [1-13C]Pyruvate. Sci. Transl. Med. 5 (198), (2013).
- Warburg, O. On the origin of cancer cells. Science. 123 (3191), 309-314 (1956).
- Warburg, O., Wind, F., Negelein, E. {Ü}ber den Stoffwechsel von Tumoren im K{ö}rper. Klin. Wochenschr. 5 (19), 829-832 (1926).
- Barnes, A. B., De Paepe, G., et al. High-Field Dynamic Nuclear Polarization for Solid and Solution. Biological NMR. Appl. Magn. Reson. 34 (3-4), 237-263 (2008).
- Koukourakis, M. I., Giatromanolaki, A., Sivridis, E., Gatter, K. C., Harris, A. L. Pyruvate dehydrogenase and pyruvate dehydrogenase kinase expression in non small cell lung cancer and tumor-associated stroma. Neoplasia. 7 (1), 1-6 (2005).
- Golman, K., Petersson, J. S. Metabolic Imaging and Other Applications of Hyperpolarized 13C1. Acad. Radiol. 13 (8), 932-942 (2016).
- Golman, K., Petersson, J. S., et al. Cardiac metabolism measured noninvasively by hyperpolarized 13C MRI. Magn. Reson. Med. 59 (5), 1005-1013 (2008).
- Merritt, M. E., Harrison, C., Storey, C., Jeffrey, F. M., Sherry, A. D., Malloy, C. R. Hyperpolarized 13C allows a direct measure of flux through a single enzyme-catalyzed step by NMR. Proc. Natl. Acad. Sci. U. S. A. 104 (50), 19773-19777 (2007).
- Merritt, M. E., Harrison, C., Storey, C., Sherry, A. D., Malloy, C. R. Inhibition of carbohydrate oxidation during the first minute of reperfusion after brief ischemia NMR detection of hyperpolarized 13CO2 and H13CO3-. Magn. Reson. Med. 60 (5), 1029-1036 (2008).
- Hu, S., Chen, A. P., et al. In vivo carbon-13 dynamic MRS and MRSI of normal and fasted rat liver with hyperpolarized 13C-pyruvate. Mol. imaging Biol. MIB Off. Publ. Acad. Mol. Imaging. 11 (6), 399-407 (2009).
- Kohler, S. J., Yen, Y., et al. In vivo 13 carbon metabolic imaging at 3T with hyperpolarized 13C-1-pyruvate. Magn. Reson. Med. 58 (1), 65-69 (2007).
- Hu, S., Lustig, M., et al. 3D compressed sensing for highly accelerated hyperpolarized (13)C MRSI with in vivo applications to transgenic mouse models of cancer. Magn. Reson. Med. 63 (2), 312-321 (2010).
- Kurhanewicz, J., Vigneron, D. B., et al. Analysis of cancer metabolism by imaging hyperpolarized nuclei: prospects for translation to clinical research. Neoplasia. 13 (2), 81-97 (2011).
- Schroeder, M. A., Cochlin, L. E., Heather, L. C., Clarke, K., Radda, G. K., Tyler, D. J. In vivo assessment of pyruvate dehydrogenase flux in the heart using hyperpolarized carbon-13 magnetic resonance. Proc. Natl. Acad. Sci. U. S. A. 105 (33), 12051-12056 (2008).
- Zierhut, M. L., Yen, Y. -. F., et al. Kinetic modeling of hyperpolarized 13C1-pyruvate metabolism in normal rats and TRAMP mice. J. Magn. Reson. 202 (1), 85-92 (2010).
- Dennis, L. K., Resnick, M. I. Analysis of recent trends in prostate cancer incidence and mortality. Prostate. 42 (4), 247-252 (2000).
- Jambor, I., Borra, R., et al. Functional imaging of localized prostate cancer aggressiveness using 11C-acetate PET/CT and 1H-MR spectroscopy. J. Nucl. Med. 51 (11), 1676-1683 (2010).
- Presti, J. C. J., Hricak, H., Narayan, P. A., Shinohara, K., White, S., Carroll, P. R. Local staging of prostatic carcinoma: comparison of transrectal sonography and endorectal MR imaging. AJR. Am. J. Roentgenol. 166 (1), 103-108 (1996).
- Schulte, R. F., Sacolick, L., et al. Transmit gain calibration for nonproton MR using the Bloch-Siegert shift. NMR Biomed. 24 (9), 1068-1072 (2011).
- Durst, M., Koellisch, U., et al. Comparison of acquisition schemes for hyperpolarised (1)(3)C imaging. NMR Biomed. 28 (6), 715-725 (2015).
- Janich, M. A., Menzel, M. I., et al. Effects of pyruvate dose on in vivo metabolism and quantification of hyperpolarized (1)(3)C spectra. NMR Biomed. 25 (1), 142-151 (2012).
- Harrison, C., Yang, C., et al. Comparison of kinetic models for analysis of pyruvate-to-lactate exchange by hyperpolarized 13 C NMR. NMR Biomed. 25 (11), 1286-1294 (2012).
- Gómez Damián, P. A., Sperl, J. I., et al. Multisite Kinetic Modeling of (13)C Metabolic MR Using [1-(13)C]Pyruvate. Radiol. Res. Pract. 2014, (2014).
- Talbot, J. -. N., Gutman, F., et al. PET/CT in patients with hepatocellular carcinoma using [(18)F]fluorocholine: preliminary comparison with [(18)F]FDG PET/CT. Eur. J. Nucl. Med. Mol. Imaging. 33 (11), 1285-1289 (2006).
- Reeder, S. B., Pineda, A. R., et al. Iterative decomposition of water and fat with echo asymmetry and least-squares estimation (IDEAL): application with fast spin-echo imaging. Magn. Reson. Med. 54 (3), 636-644 (2005).
- Laustsen, C., Ostergaard, J. A., et al. Assessment of early diabetic renal changes with hyperpolarized [1-(13) C]pyruvate. Diabetes. Metab. Res. Rev. 29 (2), 125-129 (2013).
- Serrao, E. M., Brindle, K. M. Potential Clinical Roles for Metabolic Imaging with Hyperpolarized [1-(13)C]Pyruvate. Front. Oncol. 6, 59 (2016).

