hyperpolarized<sup> 13</sup> C metabolica spettroscopia di risonanza magnetica e Imaging
Summary
Dynamic nuclear polarization with subsequent sample dissolution has enabled real-time studies of metabolism in biological systems. Hyperpolarized [1-13C]pyruvate was used to study lactate dehydrogenase activity in a prostate carcinoma cell line in vitro.
Abstract
Negli ultimi decenni, nuovi metodi per la stadiazione del tumore, ristadiazione, monitoraggio risposta al trattamento, e la rilevazione ricorrenza di una varietà di tumori sono emersi in concomitanza con la tomografia state-of-the-art emissione di positroni con 18 F-fluorodeossiglucosio ([18 F ] -FDG PET). 13 C spettroscopia imaging a risonanza magnetica (13 CMRSI) è un metodo di imaging minimamente invasivo che permette il controllo del metabolismo in vivo ed in tempo reale. Come con qualsiasi altro metodo basato su 13 C risonanza magnetica nucleare (NMR), affronta la sfida di bassa polarizzazione termica e una successiva basso rapporto segnale-rumore dovuto alla relativamente basso rapporto giromagnetico di 13 C e la sua bassa abbondanza naturale in campioni biologici. Superando questi limiti, la polarizzazione nucleare dinamica (DNP), con conseguente scioglimento del campione ha recentemente permesso comunemente utilizzati sistemi di imaging a risonanza magnetica (MRI) NMR e misurare, Lo studio, e di immagine principali vie metaboliche nei vari sistemi biologici. Una molecola particolarmente interessante e promettente utilizzato in 13 CMRSI è [1- 13 C] piruvato, che, negli ultimi dieci anni, è stato ampiamente utilizzato in vitro, preclinici, e, più recentemente, studi clinici per indagare il metabolismo energetico cellulare nel cancro e altre malattie. In questo articolo, descriviamo la tecnica di scioglimento DNP utilizzando un 3.35 T preclinico hyperpolarizer DNP e dimostrare il suo utilizzo in studi in vitro. Un protocollo simile per iperpolarizzazione può essere applicato per la maggior parte in studi in vivo pure. Per farlo, abbiamo utilizzato lattato deidrogenasi (LDH) e catalizzato la reazione metabolica di [1- 13 C] piruvato in [1- 13 C] lattato in una linea di cellule di carcinoma della prostata, PC3, in vitro utilizzando 13 CMRSI.
Introduction
Attualmente, il metodo clinico più utilizzato per la stadiazione del tumore, ristadiazione, monitoraggio risposta al trattamento, e la rilevazione ricorrenza di una vasta gamma di tumori è [18 F] -FDG PET. 1 Tuttavia, recentemente, diversi approcci nuovi e alternativi sono emersi. Uno di questi metodi è 13 CMRSI. Questa tecnica prevede l'introduzione del 13 C-molecola in un campione biologico, seguita da MRI minimamente invasiva per valutare il metabolismo in vitro o in vivo in tempo reale. Tuttavia, la sfida del 13 CMRSI, rispetto agli altri metodi come [18 F] -FDG PET o tomografia computerizzata, è il basso rapporto segnale-rumore.
Il segnale NMR è direttamente proporzionale al livello di polarizzazione, un rapporto tra la differenza di popolazione di spin ½ nuclei in due stati di energia alla popolazione totale (Figura 1A). La polarizzazione è un prodotto di the rapporto giromagnetico (γ) dei nuclei e l'intensità del campo magnetico applicato sopra la temperatura. Una polarizzazione tipica di 1 H nuclei è dell'ordine di 0,001% a 0,005% a 3 T, che dà una relativamente scarsa rapporto segnale-rumore. Odierna state-of-the-art MRI è stato un metodo di imaging successo solo a causa della grande abbondanza di 1 H in campioni biologici e l'elevato rapporto giromagnetico di 1 H (γ 1H = 42,576 MHz / T). Tuttavia, osservando altri nuclei, come carbonio, è più esigente. L'unica stabile, isotopo di carbonio magneticamente attivi, 13 C, costituisce solo l'1,1% di tutti gli atomi di carbonio. Inoltre, il rapporto giromagnetico di 13 C (γ 13C = 10.705 MHz / T) è quattro volte inferiore a quella del 1 H, portando ad una efficienza di rivelazione inferiore. In sintesi, la scarsa abbondanza 13 C e bassa 13C γ causano misurazioni 13 C termici per raggiungere 0,0176% della sensibilità di un 1Misurazione H-NMR in vivo.
Polarizzazione nucleare dinamica
Un metodo per superare la relativamente scarsa sensibilità di 13 misurazioni C è DNP. E 'stato originariamente descritto per i metalli nel 1953 da Albert W. Overhauser. Nel suo articolo, afferma: "Si dimostra che se la risonanza di spin elettronico degli elettroni di conduzione è saturo, i nuclei vengono polarizzati nella stessa misura sarebbero se il loro rapporto giromagnetico fosse quello dello spin dell'elettrone." 2 tardi quell'anno, Carver e Slichter sperimentalmente confermato l'ipotesi di Overhauser 3. Nel 1958, Abragam e Proctor descritti questo effetto per gli elettroni nei liquidi e chiamarono "l'effetto solido." A temperature inferiori a 4 K, electron spin polarizzazione raggiunge quasi il 100% ed è più di tre ordini di grandezza superiore al nucleare polarizzazione di spin (Figura 1B) 4. Tla verifica perché il rapporto giromagnetico dell'elettrone (γ e = 28024,944 MHz / T) è di tre ordini di grandezza superiore al rapporto giromagnetico nucleari. Le interazioni deboli tra elettroni e nuclei, come l'effetto Overhauser, l'effetto solido, l'effetto trasversale, e l'effetto di miscelazione termica, consentono il trasferimento di polarizzazione da electron spin a spin nucleari mediante irradiazione a microonde con una frequenza prossima al corrispondente elettroni risonanza paramagnetica (EPR) 5,6 frequenza. teoria DNP è stato ulteriormente sviluppato per coinvolgere più elettroni e miscelazione termica. Tuttavia, ad oggi, non unificato descrizione quantitativa teorica di DNP è stato pubblicato 7,8.
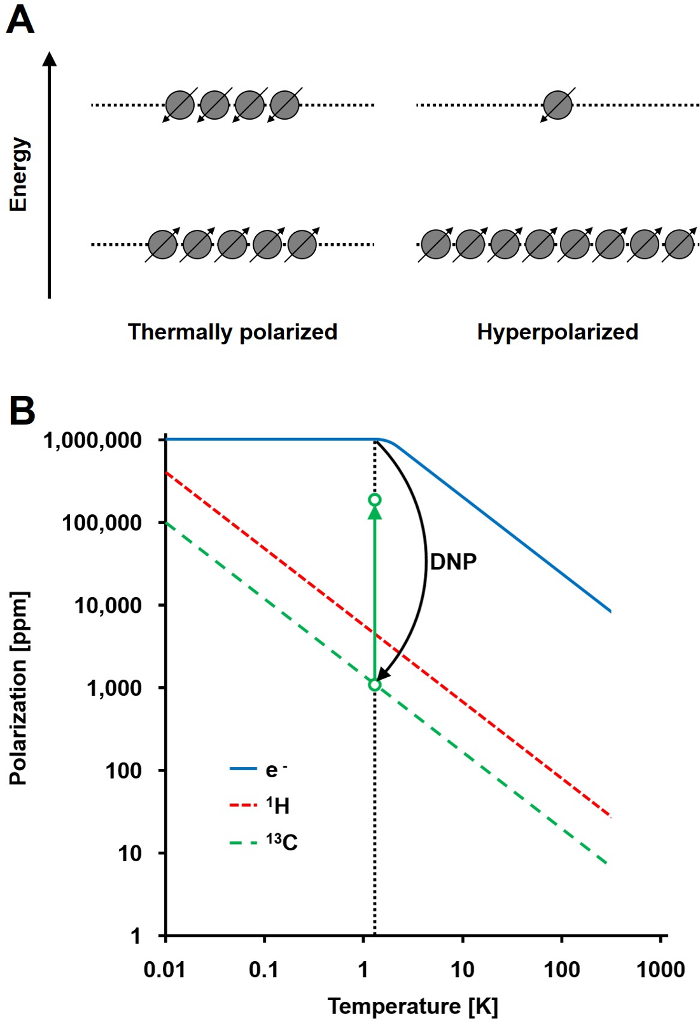
Figura 1: comprensione dinamica di polarizzazione nucleare e Iperpolarizzazione. A) Un confronto schematica della popolazione di spinnello stato di equilibrio di polarizzazione termico e lo stato iperpolarizzato. B) La polarizzazione dipende dalla temperatura. La polarizzazione di un elettrone (e -) raggiunge il 100% inferiore a 1,4 K. Il DNP permette il trasferimento della polarizzazione dalla e- ai 13 C nuclei, che aumenta la polarizzazione fino a 10 5 fold. Clicca qui per vedere una versione più grande di questa figura.
Per introdurre DNP negli studi di sistemi biologici utilizzando 13 C NMR, successivo scioglimento rapido del campione doveva essere sviluppato. 50 anni dopo l'ipotesi di Overhauser, Jan H. Ardenkjaer-Larsen et al. risolto il problema tecnicamente impegnativo di portare il campione congelato iperpolarizzato allo stato liquido con una perdita minima iperpolarizzazione 6. Scioglimento DNP ha aperto un nuovo campo di ricerca chiamato 13 CMRSIo, che fornisce un nuovo metodo per studiare e caratterizzare i vari stati di malattia 9,10. Come vettori stabili di un elettrone spaiato, un tritile tris radicale (8-carbossi-2,2,6,6-tetra (idrossietil) -benzo- [1,2-4,5] bis- (1,3) -dithiole-4-il) -metil sale di sodio (OX063) o oxyl (2,2,6,6-tetrametilpiperidin-1-il) (TEMPO) è di solito utilizzato. Questi sono mescolati con 13 molecola di C-marcato desiderata e esposti a irradiazione a microonde con una frequenza vicina alla frequenza corrispondente EPR. Usando questa tecnica, la polarizzazione di 13 C nuclei può essere aumentata fino al 37% 11. Ciò si traduce in un 10 5 fold miglioramento polarizzazione rispetto all'equilibrio termico di polarizzazione 11,12. Tuttavia, non appena l'irraggiamento a microonde è fermo e / o 13 C-molecola viene trasferito allo stato liquido, la polarizzazione decade con il tempo di rilassamento longitudinale (T 1) del nucleo 13 C che è stato polarizzato. Così, lainvenzione di tecniche di dissoluzione veloce o qualsiasi successiva tecnica accorciando il tempo prima misura sperimentale (ad esempio, l'iniezione) è di fondamentale importanza per le applicazioni biologiche 13.
Ci sono tre requisiti principali che la molecola candidato deve soddisfare per successo 13 studi CMRSI. Innanzitutto, il nucleo 13 C di interesse deve avere un tempo sufficientemente lungo T 1 (> 10 s). La scelta del 13 C-label è cruciale. Le migliori nuclei candidati sono atomi di carbonio con alcun contatto diretto con 1 H-nuclei tramite un legame. Inoltre deve essere rapidamente metabolizzato entro 2 – 3 T 1 volte, risultando in un prodotto metabolico a valle con una significativamente diverso chemical shift dalla sostanza originale. La miscela campione deve inoltre formare un vetro amorfo allo stato solido in modo che la distribuzione spaziale diminuisce la distanza tra l'elettrone e 13 C, permettendo transFer di polarizzazione. Se la molecola candidata non forma vetrosa amorfa naturalmente, deve essere altamente solubile in un agente glassing, come il glicerolo o dimetilsolfossido 14. Questi requisiti comportano un numero relativamente piccolo di molecole candidate. Tuttavia, anche dopo la scoperta di successo di una molecola adatta, sviluppando un protocollo di lavoro per iperpolarizzazione può essere tecnicamente impegnativo 9,14,15.
Negli ultimi anni, diversi substrati sono stati correttamente polarizzata, ad esempio [1- 13 C] piruvato 12,16 – 36, [2- 13 C] piruvato 37, [1- 13 C] etil piruvato 38, [1- 13 C ] lattato 39, [1- 13 C] fumarato 40-43, 13 C-bicarbonato 36,44,45, [1- 13 C] acetato di sodio 43,46 – 49, 13 C-urea 6,36,50,51 , [5- 13 C] glutamine 15,52,53, [1- 13 C] glutammato 53,54, [1- 13 C] 2-oxoglutarato 55, [1- 13 C] alanina, e altri 14,56. Un substrato particolarmente interessante e comunemente usato per iperpolarizzazione è [1- 13 C] piruvato. E 'ampiamente utilizzato negli studi preclinici per indagare il cellulare energetico del metabolismo in varie malattie 14,17,22. [1- 13 C] piruvato soddisfa tutti i requisiti per iperpolarizzazione successo, compreso un relativamente lungo T 1 e rapido trasporto attraverso la membrana cellulare prima successivamente essere metabolizzata. Gli studi preclinici con [1- 13 C] piruvato vengono attualmente tradotte in clinica 57.
Il metabolismo del piruvato
E 'ben noto che vi è un legame diretto tra le mutazioni nel DNA e cambiamenti nelle loro vie metaboliche un cancro cellule. Già nel 1920, Otto Warburg scoEred che vi è un aumento del metabolismo del glucosio e la produzione di lattato in tumori rispetto al tessuto sano 58 – 60. Successivamente, varie alternanze di altre vie metaboliche, come la via dei pentoso-fosfati, il ciclo degli acidi tricarbossilici, fosforilazione ossidativa e la sintesi dei nucleotidi e lipidi, sono stati descritti.
Il piruvato è il prodotto finale della glicolisi. Nel tumore, subisce glicolisi anaerobica catalizzata dalla LDH 61 e reagisce con la forma ridotta del coenzima nicotinamide adenina dinucleotide (NADH), con conseguente lattato e la forma ossidata del coenzima (NAD +). In alternativa, piruvato subisce una reazione di transaminazione con glutammato per formare alanina, catalizzata da alanina transaminasi (ALT). Entrambe le reazioni sono facilmente reversibili. Piruvato subisce decarbossilazione catalizzata dalla piruvato deidrogenasi (PDH) in anidride carbonica e acetil-CoA, representing una reazione irreversibile, in questa fase. Alternanze di queste velocità di reazione possono essere collegati al metabolismo tumorale 17,21,22,25,62. Le vie metaboliche sono riassunti nella figura 2.

Figura 2: Schema del forte reazione metabolica del piruvato. Piruvato / conversione del lattato è catalizzata dalla LDH, e la conversione piruvato / alanina è catalizzata da ALT. Il piruvato è irreversibilmente convertito in acetil-CoA e CO 2 di PDH, e CO 2 è in un equilibrio pH-dipendente con bicarbonato 80. Clicca qui per vedere una versione più grande di questa figura.
Il rilevamento di iperpolarizzato [1- 13 C] piruvato e dei suoi metaboliti è stata precedentemente dimostrata nel ratto haArte 37,63 – 65, del fegato 66, muscoli, reni e 62,67. Uno studio ha dimostrato differenze significative nel rapporto lattato-to-alanina tra il normale e digiuno fegato di ratto 66 e dimostrato un [1- 13 C] livello lattato altamente elevato e iperpolarizzato nel cancro del fegato 68,69. Ci sono prove che il grado del tumore può essere identificato in un adenocarcinoma prostatico transgenico di mouse (TRAMP) utilizzando hyperpolarized [1- 13 C] piruvato 22, con i livelli di lattato hyperpolarized che mostrano una forte correlazione con il grado istologico dei tumori asportati. L'alanina catalizzata dalla piruvato dal ALT stato anche suggerito come marker utile nel ratto carcinoma epatocellulare 23.
La misurazione del flusso metabolico piruvato-lattato è stato utilizzato per il monitoraggio di ischemia 63,65,70 e come risposta al trattamento con farmaci chemioterapia citotossica 17,40, mirati <sup> 24,25,41, 26 o radioterapia in modelli animali. E 'stato utilizzato anche per il rilevamento della fosfatidilinositolo 3-chinasi (PI3K) inibitore della risposta LY294002 nel glioblastoma e il cancro al seno modelli murini 25. I cambiamenti nel metabolismo del piruvato in tumori cerebrali 26 e il cancro alla prostata 24,71 sono stati osservati anche dopo il trattamento.
Carcinoma della prostata
Il carcinoma della prostata è il cancro predominante negli uomini anziani e il secondo tumore che porta legate alla morte negli uomini in tutto il mondo 72. Ad oggi, esistono metodi affidabili, non invasivi sono disponibili per una diagnosi precoce e caratterizzazione di cancro alla prostata 73,74, sottolineando la necessità urgente di nuove tecniche di imaging metabolico per consentire la rilevazione rigorosa e la stadiazione dei pazienti. Carcinoma della prostata è stato usato come modello per dimostrare le possibilità di dissoluzione DNP combinati con 13 CMRSI nel pazienteS 57. Questo lavoro è stato continuato in un primo studio clinico che impiegano [1- 13 C] piruvato e 13 CMRSI per l'imaging del cancro alla prostata, ed è proprio di recente è stato completato (NCT01229618).
La motivazione di questo lavoro era di illustrare più in dettaglio e per un pubblico più vasto l'applicazione del metodo CMRSI 13 in un ambiente preclinico con le cellule. Misurare il metabolismo LDH-catalizzata di [1- 13 C] piruvato di [1- 13 C] lattato in vitro nella linea di cellule di carcinoma della prostata PC3, dimostriamo l'eventuale applicazione di scioglimento DNP negli studi in vitro e affrontare i punti cruciali e sfide durante gli esperimenti.
Protocol
Representative Results
Discussion
13 CMRSI con sonde hyperpolarized è un metodo promettente per monitorare in tempo reale il metabolismo in vitro e in vivo. Un aspetto molto importante quando si impiega questo processo sperimentale è la corretta normalizzazione, soprattutto per quanto riguarda gli esperimenti in vitro. Innanzitutto, la preparazione del campione deve essere fatto correttamente e costantemente per ottenere la stessa concentrazione di materiale iperpolarizzato in ogni esperimento. Ciò richi…
Disclosures
The authors have nothing to disclose.
Acknowledgements
E.K. gratefully acknowledges the support of the Graduate School of Bioengineering (GSB) at Technische Universität München. This work was supported by the German Research Foundation (DFG) within the SFB Collaborative Research Center 824, “Imaging for Selection, Monitoring, and Individualization of Cancer Therapies.”
Materials
| HyperSense DNP Polariser | Oxford Instruments | 3.35 T preclinical DNP hyperpolarizer | |
| GE/Agilent MR901 | GE Healthcare/Agilent Technologies | 7 T preclinical MRI scanner, with small bore designed for experiments onrodent | |
| Spinsolve Carbon | Magritek | 1 T NMR spectrometer with permanent magnet | |
| Deuterium Oxide | Sigma Aldrich | 7789-20-0 | |
| Sodium phosphate dibasic | Sigma Aldrich | 7558-79-4 | |
| Sodium phosphate monbasic | Sigma Aldrich | 7558-80-7 | |
| Sodium hydroxide | Sigma Aldrich | 1310-73-2 | |
| Disodium edetate | Sigma Aldrich | 6381-92-6 | |
| Pyruvic acid – 13C1 | Cambridge Isotopes Laboratories | CLM-8077-1 | |
| Dotarem (0.5 mmol/L) | Guerbet | gadoterate meglumine | |
| tris (8-carboxy-2,2,6,6-tetra-(hydroxyethyl)-benzo-[1,2–4,5]-bis-(1,3)-dithiole-4-yl)-methyl sodium salt (OX063) | GE Healthcare | trityl radical used as a sourse of free electron | |
| PC3 cell line | ATCC | CRL1435 | |
| F-12K medium | ATCC | 30-2004 | |
| Fetal Bovine Serum | ATCC | SCRR-30-2020 | |
| Trypsine-EDTA Solution, 1X | ATCC | 30-2101 | |
| Sample plastic cup | Oxford Instruments | ||
| Trypan blue | Bio-Rad | 145-0013-MSDS |
References
- Rohren, E. M., Turkington, T. G., Coleman, R. E. Clinical applications of PET in oncology. Radiology. 231 (2), 305-332 (2004).
- Overhauser, A. W. Polarization of Nuclei in Metals. Phys. Rev. 92 (2), 411-415 (1953).
- Carver, T. R., Slichter, C. P. Polarization of Nuclear Spins in Metals. Phys. Rev. 92 (1), 212-213 (1953).
- Abragam, A., Proctor, W. G. Spin Temperature. Phys. Rev. 109 (5), 1441-1458 (1958).
- Abragam, a., Goldman, M. Principles of dynamic nuclear polarisation. Reports Prog. Phys. 41 (3), 395-467 (2001).
- Ardenkjaer-Larsen, J. H., Fridlund, B., et al. Increase in signal-to-noise ratio of > 10,000 times in liquid-state NMR. Proc. Natl. Acad. Sci. U. S. A. 100 (18), 10158-10163 (2003).
- Shimon, D., Hovav, Y., Feintuch, A., Goldfarb, D., Vega, S. Dynamic nuclear polarization in the solid state: a transition between the cross effect and the solid effect. Phys. Chem. Chem. Phys. 14 (16), 5729-5743 (2012).
- Serra, S. C., Rosso, A., Tedoldi, F. Electron and nuclear spin dynamics in the thermal mixing model of dynamic nuclear polarization. Phys. Chem. Chem. Phys. 14 (38), 13299-13308 (2012).
- Gallagher, F. A., Kettunen, M. I., Brindle, K. M. Biomedical applications of hyperpolarized 13C magnetic resonance imaging. Prog. Nucl. Magn. Reson. Spectrosc. 55 (4), 285-295 (2009).
- Hurd, R. E., Yen, Y. -. F., Chen, A., Ardenkjaer-Larsen, J. H. Hyperpolarized 13C metabolic imaging using dissolution dynamic nuclear polarization. J. Magn. Reson. Imaging. 36 (6), 1314-1328 (2012).
- Ardenkjaer-Larsen, J. H., Fridlund, B., et al. Increase in signal-to-noise ratio of > 10,000 times in liquid-state NMR. Proc. Natl. Acad. Sci. U. S. A. 100 (18), 10158-10163 (2003).
- Golman, K., in’t Zandt, R., Thaning, M. Real-time metabolic imaging. Proc. Natl. Acad. Sci. 103 (30), 11270-11275 (2006).
- Comment, A., Rentsch, J., et al. Producing over 100 ml of highly concentrated hyperpolarized solution by means of dissolution DNP. J. Magn. Reson. 194 (1), 152-155 (2008).
- Brindle, K. M., Bohndiek, S. E., Gallagher, F. A., Kettunen, M. I. Tumor imaging using hyperpolarized 13C magnetic resonance spectroscopy. Magn. Reson. Med. 66 (2), 505-519 (2011).
- Gallagher, F. A., Kettunen, M. I., Day, S. E., Lerche, M., Brindle, K. M. 13C MR spectroscopy measurements of glutaminase activity in human hepatocellular carcinoma cells using hyperpolarized 13C-labeled glutamine. Magn. Reson. Med. 60 (2), 253-257 (2008).
- Chen, A. P., Albers, M. J., et al. Hyperpolarized C-13 spectroscopic imaging of the TRAMP mouse at 3T-initial experience. Magn. Reson. Med. 58 (6), 1099-1106 (2007).
- Day, S. E., Kettunen, M. I., et al. Detecting tumor response to treatment using hyperpolarized 13C magnetic resonance imaging and spectroscopy. Nat. Med. 13 (11), 1382-1387 (2007).
- Schroeder, M. A., Swietach, P., et al. Measuring intracellular pH in the heart using hyperpolarized carbon dioxide and bicarbonate: a 13C and 31P magnetic resonance spectroscopy study. Cardiovasc. Res. 86 (1), 82-91 (2010).
- Hurd, R. E., Yen, Y. -. F., Tropp, J., Pfefferbaum, A., Spielman, D. M., Mayer, D. Cerebral dynamics and metabolism of hyperpolarized [1-(13)C]pyruvate using time-resolved MR spectroscopic imaging. J. Cereb. Blood Flow Metab. 30 (13), 1734-1741 (2010).
- Golman, K., Zandt, R. I., Lerche, M., Pehrson, R., Ardenkjaer-Larsen, J. H. Metabolic imaging by hyperpolarized 13C magnetic resonance imaging for in vivo tumor diagnosis. Cancer Res. 66 (22), 10855-10860 (2006).
- Park, I., Larson, P. E. Z., et al. Hyperpolarized 13C magnetic resonance metabolic imaging: application to brain tumors. Neuro. Oncol. 12 (2), 133-144 (2010).
- Albers, M. J., Bok, R., et al. Hyperpolarized 13C lactate, pyruvate, and alanine: noninvasive biomarkers for prostate cancer detection and grading. Cancer Res. 68 (20), 8607-8615 (2008).
- Yen, Y. -. F., Le Roux, P., et al. T(2) relaxation times of (13)C metabolites in a rat hepatocellular carcinoma model measured in vivo using (13)C-MRS of hyperpolarized [1-(13)C]pyruvate. NMR Biomed. 23 (4), 414-423 (2010).
- Dafni, H., Larson, P. E. Z., et al. Hyperpolarized 13C spectroscopic imaging informs on hypoxia-inducible factor-1 and myc activity downstream of platelet-derived growth factor receptor. Cancer Res. 70 (19), 7400-7410 (2010).
- Ward, C. S., Venkatesh, H. S., et al. Noninvasive detection of target modulation following phosphatidylinositol 3-kinase inhibition using hyperpolarized 13C magnetic resonance spectroscopy. Cancer Res. 70 (4), 1296-1305 (2010).
- Day, S. E., Kettunen, M. I., et al. Detecting response of rat C6 glioma tumors to radiotherapy using hyperpolarized [1- 13C]pyruvate and 13C magnetic resonance spectroscopic imaging. Magn. Reson. Med. 65 (2), 557-563 (2011).
- Johannesson, H., Macholl, S., Ardenkjaer-Larsen, J. H. Dynamic Nuclear Polarization of [1-13C]pyruvic acid at 4.6 tesla. J. Magn. Reson. 197 (2), 167-175 (2009).
- Durst, M., Koellisch, U., et al. Bolus tracking for improved metabolic imaging of hyperpolarised compounds. J. Magn. Reson. 243, 40-46 (2014).
- Khegai, O., Schulte, R. F., et al. Apparent rate constant mapping using hyperpolarized [1-(13)C]pyruvate. NMR Biomed. 27 (10), 1256-1265 (2014).
- Sogaard, L. V., Schilling, F., Janich, M. A., Menzel, M. I., Ardenkjaer-Larsen, J. H. In vivo measurement of apparent diffusion coefficients of hyperpolarized (1)(3)C-labeled metabolites. NMR Biomed. 27 (5), 561-569 (2014).
- Aquaro, G. D., Frijia, F., et al. 3D CMR mapping of metabolism by hyperpolarized 13C-pyruvate in ischemia-reperfusion. JACC. Cardiovasc. Imaging. 6 (6), 743-744 (2013).
- Menzel, M. I., Farrell, E. V., et al. Multimodal assessment of in vivo metabolism with hyperpolarized [1-13C]MR spectroscopy and 18F-FDG PET imaging in hepatocellular carcinoma tumor-bearing rats. J. Nucl. Med. 54 (7), 1113-1119 (2013).
- Schilling, F., Duwel, S., et al. Diffusion of hyperpolarized (13) C-metabolites in tumor cell spheroids using real-time NMR spectroscopy. NMR Biomed. 26 (5), 557-568 (2013).
- Schulte, R. F., Sperl, J. I., et al. Saturation-recovery metabolic-exchange rate imaging with hyperpolarized [1-13C] pyruvate using spectral-spatial excitation. Magn. Reson. Med. 69 (5), 1209-1216 (2013).
- Wiesinger, F., Weidl, E., et al. IDEAL spiral CSI for dynamic metabolic MR imaging of hyperpolarized [1-13C]pyruvate. Magn. Reson. Med. 68 (1), 8-16 (2012).
- Wilson, D. M., Keshari, K. R., et al. Multi-compound polarization by DNP allows simultaneous assessment of multiple enzymatic activities in vivo. J. Magn. Reson. 205 (1), 141-147 (2010).
- Schroeder, M. A., Atherton, H. J., et al. Real-time assessment of Krebs cycle metabolism using hyperpolarized 13C magnetic resonance spectroscopy. FASEB J. Off. Publ. Fed. Am. Soc. Exp. Biol. 23 (8), 2529-2538 (2009).
- Hurd, R. E., Yen, Y. -. F., et al. Metabolic imaging in the anesthetized rat brain using hyperpolarized [1-13C] pyruvate and [1-13C] ethyl pyruvate. Magn. Reson. Med. 63 (5), 1137-1143 (2010).
- Chen, A. P., Kurhanewicz, J., et al. Feasibility of using hyperpolarized [1-13C]lactate as a substrate for in vivo metabolic 13C MRSI studies. Magn. Reson. Imaging. 26 (6), 721-726 (2008).
- Witney, T. H., Kettunen, M. I., et al. Detecting treatment response in a model of human breast adenocarcinoma using hyperpolarised [1-(13)C]pyruvate and. Br. J. Cancer. 103 (9), 1400-1406 (2010).
- Bohndiek, S. E., Kettunen, M. I., et al. Detecting tumor response to a vascular disrupting agent using hyperpolarized (13)C magnetic resonance spectroscopy. Mol. Cancer Ther. 9 (12), 3278-3288 (2010).
- Gallagher, F. A., Kettunen, M. I., et al. Production of hyperpolarized [1,4-13C2]malate from [1,4-13C2]fumarate is a marker of cell necrosis and treatment response in tumors. Proc. Natl. Acad. Sci. U. S. A. 106 (47), 19801-19806 (2009).
- Jensen, P. R., Peitersen, T., et al. Tissue-specific short chain fatty acid metabolism and slow metabolic recovery after ischemia from hyperpolarized NMR in vivo. J. Biol. Chem. 284 (52), 36077-36082 (2009).
- Gallagher, F. A., Kettunen, M. I., et al. Magnetic resonance imaging of pH in vivo using hyperpolarized 13C-labelled bicarbonate. Nature. 453 (7197), 940-943 (2008).
- Scholz, D. J., Janich, M. A., et al. Quantified pH imaging with hyperpolarized 13C-bicarbonate. Magn. Reson. Med. 73 (6), 2274-2282 (2015).
- Koellisch, U., Gringeri, C. V., et al. Metabolic imaging of hyperpolarized [1-(13) C]acetate and [1-(13) C]acetylcarnitine – investigation of the influence of dobutamine induced stress. Magn. Reson. Med. 74 (4), 1011-1018 (2015).
- Koellisch, U., Laustsen, C., et al. Investigation of metabolic changes in STZ-induced diabetic rats with hyperpolarized [1-13C]acetate. Physiol. Rep. 3 (8), (2015).
- Jensen, P. R., Meier, S., Ardenkjaer-Larsen, J. H., Duus, J. O., Karlsson, M., Lerche, M. H. Detection of low-populated reaction intermediates with hyperpolarized NMR. Chem. Commun. (34), 5168-5170 (2009).
- Koelsch, B. L., Keshari, K. R., Peeters, T. H., Larson, P. E. Z., Wilson, D. M., Kurhanewicz, J. Diffusion MR of hyperpolarized 13C molecules in solution. Analyst. 138 (4), 1011-1014 (2013).
- Golman, K., Ardenkjaer-Larsen, J. H., Petersson, J. S., Mansson, S., Leunbach, I. Molecular imaging with endogenous substances. Proc. Natl. Acad. Sci. U. S. A. 100 (18), 10435-10439 (2003).
- von Morze, C., Larson, P. E. Z., et al. Imaging of Blood Flow Using Hyperpolarized [(13)C]Urea in Preclinical Cancer Models. J. Magn. Reson. Imaging. 33 (3), 692-697 (2011).
- Chiavazza, E., Kubala, E., et al. Earth’s magnetic field enabled scalar coupling relaxation of 13C nuclei bound to fast-relaxing quadrupolar 14N in amide groups. J. Magn. Reson. 227, 35-38 (2013).
- Jensen, P. R., Karlsson, M., Meier, S., Duus, J., Lerche, M. H. Hyperpolarized amino acids for in vivo assays of transaminase activity. Chem. – A Eur. J. 15 (39), 10010-10012 (2009).
- Gallagher, F. A., Kettunen, M. I., et al. Detection of tumor glutamate metabolism in vivo using 13C magnetic resonance spectroscopy and hyperpolarized [1-13C]glutamate. Magn. Reson. Med. 66 (1), 18-23 (2011).
- Chaumeil, M. M., Larson, P. E. Z., et al. Hyperpolarized [1-13C] glutamate: a metabolic imaging biomarker of IDH1 mutational status in glioma. Cancer Res. 74 (16), 4247-4257 (2014).
- Keshari, K. R., Wilson, D. M. Chemistry and biochemistry of 13C hyperpolarized magnetic resonance using dynamic nuclear polarization. Chem. Soc. Rev. 43 (5), 1627-1659 (2014).
- Nelson, S. J., Kurhanewicz, J., et al. Metabolic Imaging of Patients with Prostate Cancer Using Hyperpolarized [1-13C]Pyruvate. Sci. Transl. Med. 5 (198), (2013).
- Warburg, O. On the origin of cancer cells. Science. 123 (3191), 309-314 (1956).
- Warburg, O., Wind, F., Negelein, E. {Ü}ber den Stoffwechsel von Tumoren im K{ö}rper. Klin. Wochenschr. 5 (19), 829-832 (1926).
- Barnes, A. B., De Paepe, G., et al. High-Field Dynamic Nuclear Polarization for Solid and Solution. Biological NMR. Appl. Magn. Reson. 34 (3-4), 237-263 (2008).
- Koukourakis, M. I., Giatromanolaki, A., Sivridis, E., Gatter, K. C., Harris, A. L. Pyruvate dehydrogenase and pyruvate dehydrogenase kinase expression in non small cell lung cancer and tumor-associated stroma. Neoplasia. 7 (1), 1-6 (2005).
- Golman, K., Petersson, J. S. Metabolic Imaging and Other Applications of Hyperpolarized 13C1. Acad. Radiol. 13 (8), 932-942 (2016).
- Golman, K., Petersson, J. S., et al. Cardiac metabolism measured noninvasively by hyperpolarized 13C MRI. Magn. Reson. Med. 59 (5), 1005-1013 (2008).
- Merritt, M. E., Harrison, C., Storey, C., Jeffrey, F. M., Sherry, A. D., Malloy, C. R. Hyperpolarized 13C allows a direct measure of flux through a single enzyme-catalyzed step by NMR. Proc. Natl. Acad. Sci. U. S. A. 104 (50), 19773-19777 (2007).
- Merritt, M. E., Harrison, C., Storey, C., Sherry, A. D., Malloy, C. R. Inhibition of carbohydrate oxidation during the first minute of reperfusion after brief ischemia NMR detection of hyperpolarized 13CO2 and H13CO3-. Magn. Reson. Med. 60 (5), 1029-1036 (2008).
- Hu, S., Chen, A. P., et al. In vivo carbon-13 dynamic MRS and MRSI of normal and fasted rat liver with hyperpolarized 13C-pyruvate. Mol. imaging Biol. MIB Off. Publ. Acad. Mol. Imaging. 11 (6), 399-407 (2009).
- Kohler, S. J., Yen, Y., et al. In vivo 13 carbon metabolic imaging at 3T with hyperpolarized 13C-1-pyruvate. Magn. Reson. Med. 58 (1), 65-69 (2007).
- Hu, S., Lustig, M., et al. 3D compressed sensing for highly accelerated hyperpolarized (13)C MRSI with in vivo applications to transgenic mouse models of cancer. Magn. Reson. Med. 63 (2), 312-321 (2010).
- Kurhanewicz, J., Vigneron, D. B., et al. Analysis of cancer metabolism by imaging hyperpolarized nuclei: prospects for translation to clinical research. Neoplasia. 13 (2), 81-97 (2011).
- Schroeder, M. A., Cochlin, L. E., Heather, L. C., Clarke, K., Radda, G. K., Tyler, D. J. In vivo assessment of pyruvate dehydrogenase flux in the heart using hyperpolarized carbon-13 magnetic resonance. Proc. Natl. Acad. Sci. U. S. A. 105 (33), 12051-12056 (2008).
- Zierhut, M. L., Yen, Y. -. F., et al. Kinetic modeling of hyperpolarized 13C1-pyruvate metabolism in normal rats and TRAMP mice. J. Magn. Reson. 202 (1), 85-92 (2010).
- Dennis, L. K., Resnick, M. I. Analysis of recent trends in prostate cancer incidence and mortality. Prostate. 42 (4), 247-252 (2000).
- Jambor, I., Borra, R., et al. Functional imaging of localized prostate cancer aggressiveness using 11C-acetate PET/CT and 1H-MR spectroscopy. J. Nucl. Med. 51 (11), 1676-1683 (2010).
- Presti, J. C. J., Hricak, H., Narayan, P. A., Shinohara, K., White, S., Carroll, P. R. Local staging of prostatic carcinoma: comparison of transrectal sonography and endorectal MR imaging. AJR. Am. J. Roentgenol. 166 (1), 103-108 (1996).
- Schulte, R. F., Sacolick, L., et al. Transmit gain calibration for nonproton MR using the Bloch-Siegert shift. NMR Biomed. 24 (9), 1068-1072 (2011).
- Durst, M., Koellisch, U., et al. Comparison of acquisition schemes for hyperpolarised (1)(3)C imaging. NMR Biomed. 28 (6), 715-725 (2015).
- Janich, M. A., Menzel, M. I., et al. Effects of pyruvate dose on in vivo metabolism and quantification of hyperpolarized (1)(3)C spectra. NMR Biomed. 25 (1), 142-151 (2012).
- Harrison, C., Yang, C., et al. Comparison of kinetic models for analysis of pyruvate-to-lactate exchange by hyperpolarized 13 C NMR. NMR Biomed. 25 (11), 1286-1294 (2012).
- Gómez Damián, P. A., Sperl, J. I., et al. Multisite Kinetic Modeling of (13)C Metabolic MR Using [1-(13)C]Pyruvate. Radiol. Res. Pract. 2014, (2014).
- Talbot, J. -. N., Gutman, F., et al. PET/CT in patients with hepatocellular carcinoma using [(18)F]fluorocholine: preliminary comparison with [(18)F]FDG PET/CT. Eur. J. Nucl. Med. Mol. Imaging. 33 (11), 1285-1289 (2006).
- Reeder, S. B., Pineda, A. R., et al. Iterative decomposition of water and fat with echo asymmetry and least-squares estimation (IDEAL): application with fast spin-echo imaging. Magn. Reson. Med. 54 (3), 636-644 (2005).
- Laustsen, C., Ostergaard, J. A., et al. Assessment of early diabetic renal changes with hyperpolarized [1-(13) C]pyruvate. Diabetes. Metab. Res. Rev. 29 (2), 125-129 (2013).
- Serrao, E. M., Brindle, K. M. Potential Clinical Roles for Metabolic Imaging with Hyperpolarized [1-(13)C]Pyruvate. Front. Oncol. 6, 59 (2016).

