hyperpolarized<sup> 13</sup> C Metabolsk Magnetic Resonance spektroskopi og avbildning
Summary
Dynamic nuclear polarization with subsequent sample dissolution has enabled real-time studies of metabolism in biological systems. Hyperpolarized [1-13C]pyruvate was used to study lactate dehydrogenase activity in a prostate carcinoma cell line in vitro.
Abstract
I de siste tiårene har nye metoder for svulst staging, restaging, behandlingsrespons overvåking, og tilbakefall deteksjon av en rekke kreftformer dukket opp i forbindelse med state-of-the-art positronemisjonstomografi med 18 F-fluorodeoxyglucose ([18 F ] -FDG PET). 13 C magnetisk resonansavbildning spektroskopiske (13 CMRSI) er en minimal invasiv avbildningsmetode som muliggjør overvåking av metabolisme in vivo og i sanntid. Som med en hvilken som helst annen metode basert på 13C kjernemagnetisk resonans (NMR), står det utfordringen med lav termisk polarisering og en påfølgende lavt signal-til-støy-forhold på grunn av den relativt lave gyromagnetiske forhold på 13 C og dets lave naturlige overflod i biologiske prøver. Ved å overvinne disse begrensningene, har dynamisk atom polarisering (DNP) med påfølgende prøven oppløsning nylig aktivert brukte NMR og magnetisk resonans imaging (MRI) systemer for å måle, Studere og bilde viktige metabolske veier i ulike biologiske systemer. En spesielt interessant og lovende molekyl som brukes i 13 CMRSI er [1- 13 C] pyruvat, som i de siste ti årene, har vært mye brukt for in vitro, preklinisk, og nå nylig, kliniske studier for å undersøke den cellulære energiomsetningen i kreft og andre sykdommer. I denne artikkelen skissere vi teknikken for oppløsning DNP bruke en 3,35 T preklinisk DNP hyperpolarizer og demonstrere bruken i in vitro studier. En tilsvarende protokoll for hyperpolarization kan brukes for det meste i in vivo studier i tillegg. For å gjøre dette, anvendte vi laktatdehydrogenase (LDH) og katalyserte den metabolske reaksjon av [1- 13C] pyruvat til [1- 13C] laktat i en prostata carcinoma cellelinje, PC3, in vitro ved anvendelse av 13 CMRSI.
Introduction
For tiden er det mest brukte klinisk metode for tumor oppsetning, restaging, behandling respons overvåking, og gjentakelse påvisning av en rekke forskjellige krefttyper er [18F] -FDG PET. 1 Men nylig, flere nye og alternative tilnærminger har dukket opp. En av disse metodene er 13 CMRSI. Denne teknikk innebærer innføring av det 13 C-molekyl i en biologisk prøve, etterfulgt av minimalt invasiv MR for å vurdere metabolisme in vitro eller in vivo i sanntid. Ikke desto mindre, det største utfordringen i 13 CMRSI, sammenlignet med andre metoder som for eksempel [18F] -FDG PET eller computertomografi, er dens lave signal-til-støy-forhold.
NMR-signalet er direkte proporsjonal med graden av polarisering, et forhold av spinn ½ kjerner populasjonsdifferanse i to energitilstander til den totale populasjonen (figur 1A). Polariseringen er et produkt av the gyromagnetiske forhold (γ) av kjernene, og det påførte magnetiske feltstyrken over temperatur. En typisk polarisering av 1 H-kjerner er i størrelsesorden 0,001% til 0,005% etter 3 T, noe som gir en relativt dårlig signal-til-støy-forhold. Dagens state-of-the-art MR har vært en vellykket avbildningsmetode bare på grunn av den høye overflod av en H i biologiske prøver og den høye gyromagnetiske forholdet 1 H (y 1 H = 42,576 MHz / T). Imidlertid observere andre kjerner, slik som karbon, er mer krevende. Den eneste stabile, magnetisk aktivt karbon isotop, 13 C, utgjør bare 1,1% av alle karbonatomer. I tillegg er det gyromagnetiske forholdet mellom 13 C (γ 13C = 10,705 MHz / T) fire ganger lavere enn for en H, som fører til en lavere deteksjonseffektivitet. Oppsummert, den lave 13 C overflod og lav γ 13C forårsake brann 13 C-målinger for å oppnå 0,0176% av følsomheten av en 1H-NMR-måling in vivo.
Dynamisk Nuclear Polarisering
En fremgangsmåte for å overvinne den relativt dårlige følsomhet av 13 C-målinger er DNP. Det ble opprinnelig beskrevet for metaller i 1953 av Albert W. Hauser. I sin artikkel, uttalte han: «Det er vist at dersom elektronspinn resonans av lednings elektroner er mettet, vil kjernen bli polarisert i samme grad de ville være hvis deres gyromagnetiske forholdet var at av elektronspinn." 2 Senere det året, Carver og Slichter eksperimentelt bekreftet Hauser hypotese 3. I 1958 Abragam og Proctor beskrevet denne effekten for elektroner i væsker og kalte det for "solid effekt." Ved temperaturer under 4 K, når elektron-spinn polarisering nesten 100%, og er mer enn tre størrelsesordener høyere enn atom-spinn polarisering (figur 1B) 4. Thans oppstår fordi det gyromagnetiske forholdet mellom elektronet (γ e = 28024,944 MHz / T) er tre størrelsesordener høyere enn de nukleære gyromagnetiske forholdstall. De svake interaksjoner mellom elektroner og kjerner, slik som Overhauser-effekten, det faste stoff effekt, krysseffekten, og den termiske blandeeffekt, tillate overføring av polarisasjonen fra elektron-spinn til kjernespinn ved hjelp av mikrobølgestråling med en frekvens i nærheten av den tilsvarende elektron paramagnetisk resonans (EPR) frekvens 5,6. DNP teorien har blitt videreutviklet for å involvere flere elektroner og termisk blanding. Likevel, til dags dato, ingen enhetlig kvantitativ teoretisk beskrivelse av DNP er publisert 7,8.
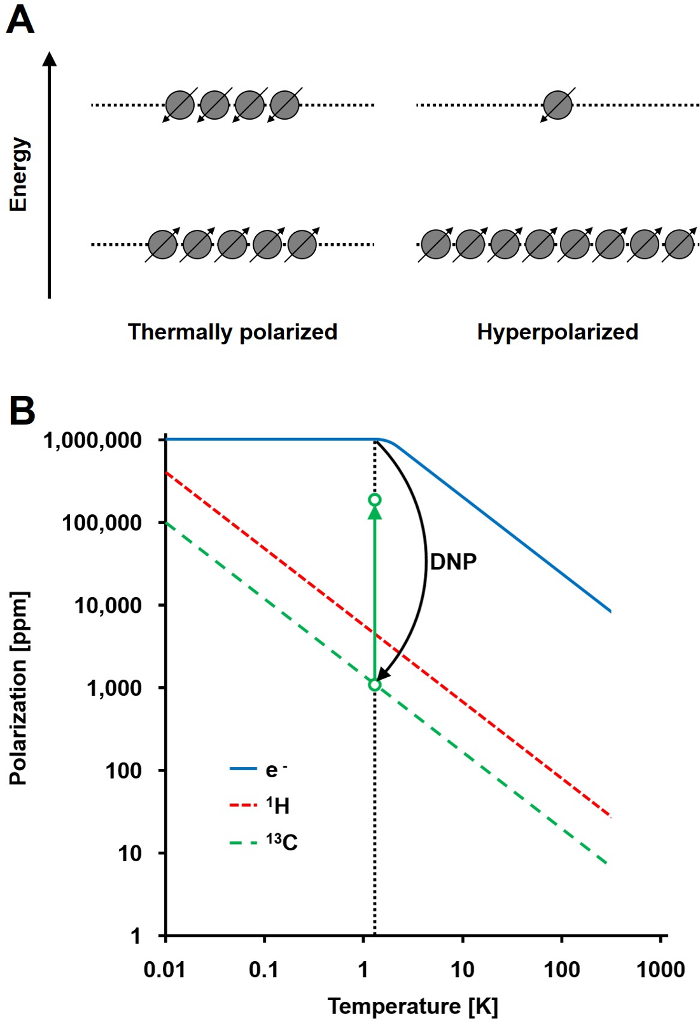
Figur 1: Forstå Dynamic Nuclear Polarisering og hyperpolarisering. A) En skjematisk sammenligning av spinn populasjoneni termisk likevekt polarisasjonstilstand og den hyperpolariserte tilstand. B) Den polariseringen er avhengig av temperaturen. Polariseringen av et elektron (e -) når 100% under 1,4 K. DNP tillater overføring av polarisasjonen fra e- til de 13 C-kjernene, noe som øker deres polarisasjon inntil 10 5 fold. Klikk her for å se en større versjon av dette tallet.
Å introdusere DNP i studier av biologiske systemer ved hjelp av 13C, påfølgende rask sample oppløsning måtte utvikles. 50 år etter Hauser hypotese, Jan H. Ardenkjaer-Larsen et al. løst teknisk utfordrende problemet med å bringe den hyperpolariserte frosne prøve i flytende tilstand med minimalt tap hyperpolarisering 6. Oppløsning DNP åpnet et nytt forskningsfelt som heter 13 pliktige CMR-stofferJeg, som gir en ny metode for å undersøke og karakterisere ulike sykdomstilstander 9,10. Som stabile bærere av et uparet elektron, en trityl- radikal tris (8-karboksy-2,2,6,6-tetra (hydroksyetyl) -benzo- [1,2-4,5] -bis- (1,3) -dithiole-4-yl) -metyl-natriumsalt (OX063) eller (2,2,6,6-tetrametylpiperidin-1-yl) oksyl (TEMPO) blir vanligvis anvendt. Disse er blandet med den ønskede 13 C-merket molekyl og utsatt for mikrobølgestråling med en frekvens i nærheten av den tilsvarende EPR frekvens. Ved hjelp av denne teknikken, kan polarisasjonen av 13 C-kjerner økes opp til 37% 11. Dette resulterer i en 10 5-doble polarisasjon forbedring sammenlignet med den termiske likevekt polarisasjonen 11,12. Men så snart som den mikrobølgebestråling er stoppet og / eller den 13 C-molekylet er overført til flytende tilstand, avtar den polarisasjon med den langsgående relaksasjonstid (T 1) av 13C kjernen som ble polarisert. Dermed blirOppfinnelsen av raske oppløsnings teknikker eller eventuelle senere teknikk forkorte tiden før eksperimentell måling (dvs. injeksjon) er avgjørende for biologiske applikasjoner 13.
Det er tre store krav at kandidaten molekylet trenger for å oppfylle for vellykkede 13 CMRSI studier. For det første har 13 C-kjernen av interesse å ha en tilstrekkelig lang T 1 (> 10 s). Valget av det 13 C-etikett er avgjørende. Den beste kandidaten kjerner er karboner med ingen direkte kontakt med 1 H-kjerner via en obligasjon. Det må også bli hurtig metabolisert i løpet av 2 – 3 T 1 ganger, noe som resulterer i en nedstrøms metabolsk produkt med en vesentlig forskjellig kjemisk skift fra den opprinnelige substans. Prøveblandingen må også danne et amorft glass når den er i en fast tilstand, slik at den romlige fordelingen avtar avstanden mellom elektronet og 13 C, slik at det transfer av polarisering. Hvis kandidaten molekylet ikke danner amorft glass naturlig, må det være meget oppløselig i et glassing middel, slik som glycerol eller dimetylsulfoksyd 14. Disse kravene fører til et forholdsvis lite antall kandidatmolekyler. Imidlertid, selv etter en vellykket oppdagelsen av en egnet molekyl, utvikle en arbeidsprotokoll for hyperpolarisering kan være teknisk utfordrende 9,14,15.
I de senere årene har flere substrater vært vellykket polarisert, for eksempel [1- 13C] pyruvat 12,16 – 36, [2- 13C] pyruvat 37, [1- 13C] etyl-pyruvat 38, [1- 13 C ] laktat 39, [1- 13C] fumarat 40-43, 13 C-bikarbonat 36,44,45, [1- 13C] natriumacetat 43,46 – 49, 13C-urea 6,36,50,51 , [5- 13 C] glutamine 15,52,53, [1- 13C] glutamat 53,54, [1- 13 C] 2-oksoglutarat 55, [1- 13C] alanin, og andre 14,56. En spesielt interessant og som vanligvis brukes substrat for hyperpolarisering er [1- 13C] pyruvat. Den er mye brukt i prekliniske studier for å undersøke den cellulære energiomsetningen i ulike sykdommer 14,17,22. [1- 13C] pyruvat oppfyller alle krav for vellykket hyperpolarisering, blant annet en forholdsvis lang T 1 og rask transport over cellemembranen før senere blir metabolisert. Prekliniske studier med [1- 13 C] pyruvat blir nå oversatt til klinikken 57.
Metabolisme av Pyruvate
Det er vel kjent at det er en direkte sammenheng mellom mutasjoner i en kreftcellenes DNA og endringer i deres metabolske veier. Allerede på 1920-tallet, Otto Warburg discovket at det er en økt metabolisme av glukose og produksjon av laktat i tumorer sammenlignet med friskt vev 58-60. Deretter diverse alter på andre metabolske veier, slik som den pentose-fosfat svei, den trikarboksylsyre syklus, oksidativ fosforylering, og syntese av nukleotider og lipider, er blitt beskrevet.
Pyruvat er sluttproduktet av glykolyse. I tumoren, gjennomgår det anaerob glykolyse katalysert av LDH 61 og reagerer med den reduserte formen av nikotinamidadenindinukleotid koenzym (NADH), som resulterer i laktat og den oksyderte formen av koenzym (NAD +). Alternativt, gjennomgår pyruvat en trans reaksjon med glutamat for å danne alanin, katalysert av alanin transaminase (ALT). Begge reaksjoner er lett reversibel. Pyruvat også gjennomgår dekarboksylering katalysert av pyruvat dehydrogenase (PDH) til karbondioksyd og acetyl-CoA, representing en irreversibel reaksjon på dette trinnet. Alter i disse reaksjonshastigheter kan knyttes til tumor metabolisme 17,21,22,25,62. De metabolske baner er oppsummert i figur 2.

Figur 2: Skisse av større metabolsk reaksjon av pyruvat. Pyruvat / laktat konvertering er katalysert av LDH, og pyruvat / alanin konvertering katalyseres av ALT. Pyruvat er irreversibelt omdannet til acetyl-CoA og CO to av PDH, og CO 2 er i et pH-avhengig likevekt med bikarbonat 80. Klikk her for å se en større versjon av dette tallet.
Påvisningen av hyperpolariserte [1- 13C] pyruvat og dets metabolitter er tidligere blitt påvist i rotte hanart 37,63 – 65, lever 66, muskler og nyrer 62,67. En studie viste signifikante forskjeller i laktat-til-alanine forholdet mellom normal og fastet rottelever 66 og demonstrert en svært forhøyet og hyperpolarized [1- 13 C] laktatnivå i leveren kreft 68,69. Det er dokumentert at svulsten klasse kan identifiseres i en transgen adenokarsinom i mus prostata (TRAMP) med hyperpolarized [1- 13 C] pyruvat 22, med Hyperpolariserte laktatnivåer som viser en høy korrelasjon med histologisk grad av skåret svulster. Den alanine katalysert fra pyruvat ved ALT har også blitt foreslått som en nyttig markør i rotteleverkreft 23.
Måling av pyruvat-laktat metabolsk fluks har blitt brukt for å overvåke iskemi 63,65,70 og som en respons på behandling med cytotoksisk kjemoterapi 17,40, målrettede medikamenter <sup> 24,25,41 eller strålebehandling 26 i dyremodeller. Det har også blitt brukt for påvisning av fosfatidylinositol 3-kinase (PI3K) inhibitor LY294002 reaksjon med glioblastom og brystkreft musemodeller 25. Endringer i pyruvat stoffskiftet i hjernen tumorer 26 og prostatakreft 24,71 er også observert etter behandling.
prostata Carcinoma
Prostata kreft er den dominerende kreft hos eldre menn og den nest største kreft knyttet til død hos menn over hele verden 72. Til dags dato ingen pålitelig, ikke-invasive metoder for tidlig diagnose og karakterisering av prostatakreft 73,74, understreker det akutte behovet for nye metabolske bildeteknikker for å muliggjøre strenge deteksjon og iscenesettelse av pasienter. Prostata carcinoma ble anvendt som en modell for å demonstrere muligheten for oppløsnings DNP kombinert med 13 CMRSI i pasientenss 57. Dette arbeidet ble videreført i en første klinisk studie ansette [1- 13 C] pyruvat og 13 CMRSI for avbildning av prostata kreft, og det har bare nylig har blitt fullført (NCT01229618).
Bakgrunnen for dette arbeidet var å illustrere mer detaljert og for et større publikum anvendelse av 13 CMRSI metoden i en preklinisk omgivelser med celler. Måling av LDH-katalysert metabolisme av [1- 13C] pyruvat til [1- 13C] laktat in vitro i PC3 prostata carcinoma-cellelinjen, viser at det er mulig anvendelse av oppløsnings DNP i in vitro studier, og ta opp de avgjørende skritt og utfordringer under eksperimentene.
Protocol
Representative Results
Discussion
13 CMRSI med Hyperpolariserte prober er en lovende metode for å overvåke metabolisme i sann tid in vitro og in vivo. Ett meget viktig aspekt ved anvendelse av denne eksperimentelle fremgangsmåte er den riktige standardisering, spesielt når det gjelder in vitro-eksperimenter. Først må fremstillingen av prøven som skal gjøres riktig og konsekvent å oppnå samme konsentrasjon av hyperpolariserte materiale i hvert eksperiment. Dette krever en nøyaktig veiing av både prøven t…
Disclosures
The authors have nothing to disclose.
Acknowledgements
E.K. gratefully acknowledges the support of the Graduate School of Bioengineering (GSB) at Technische Universität München. This work was supported by the German Research Foundation (DFG) within the SFB Collaborative Research Center 824, “Imaging for Selection, Monitoring, and Individualization of Cancer Therapies.”
Materials
| HyperSense DNP Polariser | Oxford Instruments | 3.35 T preclinical DNP hyperpolarizer | |
| GE/Agilent MR901 | GE Healthcare/Agilent Technologies | 7 T preclinical MRI scanner, with small bore designed for experiments onrodent | |
| Spinsolve Carbon | Magritek | 1 T NMR spectrometer with permanent magnet | |
| Deuterium Oxide | Sigma Aldrich | 7789-20-0 | |
| Sodium phosphate dibasic | Sigma Aldrich | 7558-79-4 | |
| Sodium phosphate monbasic | Sigma Aldrich | 7558-80-7 | |
| Sodium hydroxide | Sigma Aldrich | 1310-73-2 | |
| Disodium edetate | Sigma Aldrich | 6381-92-6 | |
| Pyruvic acid – 13C1 | Cambridge Isotopes Laboratories | CLM-8077-1 | |
| Dotarem (0.5 mmol/L) | Guerbet | gadoterate meglumine | |
| tris (8-carboxy-2,2,6,6-tetra-(hydroxyethyl)-benzo-[1,2–4,5]-bis-(1,3)-dithiole-4-yl)-methyl sodium salt (OX063) | GE Healthcare | trityl radical used as a sourse of free electron | |
| PC3 cell line | ATCC | CRL1435 | |
| F-12K medium | ATCC | 30-2004 | |
| Fetal Bovine Serum | ATCC | SCRR-30-2020 | |
| Trypsine-EDTA Solution, 1X | ATCC | 30-2101 | |
| Sample plastic cup | Oxford Instruments | ||
| Trypan blue | Bio-Rad | 145-0013-MSDS |
References
- Rohren, E. M., Turkington, T. G., Coleman, R. E. Clinical applications of PET in oncology. Radiology. 231 (2), 305-332 (2004).
- Overhauser, A. W. Polarization of Nuclei in Metals. Phys. Rev. 92 (2), 411-415 (1953).
- Carver, T. R., Slichter, C. P. Polarization of Nuclear Spins in Metals. Phys. Rev. 92 (1), 212-213 (1953).
- Abragam, A., Proctor, W. G. Spin Temperature. Phys. Rev. 109 (5), 1441-1458 (1958).
- Abragam, a., Goldman, M. Principles of dynamic nuclear polarisation. Reports Prog. Phys. 41 (3), 395-467 (2001).
- Ardenkjaer-Larsen, J. H., Fridlund, B., et al. Increase in signal-to-noise ratio of > 10,000 times in liquid-state NMR. Proc. Natl. Acad. Sci. U. S. A. 100 (18), 10158-10163 (2003).
- Shimon, D., Hovav, Y., Feintuch, A., Goldfarb, D., Vega, S. Dynamic nuclear polarization in the solid state: a transition between the cross effect and the solid effect. Phys. Chem. Chem. Phys. 14 (16), 5729-5743 (2012).
- Serra, S. C., Rosso, A., Tedoldi, F. Electron and nuclear spin dynamics in the thermal mixing model of dynamic nuclear polarization. Phys. Chem. Chem. Phys. 14 (38), 13299-13308 (2012).
- Gallagher, F. A., Kettunen, M. I., Brindle, K. M. Biomedical applications of hyperpolarized 13C magnetic resonance imaging. Prog. Nucl. Magn. Reson. Spectrosc. 55 (4), 285-295 (2009).
- Hurd, R. E., Yen, Y. -. F., Chen, A., Ardenkjaer-Larsen, J. H. Hyperpolarized 13C metabolic imaging using dissolution dynamic nuclear polarization. J. Magn. Reson. Imaging. 36 (6), 1314-1328 (2012).
- Ardenkjaer-Larsen, J. H., Fridlund, B., et al. Increase in signal-to-noise ratio of > 10,000 times in liquid-state NMR. Proc. Natl. Acad. Sci. U. S. A. 100 (18), 10158-10163 (2003).
- Golman, K., in’t Zandt, R., Thaning, M. Real-time metabolic imaging. Proc. Natl. Acad. Sci. 103 (30), 11270-11275 (2006).
- Comment, A., Rentsch, J., et al. Producing over 100 ml of highly concentrated hyperpolarized solution by means of dissolution DNP. J. Magn. Reson. 194 (1), 152-155 (2008).
- Brindle, K. M., Bohndiek, S. E., Gallagher, F. A., Kettunen, M. I. Tumor imaging using hyperpolarized 13C magnetic resonance spectroscopy. Magn. Reson. Med. 66 (2), 505-519 (2011).
- Gallagher, F. A., Kettunen, M. I., Day, S. E., Lerche, M., Brindle, K. M. 13C MR spectroscopy measurements of glutaminase activity in human hepatocellular carcinoma cells using hyperpolarized 13C-labeled glutamine. Magn. Reson. Med. 60 (2), 253-257 (2008).
- Chen, A. P., Albers, M. J., et al. Hyperpolarized C-13 spectroscopic imaging of the TRAMP mouse at 3T-initial experience. Magn. Reson. Med. 58 (6), 1099-1106 (2007).
- Day, S. E., Kettunen, M. I., et al. Detecting tumor response to treatment using hyperpolarized 13C magnetic resonance imaging and spectroscopy. Nat. Med. 13 (11), 1382-1387 (2007).
- Schroeder, M. A., Swietach, P., et al. Measuring intracellular pH in the heart using hyperpolarized carbon dioxide and bicarbonate: a 13C and 31P magnetic resonance spectroscopy study. Cardiovasc. Res. 86 (1), 82-91 (2010).
- Hurd, R. E., Yen, Y. -. F., Tropp, J., Pfefferbaum, A., Spielman, D. M., Mayer, D. Cerebral dynamics and metabolism of hyperpolarized [1-(13)C]pyruvate using time-resolved MR spectroscopic imaging. J. Cereb. Blood Flow Metab. 30 (13), 1734-1741 (2010).
- Golman, K., Zandt, R. I., Lerche, M., Pehrson, R., Ardenkjaer-Larsen, J. H. Metabolic imaging by hyperpolarized 13C magnetic resonance imaging for in vivo tumor diagnosis. Cancer Res. 66 (22), 10855-10860 (2006).
- Park, I., Larson, P. E. Z., et al. Hyperpolarized 13C magnetic resonance metabolic imaging: application to brain tumors. Neuro. Oncol. 12 (2), 133-144 (2010).
- Albers, M. J., Bok, R., et al. Hyperpolarized 13C lactate, pyruvate, and alanine: noninvasive biomarkers for prostate cancer detection and grading. Cancer Res. 68 (20), 8607-8615 (2008).
- Yen, Y. -. F., Le Roux, P., et al. T(2) relaxation times of (13)C metabolites in a rat hepatocellular carcinoma model measured in vivo using (13)C-MRS of hyperpolarized [1-(13)C]pyruvate. NMR Biomed. 23 (4), 414-423 (2010).
- Dafni, H., Larson, P. E. Z., et al. Hyperpolarized 13C spectroscopic imaging informs on hypoxia-inducible factor-1 and myc activity downstream of platelet-derived growth factor receptor. Cancer Res. 70 (19), 7400-7410 (2010).
- Ward, C. S., Venkatesh, H. S., et al. Noninvasive detection of target modulation following phosphatidylinositol 3-kinase inhibition using hyperpolarized 13C magnetic resonance spectroscopy. Cancer Res. 70 (4), 1296-1305 (2010).
- Day, S. E., Kettunen, M. I., et al. Detecting response of rat C6 glioma tumors to radiotherapy using hyperpolarized [1- 13C]pyruvate and 13C magnetic resonance spectroscopic imaging. Magn. Reson. Med. 65 (2), 557-563 (2011).
- Johannesson, H., Macholl, S., Ardenkjaer-Larsen, J. H. Dynamic Nuclear Polarization of [1-13C]pyruvic acid at 4.6 tesla. J. Magn. Reson. 197 (2), 167-175 (2009).
- Durst, M., Koellisch, U., et al. Bolus tracking for improved metabolic imaging of hyperpolarised compounds. J. Magn. Reson. 243, 40-46 (2014).
- Khegai, O., Schulte, R. F., et al. Apparent rate constant mapping using hyperpolarized [1-(13)C]pyruvate. NMR Biomed. 27 (10), 1256-1265 (2014).
- Sogaard, L. V., Schilling, F., Janich, M. A., Menzel, M. I., Ardenkjaer-Larsen, J. H. In vivo measurement of apparent diffusion coefficients of hyperpolarized (1)(3)C-labeled metabolites. NMR Biomed. 27 (5), 561-569 (2014).
- Aquaro, G. D., Frijia, F., et al. 3D CMR mapping of metabolism by hyperpolarized 13C-pyruvate in ischemia-reperfusion. JACC. Cardiovasc. Imaging. 6 (6), 743-744 (2013).
- Menzel, M. I., Farrell, E. V., et al. Multimodal assessment of in vivo metabolism with hyperpolarized [1-13C]MR spectroscopy and 18F-FDG PET imaging in hepatocellular carcinoma tumor-bearing rats. J. Nucl. Med. 54 (7), 1113-1119 (2013).
- Schilling, F., Duwel, S., et al. Diffusion of hyperpolarized (13) C-metabolites in tumor cell spheroids using real-time NMR spectroscopy. NMR Biomed. 26 (5), 557-568 (2013).
- Schulte, R. F., Sperl, J. I., et al. Saturation-recovery metabolic-exchange rate imaging with hyperpolarized [1-13C] pyruvate using spectral-spatial excitation. Magn. Reson. Med. 69 (5), 1209-1216 (2013).
- Wiesinger, F., Weidl, E., et al. IDEAL spiral CSI for dynamic metabolic MR imaging of hyperpolarized [1-13C]pyruvate. Magn. Reson. Med. 68 (1), 8-16 (2012).
- Wilson, D. M., Keshari, K. R., et al. Multi-compound polarization by DNP allows simultaneous assessment of multiple enzymatic activities in vivo. J. Magn. Reson. 205 (1), 141-147 (2010).
- Schroeder, M. A., Atherton, H. J., et al. Real-time assessment of Krebs cycle metabolism using hyperpolarized 13C magnetic resonance spectroscopy. FASEB J. Off. Publ. Fed. Am. Soc. Exp. Biol. 23 (8), 2529-2538 (2009).
- Hurd, R. E., Yen, Y. -. F., et al. Metabolic imaging in the anesthetized rat brain using hyperpolarized [1-13C] pyruvate and [1-13C] ethyl pyruvate. Magn. Reson. Med. 63 (5), 1137-1143 (2010).
- Chen, A. P., Kurhanewicz, J., et al. Feasibility of using hyperpolarized [1-13C]lactate as a substrate for in vivo metabolic 13C MRSI studies. Magn. Reson. Imaging. 26 (6), 721-726 (2008).
- Witney, T. H., Kettunen, M. I., et al. Detecting treatment response in a model of human breast adenocarcinoma using hyperpolarised [1-(13)C]pyruvate and. Br. J. Cancer. 103 (9), 1400-1406 (2010).
- Bohndiek, S. E., Kettunen, M. I., et al. Detecting tumor response to a vascular disrupting agent using hyperpolarized (13)C magnetic resonance spectroscopy. Mol. Cancer Ther. 9 (12), 3278-3288 (2010).
- Gallagher, F. A., Kettunen, M. I., et al. Production of hyperpolarized [1,4-13C2]malate from [1,4-13C2]fumarate is a marker of cell necrosis and treatment response in tumors. Proc. Natl. Acad. Sci. U. S. A. 106 (47), 19801-19806 (2009).
- Jensen, P. R., Peitersen, T., et al. Tissue-specific short chain fatty acid metabolism and slow metabolic recovery after ischemia from hyperpolarized NMR in vivo. J. Biol. Chem. 284 (52), 36077-36082 (2009).
- Gallagher, F. A., Kettunen, M. I., et al. Magnetic resonance imaging of pH in vivo using hyperpolarized 13C-labelled bicarbonate. Nature. 453 (7197), 940-943 (2008).
- Scholz, D. J., Janich, M. A., et al. Quantified pH imaging with hyperpolarized 13C-bicarbonate. Magn. Reson. Med. 73 (6), 2274-2282 (2015).
- Koellisch, U., Gringeri, C. V., et al. Metabolic imaging of hyperpolarized [1-(13) C]acetate and [1-(13) C]acetylcarnitine – investigation of the influence of dobutamine induced stress. Magn. Reson. Med. 74 (4), 1011-1018 (2015).
- Koellisch, U., Laustsen, C., et al. Investigation of metabolic changes in STZ-induced diabetic rats with hyperpolarized [1-13C]acetate. Physiol. Rep. 3 (8), (2015).
- Jensen, P. R., Meier, S., Ardenkjaer-Larsen, J. H., Duus, J. O., Karlsson, M., Lerche, M. H. Detection of low-populated reaction intermediates with hyperpolarized NMR. Chem. Commun. (34), 5168-5170 (2009).
- Koelsch, B. L., Keshari, K. R., Peeters, T. H., Larson, P. E. Z., Wilson, D. M., Kurhanewicz, J. Diffusion MR of hyperpolarized 13C molecules in solution. Analyst. 138 (4), 1011-1014 (2013).
- Golman, K., Ardenkjaer-Larsen, J. H., Petersson, J. S., Mansson, S., Leunbach, I. Molecular imaging with endogenous substances. Proc. Natl. Acad. Sci. U. S. A. 100 (18), 10435-10439 (2003).
- von Morze, C., Larson, P. E. Z., et al. Imaging of Blood Flow Using Hyperpolarized [(13)C]Urea in Preclinical Cancer Models. J. Magn. Reson. Imaging. 33 (3), 692-697 (2011).
- Chiavazza, E., Kubala, E., et al. Earth’s magnetic field enabled scalar coupling relaxation of 13C nuclei bound to fast-relaxing quadrupolar 14N in amide groups. J. Magn. Reson. 227, 35-38 (2013).
- Jensen, P. R., Karlsson, M., Meier, S., Duus, J., Lerche, M. H. Hyperpolarized amino acids for in vivo assays of transaminase activity. Chem. – A Eur. J. 15 (39), 10010-10012 (2009).
- Gallagher, F. A., Kettunen, M. I., et al. Detection of tumor glutamate metabolism in vivo using 13C magnetic resonance spectroscopy and hyperpolarized [1-13C]glutamate. Magn. Reson. Med. 66 (1), 18-23 (2011).
- Chaumeil, M. M., Larson, P. E. Z., et al. Hyperpolarized [1-13C] glutamate: a metabolic imaging biomarker of IDH1 mutational status in glioma. Cancer Res. 74 (16), 4247-4257 (2014).
- Keshari, K. R., Wilson, D. M. Chemistry and biochemistry of 13C hyperpolarized magnetic resonance using dynamic nuclear polarization. Chem. Soc. Rev. 43 (5), 1627-1659 (2014).
- Nelson, S. J., Kurhanewicz, J., et al. Metabolic Imaging of Patients with Prostate Cancer Using Hyperpolarized [1-13C]Pyruvate. Sci. Transl. Med. 5 (198), (2013).
- Warburg, O. On the origin of cancer cells. Science. 123 (3191), 309-314 (1956).
- Warburg, O., Wind, F., Negelein, E. {Ü}ber den Stoffwechsel von Tumoren im K{ö}rper. Klin. Wochenschr. 5 (19), 829-832 (1926).
- Barnes, A. B., De Paepe, G., et al. High-Field Dynamic Nuclear Polarization for Solid and Solution. Biological NMR. Appl. Magn. Reson. 34 (3-4), 237-263 (2008).
- Koukourakis, M. I., Giatromanolaki, A., Sivridis, E., Gatter, K. C., Harris, A. L. Pyruvate dehydrogenase and pyruvate dehydrogenase kinase expression in non small cell lung cancer and tumor-associated stroma. Neoplasia. 7 (1), 1-6 (2005).
- Golman, K., Petersson, J. S. Metabolic Imaging and Other Applications of Hyperpolarized 13C1. Acad. Radiol. 13 (8), 932-942 (2016).
- Golman, K., Petersson, J. S., et al. Cardiac metabolism measured noninvasively by hyperpolarized 13C MRI. Magn. Reson. Med. 59 (5), 1005-1013 (2008).
- Merritt, M. E., Harrison, C., Storey, C., Jeffrey, F. M., Sherry, A. D., Malloy, C. R. Hyperpolarized 13C allows a direct measure of flux through a single enzyme-catalyzed step by NMR. Proc. Natl. Acad. Sci. U. S. A. 104 (50), 19773-19777 (2007).
- Merritt, M. E., Harrison, C., Storey, C., Sherry, A. D., Malloy, C. R. Inhibition of carbohydrate oxidation during the first minute of reperfusion after brief ischemia NMR detection of hyperpolarized 13CO2 and H13CO3-. Magn. Reson. Med. 60 (5), 1029-1036 (2008).
- Hu, S., Chen, A. P., et al. In vivo carbon-13 dynamic MRS and MRSI of normal and fasted rat liver with hyperpolarized 13C-pyruvate. Mol. imaging Biol. MIB Off. Publ. Acad. Mol. Imaging. 11 (6), 399-407 (2009).
- Kohler, S. J., Yen, Y., et al. In vivo 13 carbon metabolic imaging at 3T with hyperpolarized 13C-1-pyruvate. Magn. Reson. Med. 58 (1), 65-69 (2007).
- Hu, S., Lustig, M., et al. 3D compressed sensing for highly accelerated hyperpolarized (13)C MRSI with in vivo applications to transgenic mouse models of cancer. Magn. Reson. Med. 63 (2), 312-321 (2010).
- Kurhanewicz, J., Vigneron, D. B., et al. Analysis of cancer metabolism by imaging hyperpolarized nuclei: prospects for translation to clinical research. Neoplasia. 13 (2), 81-97 (2011).
- Schroeder, M. A., Cochlin, L. E., Heather, L. C., Clarke, K., Radda, G. K., Tyler, D. J. In vivo assessment of pyruvate dehydrogenase flux in the heart using hyperpolarized carbon-13 magnetic resonance. Proc. Natl. Acad. Sci. U. S. A. 105 (33), 12051-12056 (2008).
- Zierhut, M. L., Yen, Y. -. F., et al. Kinetic modeling of hyperpolarized 13C1-pyruvate metabolism in normal rats and TRAMP mice. J. Magn. Reson. 202 (1), 85-92 (2010).
- Dennis, L. K., Resnick, M. I. Analysis of recent trends in prostate cancer incidence and mortality. Prostate. 42 (4), 247-252 (2000).
- Jambor, I., Borra, R., et al. Functional imaging of localized prostate cancer aggressiveness using 11C-acetate PET/CT and 1H-MR spectroscopy. J. Nucl. Med. 51 (11), 1676-1683 (2010).
- Presti, J. C. J., Hricak, H., Narayan, P. A., Shinohara, K., White, S., Carroll, P. R. Local staging of prostatic carcinoma: comparison of transrectal sonography and endorectal MR imaging. AJR. Am. J. Roentgenol. 166 (1), 103-108 (1996).
- Schulte, R. F., Sacolick, L., et al. Transmit gain calibration for nonproton MR using the Bloch-Siegert shift. NMR Biomed. 24 (9), 1068-1072 (2011).
- Durst, M., Koellisch, U., et al. Comparison of acquisition schemes for hyperpolarised (1)(3)C imaging. NMR Biomed. 28 (6), 715-725 (2015).
- Janich, M. A., Menzel, M. I., et al. Effects of pyruvate dose on in vivo metabolism and quantification of hyperpolarized (1)(3)C spectra. NMR Biomed. 25 (1), 142-151 (2012).
- Harrison, C., Yang, C., et al. Comparison of kinetic models for analysis of pyruvate-to-lactate exchange by hyperpolarized 13 C NMR. NMR Biomed. 25 (11), 1286-1294 (2012).
- Gómez Damián, P. A., Sperl, J. I., et al. Multisite Kinetic Modeling of (13)C Metabolic MR Using [1-(13)C]Pyruvate. Radiol. Res. Pract. 2014, (2014).
- Talbot, J. -. N., Gutman, F., et al. PET/CT in patients with hepatocellular carcinoma using [(18)F]fluorocholine: preliminary comparison with [(18)F]FDG PET/CT. Eur. J. Nucl. Med. Mol. Imaging. 33 (11), 1285-1289 (2006).
- Reeder, S. B., Pineda, A. R., et al. Iterative decomposition of water and fat with echo asymmetry and least-squares estimation (IDEAL): application with fast spin-echo imaging. Magn. Reson. Med. 54 (3), 636-644 (2005).
- Laustsen, C., Ostergaard, J. A., et al. Assessment of early diabetic renal changes with hyperpolarized [1-(13) C]pyruvate. Diabetes. Metab. Res. Rev. 29 (2), 125-129 (2013).
- Serrao, E. M., Brindle, K. M. Potential Clinical Roles for Metabolic Imaging with Hyperpolarized [1-(13)C]Pyruvate. Front. Oncol. 6, 59 (2016).

