Hyperpolarized<sup> 13</sup> ספקטרוסקופיה בתהודה מגנטית מטבולית C והדמיה
Summary
Dynamic nuclear polarization with subsequent sample dissolution has enabled real-time studies of metabolism in biological systems. Hyperpolarized [1-13C]pyruvate was used to study lactate dehydrogenase activity in a prostate carcinoma cell line in vitro.
Abstract
בעשורים האחרונים, שיטות חדשות עבור staging גידול, restaging, ניטור תגובה לטיפול, וזיהוי ישן בסוגים שונים של הסרטן צמחו בשיתוף עם המדינה- of-the-art טומוגרפיית פליטת פוזיטרונים עם 18 F-fluorodeoxyglucose ([18 F ] -FDG PET). 13 הדמיה ספקטרוסקופיות בתהודה מגנטית C (13 CMRSI) היא שיטת דימות פולשנית המאפשרת ניטור של מטבוליזם in vivo ו בזמן אמת. כמו בכל שיטה אחרת המבוססת על 13 תהודה מגנטית גרעינית C (NMR), היא עומדת בפני האתגר של קיטוב תרמית נמוך יחס אות לרעש נמוך שלאחר מכן עקב יחס gyromagnetic הנמוך היחסי של 13 C והשפע הטבעי הנמוך שלה דגימות ביולוגיות. על ידי להתגבר על המגבלות האלה, קיטוב גרעיני דינמי (DNP) עם פירוק מדגם עוקב אפשר לאחרונה נפוץ תמ"ג תהודה מגנטית (MRI) מערכות למדידה, מחקר, מסלולים מרכזיים מטבולית תמונה במערכות ביולוגיות שונות. במיוחד מולקולה מעניינת ומבטיחה בשימוש 13 CMRSI היא [1- 13 C] פירובט, אשר, בעשר השנים האחרונות, כבר בשימוש נרחב עבור במבחנה, פרה-קליני, ולאחרונה, מחקרים קליניים לחקור את חילוף חומרי אנרגיה התאי בסרטן ומחלות אחרות. במאמר זה, נתאר את הטכניקה של DNP פירוק באמצעות hyperpolarizer DNP פרה-קליני 3.35 T ולהפגין השימוש שלה במבחנה. פרוטוקול דומה עבור hyperpolarization ניתן להחיל על פי רוב במחקרים vivo גם כן. לשם כך, השתמשנו לקטט דהידרוגנאז (LDH) ו catalyzed התגובה המטבולית של [1- 13 C] פירובט ל [1- 13 C] לקטט בקו תא סרטן הערמונית, PC3, במבחנה באמצעות 13 CMRSI.
Introduction
נכון להיום, השיטה הקלינית הנרחבת ביותר עבור staging גידול, restaging, ניטור תגובה לטיפול, וזיהוי הישנות של מגוון רחב של סוגי הסרטן הוא [18 F] -FDG PET. 1 עם זאת, לאחרונה, מספר גישות חדשות ואלטרנטיביות צמחו. אחת השיטות הללו הוא 13 CMRSI. טכניקה זו כרוכה כניסתה של 13 C-מולקולת דגימה ביולוגית, ואחריו MRI פולשנית להעריך את חילוף החומרים במבחנה או in vivo בזמן אמת. עם זאת, האתגר הגדול ביותר של 13 CMRSI, לעומת שיטות אחרות כגון [18 F] -FDG PET או טומוגרפיה ממוחשבת, הוא יחס אות לרעש נמוך שלה.
אות התמ"ג עומדת ביחס ישר לרמת קיטוב, יחס של הבדל אוכלוסיית ספין ½ הגרעינים בשתי מדינות אנרגיה לכלל האוכלוסייה (איור 1 א). הקיטוב הוא מוצר של הדואר יחס gyromagnetic (γ) של הגרעינים ואת עוצמת השדה המגנטי מוחל על הטמפרטורה. קיטוב טיפוסי של 1 גרעיני H הוא בסדר גודל של 0.001% 0.005% ב -3 T, אשר נותן עניים יחסית יחס אות לרעש. המדינה- of-the-art של היום MRI כבר שיטת הדמיה מוצלחת רק בשל השפע הגבוה של 1 H ב דגימות ביולוגיות ויחס gyromagnetic הגבוה של 1 H (γ 1H = 42.576 מגה-רץ / T). עם זאת, התבוננות גרעינים אחרים, כגון פחמן, הוא תובעני יותר. האיזוטופ פחמן יציב, רק פעיל מגנטית, 13 C, מהווה רק 1.1% מכלל אטומי פחמן. בנוסף, היחס gyromagnetic של 13 C (γ 13C = 10.705 מגה-הרץ / T) הוא ארבע פעמים נמוכה מזו של 1 H, שמוביל איתור יעילות נמוכה. לסיכום, את השפע 13 C נמוך 13C γ נמוך לגרום תרמית 13 מדידות C להשיג 0.0176% של רגישות של 1H-NMR מדידה in vivo.
קיטוב גרעיני דינמי
שיטה להתגבר על הרגישות העניה יחסית של 13 מדידות C היא DNP. זה תואר לראשונה על מתכות בשנת 1953 על ידי אלברט וו אוברהאווזר. במאמרו, הוא הצהיר: "זה מוצג שאם תהודת ספין אלקטרון של אלקטרוני ההולכה רוויה, הגרעינים יהיו מקוטבים באותה המידה שהם יהיו אם יחס gyromagnetic שלהם היה של ספין האלקטרון." 2 מאוחר יותר באותה שנה, קארבר Slichter אישר ההשערה של אוברהאווזר ניסיוני 3. בשנת 1958, Abragam ו פרוקטור תיאר את האפקט הזה עבור האלקטרונים נוזלים והפתרון זכה לשם "אפקט מוצק." בטמפרטורות מתחת ל -4 K, קיטוב האלקטרון-ספין מגיע כמעט 100% והוא יותר שלושה סדרי גודל גבוה יותר הקיטוב גרעיני-ספין (איור 1B) 4. Tשלו מתרחש בגלל יחס gyromagnetic של האלקטרון (ה γ = 28024.944 MHz / T) הוא שלושה סדרי גודל גבוה מיחסי gyromagnetic הגרעיניים. האינטראקציות החלשות בין אלקטרונים וגרעינים, כגון אפקט אוברהאווזר, ההשפעה המוצקה, השפעת הצלב, וכן השפעת ערבוב התרמית, לאפשר העברת קיטוב מן אלקטרון ספינים כדי ספינים גרעיניים באמצעות הקרנת מיקרוגל עם תדר קרוב האלקטרון המקביל 5,6 תדר התהודה פאראמגנטיים (EPR). התיאוריה DNP פותחה נוספת לערב יותר אלקטרונים ערבוב תרמית. אף על פי כן, עד כה, שום תיאור תיאורטי כמותית אחידה של DNP פורסם 7,8.
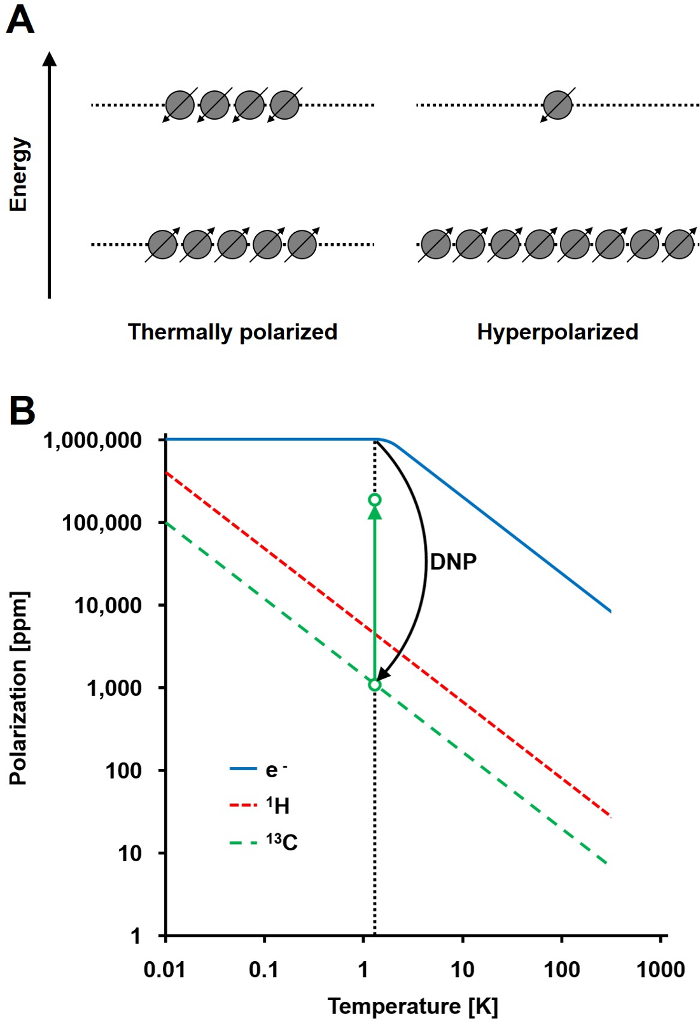
איור 1: הבנה דינמית גרעיני קיטוב hyperpolarization. א) השוואה סכמטי של אוכלוסיית הספיןבמדינת קיטוב שיווי משקל תרמי ומדינת hyperpolarized. ב) הקיטוב תלוי בטמפרטורה. הקיטוב של אלקטרון (ה -) מגיע ל -100% מתחת 1.4 ק DNP מאפשרת העברה של הקיטוב מן אי-מייל 13 הגרעינים C, אשר מגדילה את הקיטוב שלהם עד 10 5 -fold. אנא לחץ כאן כדי לצפות בגרסה גדולה יותר של דמות זו.
כדי להציג DNP במחקרים של מערכות ביולוגיות באמצעות 13 C תמ"ג, פירוק מדגם מהיר שלאחר מכן היה צריך להיות מפותח. 50 שנים אחרי ההשערה של אוברהאווזר, Jan H. Ardenkjaer-לארסן ואח. פתר את הבעיה מאתגר מבחינה טכנית של הבאת מדגם קפוא hyperpolarized למצב נוזלי עם הפסד 6 hyperpolarization מינימלי. DNP פירוק נפתח תחום חדש של מחקר שנקרא 13 CMRSאני, מתן שיטה חדשה לחקור ולאפיין מצב מחלה שונה 9,10. כנישאים יציבים של אלקטרון מזווג, טריס רדיקלי trityl (8-carboxy-2,2,6,6-אַרְבַּע- (hydroxyethyl) -benzo- [1,2-4,5] -bis- (1,3) -dithiole-4-י.ל.) מלח נתרן -methyl (OX063) או (2,2,6,6-Tetramethylpiperidin-1-י.ל) oxyl (TEMPO) משמש בדרך כלל. אלה מעורבבים עם מולקולת C שכותרתו 13 הרצוי חשוף קרינת מיקרוגל עם תדר קרוב לתדר EPR המקביל. באמצעות טכניקה זו, הקיטוב של 13 גרעינים C ניתן להגדיל עד 37% 11. התוצאה הוא שיפור קיטוב 10 5 -fold לעומת קיטוב שיווי משקל תרמי 11,12. עם זאת, ברגע הקרנת המיקרוגל נעצר ו / או 13 C-המולקולה מועברת במצב הנוזלי, הקיטוב דועך עם זמן ההרפיה האורך (T 1) של 13 גרעין C כי היה מקוטב. לפיכך,המצאת טכניקות פירוק מהירות או כל טכניקה עוקבת קיצור הזמן לפני מדידה ניסיונית (כלומר, הזרקה) הוא חיוני עבור יישומים ביולוגיים 13.
ישנן שלוש דרישות מרכזיות כי מולקולת המועמד צריכה למלא עבור 13 מחקרים CMRSI מוצלחים. ראשית, גרעין 13 C של עניין צריך להיות 1 T מספיק ארוך (> 10 שניות). הבחירה של 13 C-התווית הוא קריטי. גרעיני המועמד הטובים ביותר הם פחמנים ללא מגע ישיר עם 1 H-גרעינים באמצעות אג"ח. זה גם צריך להיות מטבוליזם במהירות תוך 2 – 3 פעמים T 1, וכתוצאה מכך מוצר מטבולית המשך בעלי שינוי כימי שונה באופן מהותי מן החומר המקורי. תערובת המדגם חייבת גם מהווה זכוכית אמורפי כאשר במצב מוצק כל כך כי הפריסה המרחבית מקטינה את המרחק בין האלקטרון ו -13 C, המאפשרת טרנסfer של קיטוב. אם מולקולת המועמד אינה יוצרת זכוכית אמורפית טבעית, זה צריך להיות מסיס מאוד סוכן glassing, כגון sulfoxide גליצרול או דימתיל 14. דרישות אלה לגרום למספר קטן יחסית של מולקולות מועמד. עם זאת, גם לאחר הגילוי המוצלח של מולקולה מתאימה, פיתוח פרוטוקול עבודה עבור hyperpolarization יכול להיות מאתגר מבחינה טכנית 9,14,15.
בשנים האחרונות, כמה מצעים כבר מקוטב בהצלחה, כגון [1 13 C] פירובט 12,16 – 36, [2 13 C] פירובט 37, [1 13 C] פירובט אתיל 38, [1 13 C ] לקטט 39, [1 13 C] fumarate 40 – 43, 13 C-ביקרבונט 36,44,45, [1 13 C] נתרן אצטט 43,46 – 49, 13 C-אוריאה 6,36,50,51 , [5 13 C] glutamine 15,52,53, [1 13 C] גלוטמט 53,54, [1 13 C] 2-oxoglutarate 55, [1 13 C] אלאנין, ואחרים 14,56. מצע מעניין במיוחד ונהוגים עבור hyperpolarization הוא [1- 13 C] פירובט. זה נעשה שימוש נרחב במחקרים פרה לחקור את האנרגיה חילוף החומרים התאי במחלות שונות 14,17,22. [1 13 C] פירובט עומד בכל הדרישות עבור hyperpolarization מוצלחת, כולל תחבורה יחסית הארוך T 1 ומהיר על פני קרום התא לפני ובהמשך להיות מפורק. מחקרים פרה עם [1- 13 C] פירובט מתורגמים כרגע למרפאה 57.
מטבוליזם של פירובט
העובדה ידועה היא כי קיים קשר ישיר בין מוטציות DNA של תאים סרטניים ושינויי מסלולי מטבוליים שלהם. כבר בשנת 1920, אוטו ורבורג וגילהered שיש מטבוליזם של גלוקוז ייצור מוגבר של חומצת חלב בגידולים בהשוואה לרקמות בריאות 58 – 60. בהמשך לכך, החילופים שונים מסלולים מטבוליים אחרים, כגון מסלול פנטוז-פוספט, מחזור חומצה tricarboxylic, זרחון חמצוני, ואת סינתזה של נוקלאוטידים ושומנים, תוארו.
פירובט הוא התוצר הסופי של הגליקוליזה. בתוך הגידול, הוא עובר הגליקוליזה אנאירובי מזורזת על ידי LDH 61 ומגיב עם הצורה המצומצמת של dinucleotide אדנין nicotinamide קואנזים (NADH), וכתוצאה מכך לקטט ואת טופס החמצון של קואנזים (NAD +). לחלופין, פירובט עובר תגובת transamination עם הגלוטמט לגבש אלאנין, מזורזת על ידי אלאנין טראנסאמינאז (ALT). תגובות שניהם הפיכות בקלות. פירובט גם עובר decarboxylation מזורזת על ידי פירובט דהידרוגנאז (PDH) פחמן דו חמצני אצטיל-CoA, representing תגובה בלתי הפיכה בשלב זה. חילופים בשיעורי תגובה אלה ניתן לקשר מטבוליזם גידול 17,21,22,25,62. מסלולים מטבוליים מסוכמים באיור 2.

איור 2: תרשים של התגובה המטבולית הגדולה של פירובט. מרת פירובט / לקטט מזורזת על ידי LDH, ו פירובט / מרת אלאנין מזורזת על ידי ALT. פירובט מומר באופן בלתי הפיך כדי אצטיל-CoA ו- CO 2 על ידי PDH, ו- CO 2 הם בשיווי משקל pH התלוי עם 80 ביקרבונט. אנא לחץ כאן כדי לצפות בגרסה גדולה יותר של דמות זו.
הגילוי של hyperpolarized [1- 13 C] פירובט מטבוליטים שלו כבר הוכיח בעבר בחולדה הואאמנות 37,63 – 65, כבד 66, שריר, וכליות 62,67. מחקר אחד הדגים הבדלים משמעותיים ביחס לקטט-אל-אלאנין בין חולדה הכבד נורמלי צם 66 והפגינו רמה [1- 13 C] מוגבה hyperpolarized מאוד לקטט סרטן הכבד 68,69. ישנן ראיות כי בכיתת הגידול ניתן לזהות בתוך אדנוקרצינומה מהונדס של ערמונית עכבר (נווד) באמצעות hyperpolarized [1- 13 C] פירובט 22, עם רמות חומצת חלב hyperpolarized מראות מתאם גבוה עם הכיתה היסטולוגית של בגידולים. אלאנין זרז מן פירובט ידי ALT גם הוצע כסמן שימושי קרצינומה hepatocellular עכברוש 23.
מדידת השטף מטבולית-לקטט פירובט שימש במשך איסכמיה ניטור 63,65,70 וכתגובה לטיפול בכימותרפיה ציטוטוקסית 17,40, תרופות ממוקדות <sup> 24,25,41, או רדיותרפיה 26 במודלים של בעלי חיים. כמו כן נעשה שימוש לצורך זיהוי של התגובה LY294002 מעכב 3-kinase phosphatidylinositol (PI3K) במודלים של עכברים גליובלסטומה וסרטן השד 25. שינויים במטבוליזם פירובט במוח גידולים 26 וסרטן הערמונית 24,71 גם נצפו לאחר הטיפול.
הערמונית קרצינומה
קרצינומה של הערמונית הוא הסרטן משתלט בגברים קשישים הסרטן המובילה השנייה הקשורים למוות בקרב גברים ברחבי העולם 72. עד כה, אף אחת משיטות אמינות, לא פולשנית זמינות עבור אבחון מוקדם ואפיון של סרטן הערמונית 73,74, תוך שימת דגש על הצורך הדחוף טכניקות הדמית מטבולית רומן מאפשר זיהוי מחמירים ובימוי של חולים. קרצינומה הערמונית שימש כמודל כדי להדגים את האפשרויות של DNP פירוק בשילוב עם 13 CMRSI בחולהזה 57. עבודה זו נמשכה ניסוי קליני ראשון העסקה [1- 13 C] pyruvate ו -13 CMRSI עבור ההדמיה של סרטן הערמונית, והוא רק לאחרונה הושלם (NCT01229618).
המניע מאחורי המחקר הנוכחי היה להמחיש באופן מפורט יותר עבור קהל רחב יותר ביישום של 13 שיטת CMRSI באווירה פרה-קלינית עם תאים. מדידת חילוף חומרי LDH-זרז של [1- 13 C] פירובט כדי [1- 13 C] לקטט במבחנת הקו הסלולרי קרצינומה PC3 הערמונית, אנחנו מדגימים את היישום האפשרי של DNP פירוק במבחנה ב ולטפל בצעדים מכריעים אתגרים במהלך הניסויים.
Protocol
Representative Results
Discussion
13 CMRSI עם בדיקות hyperpolarized היא שיטה מבטיחה לפקח חילוף החומרים בזמן אמת במבחנה in vivo. היבט אחד חשוב מאוד כאשר המעסיקים תהליך הניסוי הזה הוא סטנדרטיזציה ראויה, במיוחד לגבי בניסויים במבחנה. ראשית, הכנת המדגם צריך להיעשות כראוי בעקביות להשגת ריכוז זהה של ?…
Disclosures
The authors have nothing to disclose.
Acknowledgements
E.K. gratefully acknowledges the support of the Graduate School of Bioengineering (GSB) at Technische Universität München. This work was supported by the German Research Foundation (DFG) within the SFB Collaborative Research Center 824, “Imaging for Selection, Monitoring, and Individualization of Cancer Therapies.”
Materials
| HyperSense DNP Polariser | Oxford Instruments | 3.35 T preclinical DNP hyperpolarizer | |
| GE/Agilent MR901 | GE Healthcare/Agilent Technologies | 7 T preclinical MRI scanner, with small bore designed for experiments onrodent | |
| Spinsolve Carbon | Magritek | 1 T NMR spectrometer with permanent magnet | |
| Deuterium Oxide | Sigma Aldrich | 7789-20-0 | |
| Sodium phosphate dibasic | Sigma Aldrich | 7558-79-4 | |
| Sodium phosphate monbasic | Sigma Aldrich | 7558-80-7 | |
| Sodium hydroxide | Sigma Aldrich | 1310-73-2 | |
| Disodium edetate | Sigma Aldrich | 6381-92-6 | |
| Pyruvic acid – 13C1 | Cambridge Isotopes Laboratories | CLM-8077-1 | |
| Dotarem (0.5 mmol/L) | Guerbet | gadoterate meglumine | |
| tris (8-carboxy-2,2,6,6-tetra-(hydroxyethyl)-benzo-[1,2–4,5]-bis-(1,3)-dithiole-4-yl)-methyl sodium salt (OX063) | GE Healthcare | trityl radical used as a sourse of free electron | |
| PC3 cell line | ATCC | CRL1435 | |
| F-12K medium | ATCC | 30-2004 | |
| Fetal Bovine Serum | ATCC | SCRR-30-2020 | |
| Trypsine-EDTA Solution, 1X | ATCC | 30-2101 | |
| Sample plastic cup | Oxford Instruments | ||
| Trypan blue | Bio-Rad | 145-0013-MSDS |
References
- Rohren, E. M., Turkington, T. G., Coleman, R. E. Clinical applications of PET in oncology. Radiology. 231 (2), 305-332 (2004).
- Overhauser, A. W. Polarization of Nuclei in Metals. Phys. Rev. 92 (2), 411-415 (1953).
- Carver, T. R., Slichter, C. P. Polarization of Nuclear Spins in Metals. Phys. Rev. 92 (1), 212-213 (1953).
- Abragam, A., Proctor, W. G. Spin Temperature. Phys. Rev. 109 (5), 1441-1458 (1958).
- Abragam, a., Goldman, M. Principles of dynamic nuclear polarisation. Reports Prog. Phys. 41 (3), 395-467 (2001).
- Ardenkjaer-Larsen, J. H., Fridlund, B., et al. Increase in signal-to-noise ratio of > 10,000 times in liquid-state NMR. Proc. Natl. Acad. Sci. U. S. A. 100 (18), 10158-10163 (2003).
- Shimon, D., Hovav, Y., Feintuch, A., Goldfarb, D., Vega, S. Dynamic nuclear polarization in the solid state: a transition between the cross effect and the solid effect. Phys. Chem. Chem. Phys. 14 (16), 5729-5743 (2012).
- Serra, S. C., Rosso, A., Tedoldi, F. Electron and nuclear spin dynamics in the thermal mixing model of dynamic nuclear polarization. Phys. Chem. Chem. Phys. 14 (38), 13299-13308 (2012).
- Gallagher, F. A., Kettunen, M. I., Brindle, K. M. Biomedical applications of hyperpolarized 13C magnetic resonance imaging. Prog. Nucl. Magn. Reson. Spectrosc. 55 (4), 285-295 (2009).
- Hurd, R. E., Yen, Y. -. F., Chen, A., Ardenkjaer-Larsen, J. H. Hyperpolarized 13C metabolic imaging using dissolution dynamic nuclear polarization. J. Magn. Reson. Imaging. 36 (6), 1314-1328 (2012).
- Ardenkjaer-Larsen, J. H., Fridlund, B., et al. Increase in signal-to-noise ratio of > 10,000 times in liquid-state NMR. Proc. Natl. Acad. Sci. U. S. A. 100 (18), 10158-10163 (2003).
- Golman, K., in’t Zandt, R., Thaning, M. Real-time metabolic imaging. Proc. Natl. Acad. Sci. 103 (30), 11270-11275 (2006).
- Comment, A., Rentsch, J., et al. Producing over 100 ml of highly concentrated hyperpolarized solution by means of dissolution DNP. J. Magn. Reson. 194 (1), 152-155 (2008).
- Brindle, K. M., Bohndiek, S. E., Gallagher, F. A., Kettunen, M. I. Tumor imaging using hyperpolarized 13C magnetic resonance spectroscopy. Magn. Reson. Med. 66 (2), 505-519 (2011).
- Gallagher, F. A., Kettunen, M. I., Day, S. E., Lerche, M., Brindle, K. M. 13C MR spectroscopy measurements of glutaminase activity in human hepatocellular carcinoma cells using hyperpolarized 13C-labeled glutamine. Magn. Reson. Med. 60 (2), 253-257 (2008).
- Chen, A. P., Albers, M. J., et al. Hyperpolarized C-13 spectroscopic imaging of the TRAMP mouse at 3T-initial experience. Magn. Reson. Med. 58 (6), 1099-1106 (2007).
- Day, S. E., Kettunen, M. I., et al. Detecting tumor response to treatment using hyperpolarized 13C magnetic resonance imaging and spectroscopy. Nat. Med. 13 (11), 1382-1387 (2007).
- Schroeder, M. A., Swietach, P., et al. Measuring intracellular pH in the heart using hyperpolarized carbon dioxide and bicarbonate: a 13C and 31P magnetic resonance spectroscopy study. Cardiovasc. Res. 86 (1), 82-91 (2010).
- Hurd, R. E., Yen, Y. -. F., Tropp, J., Pfefferbaum, A., Spielman, D. M., Mayer, D. Cerebral dynamics and metabolism of hyperpolarized [1-(13)C]pyruvate using time-resolved MR spectroscopic imaging. J. Cereb. Blood Flow Metab. 30 (13), 1734-1741 (2010).
- Golman, K., Zandt, R. I., Lerche, M., Pehrson, R., Ardenkjaer-Larsen, J. H. Metabolic imaging by hyperpolarized 13C magnetic resonance imaging for in vivo tumor diagnosis. Cancer Res. 66 (22), 10855-10860 (2006).
- Park, I., Larson, P. E. Z., et al. Hyperpolarized 13C magnetic resonance metabolic imaging: application to brain tumors. Neuro. Oncol. 12 (2), 133-144 (2010).
- Albers, M. J., Bok, R., et al. Hyperpolarized 13C lactate, pyruvate, and alanine: noninvasive biomarkers for prostate cancer detection and grading. Cancer Res. 68 (20), 8607-8615 (2008).
- Yen, Y. -. F., Le Roux, P., et al. T(2) relaxation times of (13)C metabolites in a rat hepatocellular carcinoma model measured in vivo using (13)C-MRS of hyperpolarized [1-(13)C]pyruvate. NMR Biomed. 23 (4), 414-423 (2010).
- Dafni, H., Larson, P. E. Z., et al. Hyperpolarized 13C spectroscopic imaging informs on hypoxia-inducible factor-1 and myc activity downstream of platelet-derived growth factor receptor. Cancer Res. 70 (19), 7400-7410 (2010).
- Ward, C. S., Venkatesh, H. S., et al. Noninvasive detection of target modulation following phosphatidylinositol 3-kinase inhibition using hyperpolarized 13C magnetic resonance spectroscopy. Cancer Res. 70 (4), 1296-1305 (2010).
- Day, S. E., Kettunen, M. I., et al. Detecting response of rat C6 glioma tumors to radiotherapy using hyperpolarized [1- 13C]pyruvate and 13C magnetic resonance spectroscopic imaging. Magn. Reson. Med. 65 (2), 557-563 (2011).
- Johannesson, H., Macholl, S., Ardenkjaer-Larsen, J. H. Dynamic Nuclear Polarization of [1-13C]pyruvic acid at 4.6 tesla. J. Magn. Reson. 197 (2), 167-175 (2009).
- Durst, M., Koellisch, U., et al. Bolus tracking for improved metabolic imaging of hyperpolarised compounds. J. Magn. Reson. 243, 40-46 (2014).
- Khegai, O., Schulte, R. F., et al. Apparent rate constant mapping using hyperpolarized [1-(13)C]pyruvate. NMR Biomed. 27 (10), 1256-1265 (2014).
- Sogaard, L. V., Schilling, F., Janich, M. A., Menzel, M. I., Ardenkjaer-Larsen, J. H. In vivo measurement of apparent diffusion coefficients of hyperpolarized (1)(3)C-labeled metabolites. NMR Biomed. 27 (5), 561-569 (2014).
- Aquaro, G. D., Frijia, F., et al. 3D CMR mapping of metabolism by hyperpolarized 13C-pyruvate in ischemia-reperfusion. JACC. Cardiovasc. Imaging. 6 (6), 743-744 (2013).
- Menzel, M. I., Farrell, E. V., et al. Multimodal assessment of in vivo metabolism with hyperpolarized [1-13C]MR spectroscopy and 18F-FDG PET imaging in hepatocellular carcinoma tumor-bearing rats. J. Nucl. Med. 54 (7), 1113-1119 (2013).
- Schilling, F., Duwel, S., et al. Diffusion of hyperpolarized (13) C-metabolites in tumor cell spheroids using real-time NMR spectroscopy. NMR Biomed. 26 (5), 557-568 (2013).
- Schulte, R. F., Sperl, J. I., et al. Saturation-recovery metabolic-exchange rate imaging with hyperpolarized [1-13C] pyruvate using spectral-spatial excitation. Magn. Reson. Med. 69 (5), 1209-1216 (2013).
- Wiesinger, F., Weidl, E., et al. IDEAL spiral CSI for dynamic metabolic MR imaging of hyperpolarized [1-13C]pyruvate. Magn. Reson. Med. 68 (1), 8-16 (2012).
- Wilson, D. M., Keshari, K. R., et al. Multi-compound polarization by DNP allows simultaneous assessment of multiple enzymatic activities in vivo. J. Magn. Reson. 205 (1), 141-147 (2010).
- Schroeder, M. A., Atherton, H. J., et al. Real-time assessment of Krebs cycle metabolism using hyperpolarized 13C magnetic resonance spectroscopy. FASEB J. Off. Publ. Fed. Am. Soc. Exp. Biol. 23 (8), 2529-2538 (2009).
- Hurd, R. E., Yen, Y. -. F., et al. Metabolic imaging in the anesthetized rat brain using hyperpolarized [1-13C] pyruvate and [1-13C] ethyl pyruvate. Magn. Reson. Med. 63 (5), 1137-1143 (2010).
- Chen, A. P., Kurhanewicz, J., et al. Feasibility of using hyperpolarized [1-13C]lactate as a substrate for in vivo metabolic 13C MRSI studies. Magn. Reson. Imaging. 26 (6), 721-726 (2008).
- Witney, T. H., Kettunen, M. I., et al. Detecting treatment response in a model of human breast adenocarcinoma using hyperpolarised [1-(13)C]pyruvate and. Br. J. Cancer. 103 (9), 1400-1406 (2010).
- Bohndiek, S. E., Kettunen, M. I., et al. Detecting tumor response to a vascular disrupting agent using hyperpolarized (13)C magnetic resonance spectroscopy. Mol. Cancer Ther. 9 (12), 3278-3288 (2010).
- Gallagher, F. A., Kettunen, M. I., et al. Production of hyperpolarized [1,4-13C2]malate from [1,4-13C2]fumarate is a marker of cell necrosis and treatment response in tumors. Proc. Natl. Acad. Sci. U. S. A. 106 (47), 19801-19806 (2009).
- Jensen, P. R., Peitersen, T., et al. Tissue-specific short chain fatty acid metabolism and slow metabolic recovery after ischemia from hyperpolarized NMR in vivo. J. Biol. Chem. 284 (52), 36077-36082 (2009).
- Gallagher, F. A., Kettunen, M. I., et al. Magnetic resonance imaging of pH in vivo using hyperpolarized 13C-labelled bicarbonate. Nature. 453 (7197), 940-943 (2008).
- Scholz, D. J., Janich, M. A., et al. Quantified pH imaging with hyperpolarized 13C-bicarbonate. Magn. Reson. Med. 73 (6), 2274-2282 (2015).
- Koellisch, U., Gringeri, C. V., et al. Metabolic imaging of hyperpolarized [1-(13) C]acetate and [1-(13) C]acetylcarnitine – investigation of the influence of dobutamine induced stress. Magn. Reson. Med. 74 (4), 1011-1018 (2015).
- Koellisch, U., Laustsen, C., et al. Investigation of metabolic changes in STZ-induced diabetic rats with hyperpolarized [1-13C]acetate. Physiol. Rep. 3 (8), (2015).
- Jensen, P. R., Meier, S., Ardenkjaer-Larsen, J. H., Duus, J. O., Karlsson, M., Lerche, M. H. Detection of low-populated reaction intermediates with hyperpolarized NMR. Chem. Commun. (34), 5168-5170 (2009).
- Koelsch, B. L., Keshari, K. R., Peeters, T. H., Larson, P. E. Z., Wilson, D. M., Kurhanewicz, J. Diffusion MR of hyperpolarized 13C molecules in solution. Analyst. 138 (4), 1011-1014 (2013).
- Golman, K., Ardenkjaer-Larsen, J. H., Petersson, J. S., Mansson, S., Leunbach, I. Molecular imaging with endogenous substances. Proc. Natl. Acad. Sci. U. S. A. 100 (18), 10435-10439 (2003).
- von Morze, C., Larson, P. E. Z., et al. Imaging of Blood Flow Using Hyperpolarized [(13)C]Urea in Preclinical Cancer Models. J. Magn. Reson. Imaging. 33 (3), 692-697 (2011).
- Chiavazza, E., Kubala, E., et al. Earth’s magnetic field enabled scalar coupling relaxation of 13C nuclei bound to fast-relaxing quadrupolar 14N in amide groups. J. Magn. Reson. 227, 35-38 (2013).
- Jensen, P. R., Karlsson, M., Meier, S., Duus, J., Lerche, M. H. Hyperpolarized amino acids for in vivo assays of transaminase activity. Chem. – A Eur. J. 15 (39), 10010-10012 (2009).
- Gallagher, F. A., Kettunen, M. I., et al. Detection of tumor glutamate metabolism in vivo using 13C magnetic resonance spectroscopy and hyperpolarized [1-13C]glutamate. Magn. Reson. Med. 66 (1), 18-23 (2011).
- Chaumeil, M. M., Larson, P. E. Z., et al. Hyperpolarized [1-13C] glutamate: a metabolic imaging biomarker of IDH1 mutational status in glioma. Cancer Res. 74 (16), 4247-4257 (2014).
- Keshari, K. R., Wilson, D. M. Chemistry and biochemistry of 13C hyperpolarized magnetic resonance using dynamic nuclear polarization. Chem. Soc. Rev. 43 (5), 1627-1659 (2014).
- Nelson, S. J., Kurhanewicz, J., et al. Metabolic Imaging of Patients with Prostate Cancer Using Hyperpolarized [1-13C]Pyruvate. Sci. Transl. Med. 5 (198), (2013).
- Warburg, O. On the origin of cancer cells. Science. 123 (3191), 309-314 (1956).
- Warburg, O., Wind, F., Negelein, E. {Ü}ber den Stoffwechsel von Tumoren im K{ö}rper. Klin. Wochenschr. 5 (19), 829-832 (1926).
- Barnes, A. B., De Paepe, G., et al. High-Field Dynamic Nuclear Polarization for Solid and Solution. Biological NMR. Appl. Magn. Reson. 34 (3-4), 237-263 (2008).
- Koukourakis, M. I., Giatromanolaki, A., Sivridis, E., Gatter, K. C., Harris, A. L. Pyruvate dehydrogenase and pyruvate dehydrogenase kinase expression in non small cell lung cancer and tumor-associated stroma. Neoplasia. 7 (1), 1-6 (2005).
- Golman, K., Petersson, J. S. Metabolic Imaging and Other Applications of Hyperpolarized 13C1. Acad. Radiol. 13 (8), 932-942 (2016).
- Golman, K., Petersson, J. S., et al. Cardiac metabolism measured noninvasively by hyperpolarized 13C MRI. Magn. Reson. Med. 59 (5), 1005-1013 (2008).
- Merritt, M. E., Harrison, C., Storey, C., Jeffrey, F. M., Sherry, A. D., Malloy, C. R. Hyperpolarized 13C allows a direct measure of flux through a single enzyme-catalyzed step by NMR. Proc. Natl. Acad. Sci. U. S. A. 104 (50), 19773-19777 (2007).
- Merritt, M. E., Harrison, C., Storey, C., Sherry, A. D., Malloy, C. R. Inhibition of carbohydrate oxidation during the first minute of reperfusion after brief ischemia NMR detection of hyperpolarized 13CO2 and H13CO3-. Magn. Reson. Med. 60 (5), 1029-1036 (2008).
- Hu, S., Chen, A. P., et al. In vivo carbon-13 dynamic MRS and MRSI of normal and fasted rat liver with hyperpolarized 13C-pyruvate. Mol. imaging Biol. MIB Off. Publ. Acad. Mol. Imaging. 11 (6), 399-407 (2009).
- Kohler, S. J., Yen, Y., et al. In vivo 13 carbon metabolic imaging at 3T with hyperpolarized 13C-1-pyruvate. Magn. Reson. Med. 58 (1), 65-69 (2007).
- Hu, S., Lustig, M., et al. 3D compressed sensing for highly accelerated hyperpolarized (13)C MRSI with in vivo applications to transgenic mouse models of cancer. Magn. Reson. Med. 63 (2), 312-321 (2010).
- Kurhanewicz, J., Vigneron, D. B., et al. Analysis of cancer metabolism by imaging hyperpolarized nuclei: prospects for translation to clinical research. Neoplasia. 13 (2), 81-97 (2011).
- Schroeder, M. A., Cochlin, L. E., Heather, L. C., Clarke, K., Radda, G. K., Tyler, D. J. In vivo assessment of pyruvate dehydrogenase flux in the heart using hyperpolarized carbon-13 magnetic resonance. Proc. Natl. Acad. Sci. U. S. A. 105 (33), 12051-12056 (2008).
- Zierhut, M. L., Yen, Y. -. F., et al. Kinetic modeling of hyperpolarized 13C1-pyruvate metabolism in normal rats and TRAMP mice. J. Magn. Reson. 202 (1), 85-92 (2010).
- Dennis, L. K., Resnick, M. I. Analysis of recent trends in prostate cancer incidence and mortality. Prostate. 42 (4), 247-252 (2000).
- Jambor, I., Borra, R., et al. Functional imaging of localized prostate cancer aggressiveness using 11C-acetate PET/CT and 1H-MR spectroscopy. J. Nucl. Med. 51 (11), 1676-1683 (2010).
- Presti, J. C. J., Hricak, H., Narayan, P. A., Shinohara, K., White, S., Carroll, P. R. Local staging of prostatic carcinoma: comparison of transrectal sonography and endorectal MR imaging. AJR. Am. J. Roentgenol. 166 (1), 103-108 (1996).
- Schulte, R. F., Sacolick, L., et al. Transmit gain calibration for nonproton MR using the Bloch-Siegert shift. NMR Biomed. 24 (9), 1068-1072 (2011).
- Durst, M., Koellisch, U., et al. Comparison of acquisition schemes for hyperpolarised (1)(3)C imaging. NMR Biomed. 28 (6), 715-725 (2015).
- Janich, M. A., Menzel, M. I., et al. Effects of pyruvate dose on in vivo metabolism and quantification of hyperpolarized (1)(3)C spectra. NMR Biomed. 25 (1), 142-151 (2012).
- Harrison, C., Yang, C., et al. Comparison of kinetic models for analysis of pyruvate-to-lactate exchange by hyperpolarized 13 C NMR. NMR Biomed. 25 (11), 1286-1294 (2012).
- Gómez Damián, P. A., Sperl, J. I., et al. Multisite Kinetic Modeling of (13)C Metabolic MR Using [1-(13)C]Pyruvate. Radiol. Res. Pract. 2014, (2014).
- Talbot, J. -. N., Gutman, F., et al. PET/CT in patients with hepatocellular carcinoma using [(18)F]fluorocholine: preliminary comparison with [(18)F]FDG PET/CT. Eur. J. Nucl. Med. Mol. Imaging. 33 (11), 1285-1289 (2006).
- Reeder, S. B., Pineda, A. R., et al. Iterative decomposition of water and fat with echo asymmetry and least-squares estimation (IDEAL): application with fast spin-echo imaging. Magn. Reson. Med. 54 (3), 636-644 (2005).
- Laustsen, C., Ostergaard, J. A., et al. Assessment of early diabetic renal changes with hyperpolarized [1-(13) C]pyruvate. Diabetes. Metab. Res. Rev. 29 (2), 125-129 (2013).
- Serrao, E. M., Brindle, K. M. Potential Clinical Roles for Metabolic Imaging with Hyperpolarized [1-(13)C]Pyruvate. Front. Oncol. 6, 59 (2016).

