Real-time iontophorese met tetramethylammonium om volume-fractie en tortuositeit van de extracellulaire ruimte van de hersenen te kwantificeren
Summary
Dit protocol beschrijft real-time iontoforese, een methode die fysieke parameters meet van de extracellulaire ruimte (ECS) van de levende hersenen. De diffusie van een inert molecuul dat in de ECS wordt vrijgegeven, wordt gebruikt om de ECS volume fractie en tortuositeit te berekenen. Het is ideaal voor het bestuderen van acute omkeerbare veranderingen in hersen ECS.
Abstract
Deze review beschrijft de basisconcepten en het protocol om de real-time iontoforese (RTI) methode uit te voeren, de gouden standaard om de extracellulaire ruimte (ECS) van de levende hersenen te onderzoeken en te kwantificeren. De ECS omgeeft alle hersencellen en bevat zowel interstitiële vloeistof als extracellulaire matrix. Het transport van veel stoffen die nodig zijn voor hersenactiviteit, inclusief neurotransmitters, hormonen en voedingsstoffen, komt door diffusie door de ECS voor. Veranderingen in het volume en de geometrie van deze ruimte komen voor bij normale hersenprocessen, zoals slaap en pathologische aandoeningen, zoals ischemie. De structuur en de regulering van hersen ECS, vooral in zieke staten, blijft echter grotendeels onontgonnen. De RTI methode meet twee fysieke parameters van het levende brein: volume fractie en tortuositeit. Volume-fractie is het aandeel van het weefselvolume dat door ECS wordt bezet. Tortuosity is een maat voor de relatieve hinder die een stof tegenkomt wanneer het diffundeert door een hersenreactieGion in vergelijking met een medium zonder obstakels. In RTI wordt een inerte molecuul gepulst van een bron microelektrode in de hersenen ECS. Aangezien moleculen van deze bron diffunderen, wordt de veranderende concentratie van het ionen mettertijd gemeten met behulp van een ionen-selectieve micro-elektrode die ongeveer 100 μm is gepositioneerd. Uit de resulterende diffusiecurve kan zowel volumefractie als tortuositeit worden berekend. Deze techniek is gebruikt in hersenschijfjes van meerdere soorten (inclusief mensen) en in vivo om acute en chronische veranderingen in ECS te bestuderen. In tegenstelling tot andere methoden kan RTI zowel in realtime als omkeerbare en onomkeerbare veranderingen in de hersenen ECS worden bekeken.
Introduction
De extracellulaire ruimte (ECS) is het netwerk van door elkaar verbonden kanalen buiten alle hersencellen en bevat zowel interstitiële vloeistof als extracellulaire matrix ( Figuur 1a en Figuur 1b ). De verspreiding van veel stoffen die nodig zijn voor de hersencelfunctie, met inbegrip van voedingsstoffen, hormonen en neurotransmitters, komt door diffusie door de ECS voor. Veranderingen in de fysieke parameters van deze ruimte, met inbegrip van volume, geometrie en extracellulaire matrix, kunnen de diffusie drastisch beïnvloeden door de ECS en de lokale ionconcentraties baden van de hersenen, die een belangrijke invloed hebben op de celfunctie van de hersenencel 1 , 2 .
Real-time iontoforese (RTI) wordt gebruikt om twee structurele kenmerken van een hersengebied te bepalen: volume fractie en tortuositeit 3 , 4 ,"Xref"> 5. Volumefractie ( a ) is het aandeel van weefselvolume dat door de ECS ( V ECS ) wordt bezet ten opzichte van het totale weefselvolume ( V weefsel ) in een representatief elementair volume;
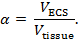
Tortuosity ( λ ) is de relatieve belemmering die een stof tegenkomt wanneer het diffundeert door een hersengebied in vergelijking met een medium zonder obstructies;
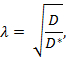
Waar D * (cm 2 s -1 ) de effectieve diffusiecoëfficiënt van de stof in de hersenen en D (cm 2 s -1 ) is, is de vrije diffusiecoëfficiënt van de stof in een vrij medium, zoals verdunde agarosegel.
Vandaag de meest gebruikte sonde stof voor de RTI methode is het kleine kationtetramethylammonium (TMA). TMA heeft een molecuulgewicht van 74 g / mol, dissocieert volledig in oplossing en heeft één positieve lading. RTI studies met dit ion hebben aangetoond dat α 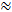 0,2 en λ
0,2 en λ 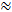 1,6 1 , 2 . Dit betekent dat de ECS ongeveer 20% van het totale hersenvolume bedraagt en dat de diffusie van een klein inert molecuul ongeveer 2,5 keer langzamer voorkomt in de ECS dan in een medium zonder obstakels 3 . Beide α en λ variëren echter met de leeftijd van de hersenen, regio en staat en in pathologische omstandigheden 1 . Wijzigingen van deze parameters zijn gekoppeld aan de ontwikkeling van de hersenen, veroudering, slaap, epilepsie en vele andere fundamentele processen en hersenziekten 1, 6 . Terwijl andere technieken a en λ meeten, kan RTI zowel in gelokaliseerde gebieden van levend weefsel in realtime meten. Om deze reden is RTI een onontbeerlijk instrument geworden voor het onderzoeken van veranderingen in a en λ tijdens acute en omkeerbare uitdagingen.
1,6 1 , 2 . Dit betekent dat de ECS ongeveer 20% van het totale hersenvolume bedraagt en dat de diffusie van een klein inert molecuul ongeveer 2,5 keer langzamer voorkomt in de ECS dan in een medium zonder obstakels 3 . Beide α en λ variëren echter met de leeftijd van de hersenen, regio en staat en in pathologische omstandigheden 1 . Wijzigingen van deze parameters zijn gekoppeld aan de ontwikkeling van de hersenen, veroudering, slaap, epilepsie en vele andere fundamentele processen en hersenziekten 1, 6 . Terwijl andere technieken a en λ meeten, kan RTI zowel in gelokaliseerde gebieden van levend weefsel in realtime meten. Om deze reden is RTI een onontbeerlijk instrument geworden voor het onderzoeken van veranderingen in a en λ tijdens acute en omkeerbare uitdagingen.
De theorie ter ondersteuning van RTI werd oorspronkelijk gevalideerd door Nicholson en Phillips, en de techniek is sinds die tijd zeer uitgebreid gebruikt 4 , 7 . Experimenten die RTI gebruiken, beginnen met het vrijkomen van een puls van TMA van een bron-micro-elektrode door iontoforese in een verdunde agarosegel. Eens uitgeworpen diffundeerden de ionen vrij van de puntbron, waarbij ze kiezen uit een potentieel oneindig aantal willekeurige wegen ( Figuur 1d ). De veranderende concentratie van het ionen wordt mettertijd gemeten met behulp van een ionen-selectieve micro-elektrode (ISM) die ruwweg is gepositioneerd100 μm weg ( figuur 1c ). De veranderingen in TMA-concentratie worden getekend en op een curve aangebracht die de berekening van zowel D als het transportnummer van de iontoforese micro-elektrode mogelijk maakt (parameters beschreven in het protocol). Met deze waarden wordt de procedure herhaald in een hersengebied van belang om D * te verkrijgen en zowel α als λ te berekenen. Beheersing van de iontoforese micro-elektrode, dataverzameling, grafieken en montage van de TMA-concentratiecurve en berekening van de experimentele parameters worden doorgaans uitgevoerd door de programma's Wanda en Walter, die speciaal hiervoor zijn ontworpen (de software en hun handleidingen zijn Vrij verkrijgbaar bij de auteurs op aanvraag).
Het protocol gedeelte van deze review beschrijft de basisprocedures die nodig zijn voor het ontwerpen en uitvoeren van RTI in knaagdierbreinzen. De techniek is ook gebruikt in niet-staafEnt modellen, waaronder menselijke hersenen plakjes en in vivo hersenpreparaten 1 , 4 , 6 , 8 , 9 . Het gedeelte Representatieve resultaten biedt zowel ideale als niet-ideale resultaten om nuances in data-interpretatie te markeren. Tenslotte behandelt de discussie sectie probleemoplossingstechnieken, beperkingen van RTI, alternatieve technieken die gebruikt worden om de ECS te bestuderen en toekomstige toepassingen van RTI.
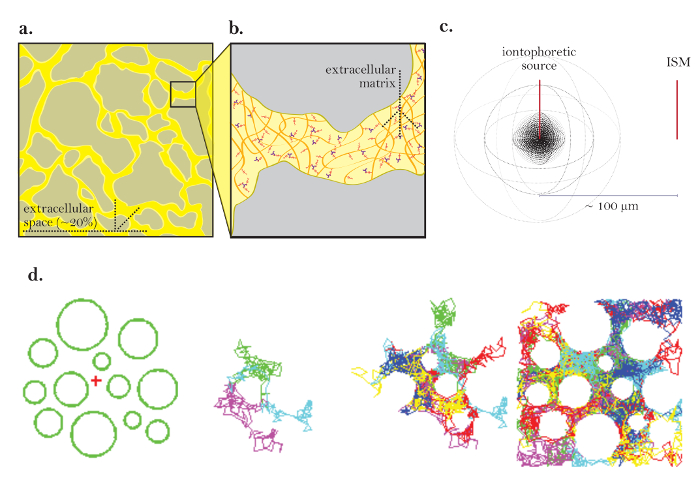
Figuur 1: Diagrammen van diffusie via ECS. (A) Schema van ECS: Toont de grootte en locatie van het ECS in een typische hersenpreparaat. Geel markeert de ECS tussen de grijze hersencel processen. Het volume van de ECS bedraagt ongeveer 20% van het totale weefsel volume ( dwz volume fractie = 0.2) onder fysiologische omstandigheden. ( B ) vergroot diagram van de ECS: benadrukt fysieke parameters die bijdragen aan tortuositeit, inclusief hersencel geometrie (grijs) en extracellulaire matrix (aangetoond als een netwerk van veelkleurige glycosaminoglycanen en proteoglycanen). ( C ) 3D-diagram van diffusie van een puntbron: Demonstreert de netto beweging van inerte moleculen van een iontoforetische bron naar een ISM. Met uitzondering van diffusiebarrières en cellulaire opname diffundeerden de moleculen in alle richtingen naar buiten, waardoor er een bolvormige concentratievoorzijde ontstaat. Het ISM kwantificeert de lokale concentratie van de inerte moleculen die vrijkomen van de iontoforetische bron. ( D ) Computer simulatie van diffusie in ECS van de hersenen: [Verre links] Instelling voor Monte Carlo simulatie; Groene bollen vertegenwoordigen hersencelprocessen en het rode kruis vertegenwoordigt een puntbron. Deze opstelling modelleren het hersenweefsel diagramma in figuur 1a . [Middenbeelden] 3 en6 moleculen die willekeurige bewegingen verrichten als ze diffunderen door de extracellulaire ruimte van de hersenen, weergegeven in 2 dimensies. [Verre rechts] Willekeurige wandelingen van veel moleculen die uit de puntbron worden vrijgegeven. De netto beweging van alle moleculen uit de puntbron is naar buiten, zoals afgebeeld in figuur 1c . De cumulatieve willekeurige wandelingen schetsen de ruimten tussen de cellen ( dwz de ECS, zie referentie 5 voor verdere uitleg). Klik hier om een grotere versie van deze figuur te bekijken.
Protocol
Representative Results
Discussion
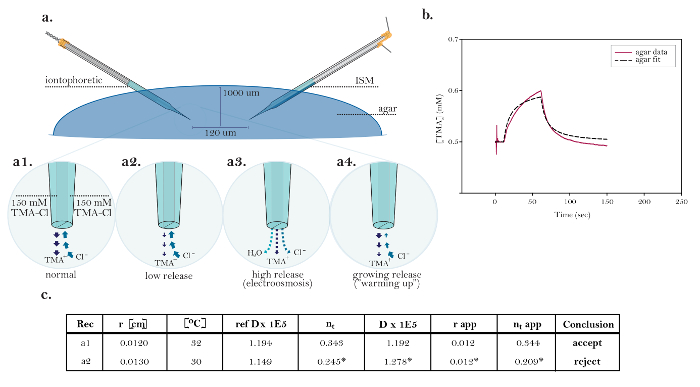
Figuur 10: Niet-ideale gegevens die gemeenschappelijke technische problemen tonen. (A) Schema van gemeenschappelijke technische problemen met iontoforese micro-elektroden: Vergelijking van de normale release van TMA uit een functionerende iontoforese micro-elektrode met drie bronnen demonstreren technische problemen. [Hoge vergroting, a1] De stroom in een ideale iontoforetische bron wordt gelijk ve…
Disclosures
The authors have nothing to disclose.
Acknowledgements
Het werk werd ondersteund door NIH NINDS subsidie R01 NS047557.
Materials
| A/D and D/A converter | National Instruments Corporation | NI USB-6221 DAQ | The NI USB-6221 is still sold as a 'Legacy' device by NI. They recommend using NI USB-6341 X Series DAQs for new installations, however we have not tested the newer units. We describe the use of the NI USB-6221 with MATLAB and Windows 7 (32-bit). Alternatives: the much older PCI-MIO-16E-4 A/D converter (Used under Windows XP or older OS only) with BNC-2090 BNC connector panel and SH68-68-EP cable. As noted in the Wanda Manual, an experimental MATLAB program to use Axon Binary Files is available. |
| agarose | Lonza | NuSieve GTG Agarose #50081 | to prepare dilute agarose gel for RTI measurements |
| amplifier for ISM | Dagan | Model IX2-700 Dual Intracellular Preamplifier | ion and reference voltage amplifier with N=0.1 (for reference barrel) and N=0.001 (for ion barrel) headstages |
| biological compound miscroscope (with 4x and 10x objective) | for chipping the microelectrode tips and inspecting microelectrodes; various suppliers, e.g. AmScope | ||
| borosilicate theta capillary glass tubing | Harvard Apparatus | Warner Instruments model TG200-4; order #64-0811 | double-barreled glass tubing for ion-selective microelectrodes and iontophoretic microelectrodes; O.D. 2.0 mm, I.D. 1.4 mm, septum 0.2 mm, length 10 cm |
| brush | Winsor & Newton | University Series 233, size 0 | round shoft handle brush, available from Amazon |
| bunsen burner | Fisher | ||
| camera for visualizing micropipettes | Olympus | OLY-150 | requires monitor, IR filter on substage illuminator is optional |
| chart recorder | to record continuously voltages on ion-selective microelectrode during calibration in tetramethylammonium standards and during RTI experiment; e.g. Kipp & Zonen type BD112 dual-cannel chart recorded, available refurbished | ||
| chlorotrimethylsilane, puriss., > 99% | Sigma-Aldrich | catalog # 92360 | for silanization; CAUTION: flammable, acute toxicity (oral, dermal, inhalation), skin corrosion, eye damage, reacts violently with water, see Sigma-Aldrich Safety Information for full description |
| Commercial Software | The MathWorks | MATLAB, Data acquisition toolbox | for data acquisition and analysis using Wanda and Walter programs. Note that an academic license is available. |
| eye protective goggles | Fisher | ||
| fixed-stage compound microscope | Olympus | BX51WI | can use other compound microscopes with fixed stages |
| forceps | Fine Science Tools | #11251-10 | to chip glass capillary; Dumond #5, preferably used and no longer needed for fine work |
| fume hood | for silanization and filling the tip of ion-selective barrel with liquid ion exchanger; various supliers, e.g. Captair with approriate filter sold by Erlab | ||
| glass microscope slide | Fisher | #12-550A | to chip microelectrode tips |
| heater/stirrer | Fisher | Corning PC-420D | to prepare dilute agarose gel and stir solutions |
| iontophoretic unit | Dagan | ION-100 and PS-100 | ION-100 is a single channel iontophoresis unit +/- 130 V compliance; PS-100 is an external power supply; alternatives: e.g. Axoprobe-1A made by Axon Instruments (now Molecular Devices), out of production, check for availability of refurbished units (eBay and other sites) |
| liquid ion exchanger (LIX) for tetramethylammonium | World Precision Instruments | IE190 Potassium Ion Exchanger | Note: this is equivalent to the original Corning potassium exchanger 477317 based on tetraphenlyborate – do not confuse with neutral carrier potassium exchanger originating from the laboartory of Dr. Simon, ETH, Zurich, which does not sense tetramethylammonium, and is sold by Fluka. You can also make liquid ion exchanger for tetramethylammonium yourself: 3% by weight potassium tetrakis = (p-chlorophenyl) borate dissolved in 2,3-dimethylnitrobenzene. Buy chemicals from Fluka (now part of Sigma). See Oehme and Simon (1976) Anal. Chim. Acta 86: 21-25; CAUTION: The toxicological properties of this liquid ion exchanger have not been fully determined. Ingestion or contact with the human body may be harmful. Exercise due care! Liquid ion exchangers should be stored in a cool place out of direct sunlight. |
| microelectrode holder | WPI | M3301EH | to hold ion-selective microeletrode prefabricate for silanization and filling the tip of ion-selective barrel with liquid ion exchanger; WPI sells two versions of this holder, clear M3301EH and black M3301EH. In our experience, the clear M3301EH appears to be sturdier then the black M3301EH. |
| micromanipulator | Narishige | MM-3 | to position ion-selective microelectrode prefabricate during silanization and filling the tip of ion-selective barrel with liquid ion exchanger; can be substituted with any three-axis micromanipulator in good working condition |
| micropipette puller | Sutter Instruments | Model P-97 | to pull double-barreled glass tubing; other pullers can be used as long as they can accommodate large diameter double-barreled glass tubing |
| microprobe thermometer | Physiotemp | Model BAT-12R | fine probe of this thermometer is placed close to recording site |
| needle | BD | Syringes and Needles # 305122 (25 gauge) | for silanization; BD PrecisionGlide needles 25 G x 5/8 in (0.5mm x 16mm) |
| objective 5x dry | Olympus | MPlan N | |
| objective 10x water immersion | Olympus | UMPlan FL N | 10x objective is water immersion, numerical aperture is 0.3, working distance is 3.3 mm |
| plastic containers (with lids) | Fisher | #14-375-148 | to store tetramethylammonium standard solutions and microelectrodes |
| platform and x-y translation stage for fixed-stage microscope | EXFO | Gibraltar Burleigh | platform holds slice chamber, micromanipulators and accesorries, x-y translational stage moves microscope without compromising recording stability |
| porous minicup | for RTI measurements in a dilute agarose gel; homemade | ||
| reusable adhesive | Bostik | Blu-Tack | for securing microelectrodes to holding vessel and other uses; various suppliers, available from Amazon |
| robotic micromanipulator with precise x,y,z positioning | Sutter Instruments | MP-285 | two mircomanipulators are needed to hold separately ion-selective microelectrode and iontophoretic microelectrode. Also possible to glue micropipettes in a spaced array (see text). |
| signal conditioning unit with low-pass filter | Axon Instruments | CyberAmp 320 or 380 | no longer available from the manufacturer but may be available from E-Bay; alternatives: e.g. FLA-01 Filter/Amplifier from Cygnus Technology. This is a single channel instrument with a minimum cutoff at 10 Hz using a multipole Bessel filter but the company may be willing to modify it for a lower cutoff frequency (2 Hz) if needed. |
| silver wire | A-M Systems | #7830 | diameter 0.015", bare (no coating) |
| slice chamber | Harvard Apparatus | Warner Model RC-27L | this is submersion slice chamber; do not use interface slice chamber |
| stereomicroscope | for silanization and filling the tip of ion-selective barrel with liquid ion exchanger; horizontally mounted; various suppliers | ||
| syringe, 10 mL | BD | Syringes and Needles #309604 | to backfill microelectrodes and for silanization; BD Luer-Lok tip |
| syringe filter 0.22µm pore | Whatman | #6780-1302 | to filter backfill solutions; available from Fisher |
| syringe needle, 28 gauge, 97mm | World Precision Instruments | MicroFil MF28G-5 | to backfill microelectrodes |
| Teflon (=PTFE) tubing | Component Supply | STT-28 PTFE tube light wall (28 gauge) | for silanization of ion-selective barrel; fits on BD PrecisionGlide needles 25 G x 5/8 in. Note: Teflon is essential, PVC tubing would melt by hot wax. |
| temperature control system | Harvard Apparatus | Warner Models TC-344B and SH-27A | TC-344B is a dual automatic temperature controller, SH-27A is an in-line heater; controller and heater work with Warner slice chambers |
| tetramethyammonium (TMA) chloride | Sigma-Aldrich | T-3411 | 5 M solution; CAUTION: acute toxicity (oral, dermal, inhalation), carcinogenicity, hazardous to the aquatic environment, see Sigma-Aldrich Safety Information for full description |
| vibrating blade microtome | Leica | VT1000S | to cut brain slices |
| xylenes | Fisher | X5-1 | for silanization; CAUTION: flammable, acute toxicity (oral, dermal, inhalation), skin corrosion, eye damage, carcinogenicity, see Fisher Safety Information for full description |
References
- Sykova, E., Nicholson, C. Diffusion in brain extracellular space. Physiol Rev. 88 (4), 1277-1340 (2008).
- Nicholson, C. Diffusion and related transport mechanisms in brain tissue. Rep Prog Phys. 64 (7), 815-884 (2001).
- Nicholson, C. Ion-selective microelectrodes and diffusion measurements as tools to explore the brain cell microenvironment. J Neurosci Methods. 48 (3), 199-213 (1993).
- Nicholson, C., Phillips, J. M. Ion diffusion modified by tortuosity and volume fraction in the extracellular microenvironment of the rat cerebellum. J Physiol. 321, 225-257 (1981).
- Nicholson, C., Sykova, E. Extracellular space structure revealed by diffusion analysis. Trends Neurosci. 21 (5), 207-215 (1998).
- Xie, L. L., et al. Sleep drives metabolite clearance from the adult brain. Science. 342 (6156), 373-377 (2013).
- Hrabetova, S., Nicholson, C., Michael, A. C., Borland, L. M. Biophysical properties of brain extracellular space explored with ion-selective microelectrodes, integrative optical imaging and related techniques. Electrochemical Methods for Neuroscience Neuroscience. , 167-204 (2007).
- Rice, M. E., Okada, Y. C., Nicholson, C. Anisotropic and heterogeneous diffusion in the turtle cerebellum: implications for volume transmission. J Neurophysiol. 70 (5), 2035-2044 (1993).
- Vargova, L., et al. Diffusion parameters of the extracellular space in human gliomas. Glia. 42 (1), 77-88 (2003).
- Haack, N., Durry, S., Kafitz, K. W., Chesler, M., Rose, C. Double-barreled and concentric microelectrodes for measurement of extracellular ion signals in brain tissue. J Vis Exp. (103), (2015).
- Xiao, F., Hrabetova, S. Enlarged extracellular space of aquaporin-4-deficient mice does not enhance diffusion of Alexa Fluor 488 or dextran polymers. Neuroscience. 161 (1), 39-45 (2009).
- Sherpa, A. D., Pvan de Nes, ., Xiao, F., Weedon, J., Hrabetova, S. Gliotoxin-induced swelling of astrocytes hinders diffusion in brain extracellular space via formation of dead-space microdomains. Glia. 62 (7), 1053-1065 (2014).
- Kume-Kick, J., et al. Independence of extracellular tortuosity and volume fraction during osmotic challenge in rat neocortex. J Physiol. 542 (Pt 2), 515-527 (2002).
- Saghyan, A., Lewis, D. P., Hrabe, J., Hrabetova, S. Extracellular diffusion in laminar brain structures exemplified by hippocampus. J Neurosci Methods. 205 (1), 110-118 (2012).
- Fedirko, N., Svichar, N., Chesler, M. Fabrication and use of high-speed, concentric H+- and Ca2+-selective microelectrodes suitable for in vitro extracellular recording. J Neurophys. 96 (2), 919-924 (2006).
- Nicholson, C. Diffusion from an injected volume of a substance in brain tissue with arbitrary volume fraction and tortuosity. Brain Res. 333 (2), 325-329 (1985).
- Nicholson, C., Tao, L. Hindered diffusion of high molecular weight compounds in brain extracellular microenvironment measured with integrative optical imaging. Biophys J. 65 (6), 2277-2290 (1993).
- Thorne, R. G., Nicholson, C. In vivo diffusion analysis with quantum dots and dextrans predicts the width of brain extracellular space. Proc Natl Acad Sci U S A. 103 (14), 5567-5572 (2006).
- Wolak, D. J., Thorne, R. G. Diffusion of macromolecules in the brain: implications for drug delivery. Mol Pharm. 10 (5), 1492-1504 (2013).

