Echtzeit-Iontophorese mit Tetramethylammonium zur Quantifizierung der Volumenfraktion und Tortuosität des Gehirns extrazellulären Raumes
Summary
Dieses Protokoll beschreibt Echtzeit-Iontophorese, eine Methode, die physikalische Parameter des extrazellulären Raumes (ECS) des lebenden Gehirns misst. Die Diffusion eines in das ECS freigesetzten Inertmoleküls wird zur Berechnung des ECS-Volumenanteils und der Tortuosität herangezogen. Es ist ideal für das Studium akuter reversibler Änderungen an Gehirn ECS.
Abstract
Diese Übersicht beschreibt die grundlegenden Konzepte und das Protokoll zur Durchführung der Echtzeit-Iontophorese (RTI) -Methode, die Gold-Standard, um den extrazellulären Raum (ECS) des lebenden Gehirns zu erforschen und zu quantifizieren. Die ECS umgibt alle Gehirnzellen und enthält sowohl interstitielle Flüssigkeit als auch extrazelluläre Matrix. Der Transport von vielen Substanzen, die für die Gehirnaktivität erforderlich sind, einschließlich Neurotransmitter, Hormone und Nährstoffe, erfolgt durch Diffusion durch die ECS. Änderungen des Volumens und der Geometrie dieses Raumes treten bei normalen Gehirnprozessen, wie Schlaf und pathologischen Zuständen, wie Ischämie, auf. Allerdings bleibt die Struktur und Regulierung des Gehirns ECS, vor allem in kranken Staaten, weitgehend unerforscht. Die RTI-Methode misst zwei physikalische Parameter des lebenden Gehirns: Volumenbruch und Tortuosität. Volumenanteil ist der Anteil des von ECS besetzten Gewebevolumens. Tortuosität ist ein Maß für die relative Hinderung, die eine Substanz beim Diffundieren durch ein Gehirn bekommtGion im Vergleich zu einem Medium ohne Hindernisse. In RTI wird ein inertes Molekül aus einer Quellenmikroelektrode in das Gehirn ECS gepulst. Da sich die Moleküle von dieser Quelle weg diffundieren, wird die sich ändernde Konzentration des Ions über die Zeit mit einer ionenselektiven Mikroelektrode gemessen, die etwa 100 μm entfernt ist. Aus der resultierenden Diffusionskurve können sowohl Volumenanteil als auch Tortuosität berechnet werden. Diese Technik wurde in Gehirnscheiben von mehreren Arten (einschließlich Menschen) und in vivo verwendet , um akute und chronische Veränderungen an ECS zu untersuchen. Im Gegensatz zu anderen Methoden kann RTI verwendet werden, um sowohl reversible als auch irreversible Änderungen des Gehirns ECS in Echtzeit zu untersuchen.
Introduction
Der extrazelluläre Raum (ECS) ist das Netzwerk von miteinander verbundenen Kanälen außerhalb aller Gehirnzellen und enthält sowohl interstitielle Flüssigkeit als auch extrazelluläre Matrix ( Abbildung 1a und Abbildung 1b ). Die Verteilung von vielen Substanzen, die für die Gehirnzellfunktion erforderlich sind, einschließlich Nährstoffe, Hormone und Neurotransmitter, erfolgt durch Diffusion durch die ECS. Änderungen der physikalischen Parameter dieses Raumes, einschließlich Volumen, Geometrie und extrazelluläre Matrix, können die Diffusion durch die ECS und die lokalen Ionenkonzentrationen, die Gehirnzellen, die einen tiefen Einfluss auf die Gehirnzellfunktion 1 , 2 haben, drastisch beeinflussen.
Die Echtzeit-Iontophorese (RTI) dient zur Bestimmung von zwei strukturellen Merkmalen einer Hirnregion: Volumenanteil und Tortuosität 3 , 4 ,"Xref"> 5 Der Volumenanteil ( α ) ist der Anteil des von der ECS ( V ECS ) besetzten Gewebevolumens bezogen auf das gesamte Gewebevolumen ( V- Gewebe ) in einem repräsentativen Elementarvolumen;
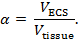
Tortuosität ( λ ) ist die relative Hinderung, dass eine Substanz beim Diffundieren durch eine Hirnregion im Vergleich zu einem Medium ohne Hindernisse begegnet;
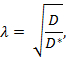
Wobei D * (cm 2 s -1 ) der effektive Diffusionskoeffizient der Substanz im Gehirn ist und D (cm 2 s -1 ) der freie Diffusionskoeffizient der Substanz in einem freien Medium, wie verdünntes Agarosegel, ist.
Heute ist die am häufigsten verwendete Sondensubstanz für die RTI-Methode ist das kleine Kation Tetramethylammonium (TMA). TMA hat ein Molekulargewicht von 74 g / mol, vollständig dissoziiert in Lösung und hat eine positive Ladung. RTI-Studien mit diesem Ion haben gezeigt, dass α 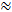 0,2 und λ
0,2 und λ 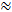 1,6 1 , 2 . Das bedeutet, dass die ECS etwa 20% des gesamten Hirnvolumens beträgt und dass die Diffusion eines kleinen, inerten Moleküls im ECS etwa 2,5 mal langsamer ist als in einem Medium ohne Hindernisse 3 . Jedoch variieren sowohl α als auch λ mit Hirnalter, Region und Zustand und in pathologischen Zuständen 1 . Veränderungen dieser Parameter wurden mit der Entwicklung des Gehirns, Alterung, Schlaf, Epilepsie und vielen anderen grundlegenden Prozessen und Erkrankungen des Gehirns verbunden 1, 6 Während andere Techniken α und λ messen, kann RTI sowohl in lokalisierten Regionen des lebenden Gewebes in Echtzeit messen. Aus diesem Grund ist RTI zu einem unverzichtbaren Werkzeug geworden, um Veränderungen in α und λ bei akuten und reversiblen Herausforderungen zu untersuchen.
1,6 1 , 2 . Das bedeutet, dass die ECS etwa 20% des gesamten Hirnvolumens beträgt und dass die Diffusion eines kleinen, inerten Moleküls im ECS etwa 2,5 mal langsamer ist als in einem Medium ohne Hindernisse 3 . Jedoch variieren sowohl α als auch λ mit Hirnalter, Region und Zustand und in pathologischen Zuständen 1 . Veränderungen dieser Parameter wurden mit der Entwicklung des Gehirns, Alterung, Schlaf, Epilepsie und vielen anderen grundlegenden Prozessen und Erkrankungen des Gehirns verbunden 1, 6 Während andere Techniken α und λ messen, kann RTI sowohl in lokalisierten Regionen des lebenden Gewebes in Echtzeit messen. Aus diesem Grund ist RTI zu einem unverzichtbaren Werkzeug geworden, um Veränderungen in α und λ bei akuten und reversiblen Herausforderungen zu untersuchen.
Die Theorie, die RTI unterstützt, wurde ursprünglich von Nicholson und Phillips validiert, und die Technik wurde seit dieser Zeit 4 , 7 ausführlich verwendet. Experimente, die RTI einsetzen, beginnen mit der Freisetzung eines Pulses von TMA aus einer Quellenmikroelektrode durch Iontophorese in ein verdünntes Agarosegel. Einmal ausgestoßen, diffundieren die Ionen frei von der Punktquelle und wählen aus einer potentiell unendlichen Anzahl von zufälligen Pfaden ( Abbildung 1d ). Die sich ändernde Konzentration des Ions wird über die Zeit unter Verwendung einer ionenselektiven Mikroelektrode (ISM) gemessen, die grob positioniert ist100 μm entfernt ( Abbildung 1c ). Die Änderungen der TMA-Konzentration werden aufgezeichnet und an eine Kurve angepasst, die die Berechnung von D und der Transportnummer der Iontophorese-Mikroelektrode erlaubt (Parameter, die im Protokoll diskutiert werden). Mit diesen Werten wird die Prozedur in einem interessierenden Hirnbereich wiederholt, um D * zu erhalten und sowohl α als auch λ zu berechnen. Die Steuerung der Iontophorese-Mikroelektrode, die Datenerfassung, die graphische Darstellung und die Anpassung der TMA-Konzentrationskurve und die Berechnung der experimentellen Parameter erfolgt in der Regel durch die Programme Wanda und Walter, die speziell für diesen Zweck konzipiert wurden (die Software und ihre Handbücher sind Frei von den Autoren auf Anfrage erhältlich).
Der Abschnitt "Protokoll" dieser Überprüfung beschreibt die grundlegenden Verfahren, die für die Konstruktion und Durchführung von RTI in Nagetierhirnscheiben erforderlich sind. Die Technik wurde auch in Nicht-Stab verwendetModelle, einschließlich menschliche Gehirnscheiben und in vivo Gehirnpräparate 1 , 4 , 6 , 8 , 9 . Der Abschnitt "Repräsentative Ergebnisse" bietet sowohl ideale als auch nicht ideale Ergebnisse, um Nuancen bei der Dateninterpretation hervorzuheben. Schließlich behandelt der Diskussionsteil kurz die Techniken zur Fehlerbehebung, die Beschränkungen von RTI, alternative Techniken, die zum Studium der ECS und zukünftige Anwendungen von RTI verwendet werden.
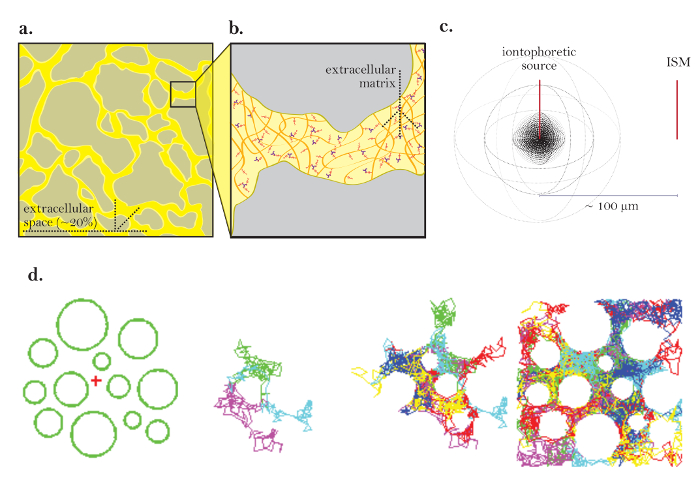
Abbildung 1: Diagramme der Diffusion durch ECS. ( A ) Diagramm der ECS: Zeigt die Größe und den Standort des ECS in einem typischen Gehirnteil an. Gelb markiert das ECS zwischen den grauen Gehirnzellenprozessen. Das Volumen des ECS beträgt etwa 20% des gesamten Gewebevolumens ( dh der Volumenanteil = 0.2) unter physiologischen Bedingungen. ( B ) Vergrößertes Diagramm des ECS: Highlights der physikalischen Parameter, die zur Tortuosität beitragen, einschließlich der Gehirnzellgeometrie (grau) und der extrazellulären Matrix (als Mesh von mehrfarbigen Glycosaminoglykanen und Proteoglykanen dargestellt). ( C ) 3D-Diagramm der Diffusion von einer Punktquelle: Demonstriert die Nettobewegung von inerten Molekülen von einer iontophoretischen Quelle zu einem ISM. Ohne Diffusionsbarrieren und zelluläre Aufnahme diffundieren Moleküle in alle Richtungen nach außen und erzeugen eine kugelförmige Konzentrationsfront. Das ISM quantifiziert die lokale Konzentration der aus der iontophoretischen Quelle freigesetzten inerten Moleküle. ( D ) Computersimulation der Diffusion in ECS des Gehirns: [Far left] Setup für Monte Carlo Simulation; Grüne Sphären stellen Gehirnzellenprozesse dar und das rote Kreuz stellt eine Punktquelle dar. Dieses Setup modelliert das in Abbildung 1a dargestellte Hirngewebe. [Mittlere Bilder] 3 und6 Moleküle, die zufällige Bewegungen durchführen, während sie durch den extrazellulären Raum des Gehirns diffundieren, in 2 Dimensionen gezeigt. [Weit rechts] Zufällige Spaziergänge von vielen Molekülen, die von der Punktquelle freigesetzt werden. Die Netzbewegung aller Moleküle von der Punktquelle ist nach außen, wie in Fig. 1c dargestellt, nach außen. Die kumulativen Zufallswege skizzieren die Räume zwischen den Zellen ( dh die ECS, siehe Referenz 5 für weitere Erläuterungen). Bitte klicken Sie hier, um eine größere Version dieser Figur zu sehen.
Protocol
Representative Results
Discussion
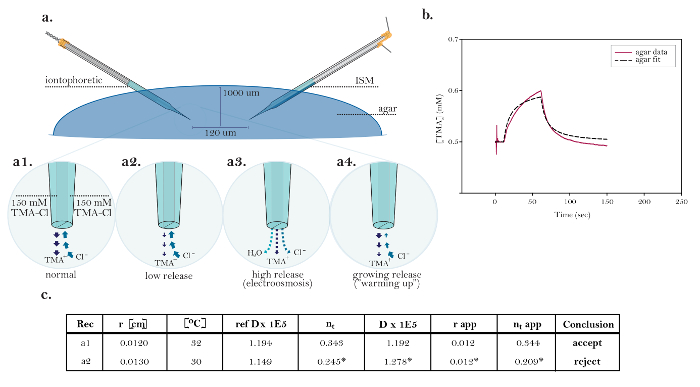
Abbildung 10: Nicht-ideale Daten, die gemeinsame technische Probleme demonstrieren. ( A ) Diagramme allgemeiner technischer Fragen mit Iontophorese-Mikroelektroden: Vergleich der normalen Freisetzung von TMA aus einer funktionierenden Iontophorese-Mikroelektrode mit drei Quellen, die technische Probleme zeigen. [Hohe Vergrößerung, a1] Der Strom in einer idealen iontophoretischen Quelle wird gl…
Disclosures
The authors have nothing to disclose.
Acknowledgements
Die Arbeit wurde von NIH NINDS bewilligt R01 NS047557 unterstützt.
Materials
| A/D and D/A converter | National Instruments Corporation | NI USB-6221 DAQ | The NI USB-6221 is still sold as a 'Legacy' device by NI. They recommend using NI USB-6341 X Series DAQs for new installations, however we have not tested the newer units. We describe the use of the NI USB-6221 with MATLAB and Windows 7 (32-bit). Alternatives: the much older PCI-MIO-16E-4 A/D converter (Used under Windows XP or older OS only) with BNC-2090 BNC connector panel and SH68-68-EP cable. As noted in the Wanda Manual, an experimental MATLAB program to use Axon Binary Files is available. |
| agarose | Lonza | NuSieve GTG Agarose #50081 | to prepare dilute agarose gel for RTI measurements |
| amplifier for ISM | Dagan | Model IX2-700 Dual Intracellular Preamplifier | ion and reference voltage amplifier with N=0.1 (for reference barrel) and N=0.001 (for ion barrel) headstages |
| biological compound miscroscope (with 4x and 10x objective) | for chipping the microelectrode tips and inspecting microelectrodes; various suppliers, e.g. AmScope | ||
| borosilicate theta capillary glass tubing | Harvard Apparatus | Warner Instruments model TG200-4; order #64-0811 | double-barreled glass tubing for ion-selective microelectrodes and iontophoretic microelectrodes; O.D. 2.0 mm, I.D. 1.4 mm, septum 0.2 mm, length 10 cm |
| brush | Winsor & Newton | University Series 233, size 0 | round shoft handle brush, available from Amazon |
| bunsen burner | Fisher | ||
| camera for visualizing micropipettes | Olympus | OLY-150 | requires monitor, IR filter on substage illuminator is optional |
| chart recorder | to record continuously voltages on ion-selective microelectrode during calibration in tetramethylammonium standards and during RTI experiment; e.g. Kipp & Zonen type BD112 dual-cannel chart recorded, available refurbished | ||
| chlorotrimethylsilane, puriss., > 99% | Sigma-Aldrich | catalog # 92360 | for silanization; CAUTION: flammable, acute toxicity (oral, dermal, inhalation), skin corrosion, eye damage, reacts violently with water, see Sigma-Aldrich Safety Information for full description |
| Commercial Software | The MathWorks | MATLAB, Data acquisition toolbox | for data acquisition and analysis using Wanda and Walter programs. Note that an academic license is available. |
| eye protective goggles | Fisher | ||
| fixed-stage compound microscope | Olympus | BX51WI | can use other compound microscopes with fixed stages |
| forceps | Fine Science Tools | #11251-10 | to chip glass capillary; Dumond #5, preferably used and no longer needed for fine work |
| fume hood | for silanization and filling the tip of ion-selective barrel with liquid ion exchanger; various supliers, e.g. Captair with approriate filter sold by Erlab | ||
| glass microscope slide | Fisher | #12-550A | to chip microelectrode tips |
| heater/stirrer | Fisher | Corning PC-420D | to prepare dilute agarose gel and stir solutions |
| iontophoretic unit | Dagan | ION-100 and PS-100 | ION-100 is a single channel iontophoresis unit +/- 130 V compliance; PS-100 is an external power supply; alternatives: e.g. Axoprobe-1A made by Axon Instruments (now Molecular Devices), out of production, check for availability of refurbished units (eBay and other sites) |
| liquid ion exchanger (LIX) for tetramethylammonium | World Precision Instruments | IE190 Potassium Ion Exchanger | Note: this is equivalent to the original Corning potassium exchanger 477317 based on tetraphenlyborate – do not confuse with neutral carrier potassium exchanger originating from the laboartory of Dr. Simon, ETH, Zurich, which does not sense tetramethylammonium, and is sold by Fluka. You can also make liquid ion exchanger for tetramethylammonium yourself: 3% by weight potassium tetrakis = (p-chlorophenyl) borate dissolved in 2,3-dimethylnitrobenzene. Buy chemicals from Fluka (now part of Sigma). See Oehme and Simon (1976) Anal. Chim. Acta 86: 21-25; CAUTION: The toxicological properties of this liquid ion exchanger have not been fully determined. Ingestion or contact with the human body may be harmful. Exercise due care! Liquid ion exchangers should be stored in a cool place out of direct sunlight. |
| microelectrode holder | WPI | M3301EH | to hold ion-selective microeletrode prefabricate for silanization and filling the tip of ion-selective barrel with liquid ion exchanger; WPI sells two versions of this holder, clear M3301EH and black M3301EH. In our experience, the clear M3301EH appears to be sturdier then the black M3301EH. |
| micromanipulator | Narishige | MM-3 | to position ion-selective microelectrode prefabricate during silanization and filling the tip of ion-selective barrel with liquid ion exchanger; can be substituted with any three-axis micromanipulator in good working condition |
| micropipette puller | Sutter Instruments | Model P-97 | to pull double-barreled glass tubing; other pullers can be used as long as they can accommodate large diameter double-barreled glass tubing |
| microprobe thermometer | Physiotemp | Model BAT-12R | fine probe of this thermometer is placed close to recording site |
| needle | BD | Syringes and Needles # 305122 (25 gauge) | for silanization; BD PrecisionGlide needles 25 G x 5/8 in (0.5mm x 16mm) |
| objective 5x dry | Olympus | MPlan N | |
| objective 10x water immersion | Olympus | UMPlan FL N | 10x objective is water immersion, numerical aperture is 0.3, working distance is 3.3 mm |
| plastic containers (with lids) | Fisher | #14-375-148 | to store tetramethylammonium standard solutions and microelectrodes |
| platform and x-y translation stage for fixed-stage microscope | EXFO | Gibraltar Burleigh | platform holds slice chamber, micromanipulators and accesorries, x-y translational stage moves microscope without compromising recording stability |
| porous minicup | for RTI measurements in a dilute agarose gel; homemade | ||
| reusable adhesive | Bostik | Blu-Tack | for securing microelectrodes to holding vessel and other uses; various suppliers, available from Amazon |
| robotic micromanipulator with precise x,y,z positioning | Sutter Instruments | MP-285 | two mircomanipulators are needed to hold separately ion-selective microelectrode and iontophoretic microelectrode. Also possible to glue micropipettes in a spaced array (see text). |
| signal conditioning unit with low-pass filter | Axon Instruments | CyberAmp 320 or 380 | no longer available from the manufacturer but may be available from E-Bay; alternatives: e.g. FLA-01 Filter/Amplifier from Cygnus Technology. This is a single channel instrument with a minimum cutoff at 10 Hz using a multipole Bessel filter but the company may be willing to modify it for a lower cutoff frequency (2 Hz) if needed. |
| silver wire | A-M Systems | #7830 | diameter 0.015", bare (no coating) |
| slice chamber | Harvard Apparatus | Warner Model RC-27L | this is submersion slice chamber; do not use interface slice chamber |
| stereomicroscope | for silanization and filling the tip of ion-selective barrel with liquid ion exchanger; horizontally mounted; various suppliers | ||
| syringe, 10 mL | BD | Syringes and Needles #309604 | to backfill microelectrodes and for silanization; BD Luer-Lok tip |
| syringe filter 0.22µm pore | Whatman | #6780-1302 | to filter backfill solutions; available from Fisher |
| syringe needle, 28 gauge, 97mm | World Precision Instruments | MicroFil MF28G-5 | to backfill microelectrodes |
| Teflon (=PTFE) tubing | Component Supply | STT-28 PTFE tube light wall (28 gauge) | for silanization of ion-selective barrel; fits on BD PrecisionGlide needles 25 G x 5/8 in. Note: Teflon is essential, PVC tubing would melt by hot wax. |
| temperature control system | Harvard Apparatus | Warner Models TC-344B and SH-27A | TC-344B is a dual automatic temperature controller, SH-27A is an in-line heater; controller and heater work with Warner slice chambers |
| tetramethyammonium (TMA) chloride | Sigma-Aldrich | T-3411 | 5 M solution; CAUTION: acute toxicity (oral, dermal, inhalation), carcinogenicity, hazardous to the aquatic environment, see Sigma-Aldrich Safety Information for full description |
| vibrating blade microtome | Leica | VT1000S | to cut brain slices |
| xylenes | Fisher | X5-1 | for silanization; CAUTION: flammable, acute toxicity (oral, dermal, inhalation), skin corrosion, eye damage, carcinogenicity, see Fisher Safety Information for full description |
References
- Sykova, E., Nicholson, C. Diffusion in brain extracellular space. Physiol Rev. 88 (4), 1277-1340 (2008).
- Nicholson, C. Diffusion and related transport mechanisms in brain tissue. Rep Prog Phys. 64 (7), 815-884 (2001).
- Nicholson, C. Ion-selective microelectrodes and diffusion measurements as tools to explore the brain cell microenvironment. J Neurosci Methods. 48 (3), 199-213 (1993).
- Nicholson, C., Phillips, J. M. Ion diffusion modified by tortuosity and volume fraction in the extracellular microenvironment of the rat cerebellum. J Physiol. 321, 225-257 (1981).
- Nicholson, C., Sykova, E. Extracellular space structure revealed by diffusion analysis. Trends Neurosci. 21 (5), 207-215 (1998).
- Xie, L. L., et al. Sleep drives metabolite clearance from the adult brain. Science. 342 (6156), 373-377 (2013).
- Hrabetova, S., Nicholson, C., Michael, A. C., Borland, L. M. Biophysical properties of brain extracellular space explored with ion-selective microelectrodes, integrative optical imaging and related techniques. Electrochemical Methods for Neuroscience Neuroscience. , 167-204 (2007).
- Rice, M. E., Okada, Y. C., Nicholson, C. Anisotropic and heterogeneous diffusion in the turtle cerebellum: implications for volume transmission. J Neurophysiol. 70 (5), 2035-2044 (1993).
- Vargova, L., et al. Diffusion parameters of the extracellular space in human gliomas. Glia. 42 (1), 77-88 (2003).
- Haack, N., Durry, S., Kafitz, K. W., Chesler, M., Rose, C. Double-barreled and concentric microelectrodes for measurement of extracellular ion signals in brain tissue. J Vis Exp. (103), (2015).
- Xiao, F., Hrabetova, S. Enlarged extracellular space of aquaporin-4-deficient mice does not enhance diffusion of Alexa Fluor 488 or dextran polymers. Neuroscience. 161 (1), 39-45 (2009).
- Sherpa, A. D., Pvan de Nes, ., Xiao, F., Weedon, J., Hrabetova, S. Gliotoxin-induced swelling of astrocytes hinders diffusion in brain extracellular space via formation of dead-space microdomains. Glia. 62 (7), 1053-1065 (2014).
- Kume-Kick, J., et al. Independence of extracellular tortuosity and volume fraction during osmotic challenge in rat neocortex. J Physiol. 542 (Pt 2), 515-527 (2002).
- Saghyan, A., Lewis, D. P., Hrabe, J., Hrabetova, S. Extracellular diffusion in laminar brain structures exemplified by hippocampus. J Neurosci Methods. 205 (1), 110-118 (2012).
- Fedirko, N., Svichar, N., Chesler, M. Fabrication and use of high-speed, concentric H+- and Ca2+-selective microelectrodes suitable for in vitro extracellular recording. J Neurophys. 96 (2), 919-924 (2006).
- Nicholson, C. Diffusion from an injected volume of a substance in brain tissue with arbitrary volume fraction and tortuosity. Brain Res. 333 (2), 325-329 (1985).
- Nicholson, C., Tao, L. Hindered diffusion of high molecular weight compounds in brain extracellular microenvironment measured with integrative optical imaging. Biophys J. 65 (6), 2277-2290 (1993).
- Thorne, R. G., Nicholson, C. In vivo diffusion analysis with quantum dots and dextrans predicts the width of brain extracellular space. Proc Natl Acad Sci U S A. 103 (14), 5567-5572 (2006).
- Wolak, D. J., Thorne, R. G. Diffusion of macromolecules in the brain: implications for drug delivery. Mol Pharm. 10 (5), 1492-1504 (2013).

