Iontoforesis en tiempo real con tetrametilamonio para cuantificar la fracción de volumen y la tortuosidad del espacio extracelular cerebral
Summary
Este protocolo describe la iontoforesis en tiempo real, un método que mide los parámetros físicos del espacio extracelular (ECS) de los cerebros vivos. La difusión de una molécula inerte liberada en el ECS se utiliza para calcular la fracción volumétrica de ECS y la tortuosidad. Es ideal para estudiar cambios reversibles agudos en ECS cerebral.
Abstract
Esta revisión describe los conceptos básicos y el protocolo para realizar el método de iontoforesis en tiempo real (RTI), el patrón oro para explorar y cuantificar el espacio extracelular (ECS) del cerebro vivo. El ECS rodea todas las células cerebrales y contiene tanto el líquido intersticial como la matriz extracelular. El transporte de muchas sustancias necesarias para la actividad cerebral, incluyendo neurotransmisores, hormonas y nutrientes, se produce por difusión a través de la ECS. Los cambios en el volumen y la geometría de este espacio ocurren durante los procesos cerebrales normales, como el sueño, y condiciones patológicas, como la isquemia. Sin embargo, la estructura y la regulación de ECS cerebral, particularmente en estados enfermos, sigue siendo en gran parte inexplorada. El método RTI mide dos parámetros físicos del cerebro vivo: fracción volumétrica y tortuosidad. La fracción de volumen es la proporción de volumen de tejido ocupado por ECS. La tortuosidad es una medida del impedimento relativo que una sustancia encuentra cuando se difunde a través de un cerebroEn comparación con un medio sin obstrucciones. En RTI, una molécula inerte es pulsada desde un microelectrodo fuente en el cerebro ECS. A medida que las moléculas se difunden lejos de esta fuente, la concentración cambiante del ion se mide con el tiempo usando un microelectrodo selectivo de iones situado aproximadamente a 100 μm de distancia. A partir de la curva de difusión resultante, tanto la fracción volumétrica como la tortuosidad pueden ser calculadas. Esta técnica se ha utilizado en rebanadas cerebrales de múltiples especies (incluyendo seres humanos) e in vivo para estudiar los cambios agudos y crónicos de ECS. A diferencia de otros métodos, RTI se puede utilizar para examinar tanto los cambios reversibles e irreversibles de la ECS cerebral en tiempo real.
Introduction
El espacio extracelular (ECS) es la red de canales interconectados exteriores a todas las células cerebrales y contiene tanto fluido intersticial como matriz extracelular ( Figura 1a y Figura 1b ). La distribución de muchas sustancias necesarias para la función de las células cerebrales, incluyendo nutrientes, hormonas y neurotransmisores, se produce por difusión a través de la ECS. Los cambios en los parámetros físicos de este espacio, incluyendo el volumen, la geometría y la matriz extracelular, pueden afectar drásticamente la difusión a través de la ECS y las concentraciones de iones locales que bañan las células cerebrales, que tienen un profundo impacto en la función de las células cerebrales 1 , 2 .
La iontoforesis en tiempo real (RTI) se utiliza para determinar dos características estructurales de una región del cerebro: fracción volumétrica y tortuosidad 3 , 4 ,"Xref"> 5. La fracción de volumen ( α ) es la proporción de volumen de tejido ocupado por la ECS ( V ECS ) con respecto al volumen de tejido total ( tejido V ) en un volumen elemental representativo;
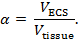
La tortuosidad ( λ ) es el obstáculo relativo que una sustancia encuentra cuando se difunde a través de una región del cerebro en comparación con un medio sin obstrucciones;
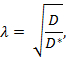
Donde D * (cm 2 s -1 ) es el coeficiente de difusión efectiva de la sustancia en el cerebro y D (cm 2 s -1 ) es el coeficiente de difusión libre de la sustancia en un medio libre, tal como gel de agarosa diluido.
Hoy en día, la sustancia de sonda más comúnmente utilizada para la RTI es el tetrametilamonio catiónico pequeño (TMA). TMA tiene un peso molecular de 74 g / mol, se disocia completamente en solución y tiene una carga positiva. RTI estudios con este ion han demostrado que α 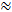 0,2 y λ
0,2 y λ 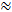 1,6 1 , 2 . Esto significa que el ECS es aproximadamente el 20% del volumen total del cerebro y que la difusión de una pequeña molécula inerte ocurre aproximadamente 2,5 veces más lenta en el ECS que en un medio sin obstrucciones 3 . Sin embargo, ambos α y λ varían con la edad, región y estado del cerebro y en condiciones patológicas 1 . Las alteraciones de estos parámetros se han relacionado con el desarrollo del cerebro, el envejecimiento, el sueño, la epilepsia y muchos otros procesos y enfermedades fundamentales del cerebro 1, 6 . Mientras que otras técnicas miden α y λ , RTI puede medir tanto en regiones localizadas de tejido vivo en tiempo real. Por esta razón, RTI se ha convertido en una herramienta indispensable para investigar los cambios en α y λ durante desafíos agudos y reversibles.
1,6 1 , 2 . Esto significa que el ECS es aproximadamente el 20% del volumen total del cerebro y que la difusión de una pequeña molécula inerte ocurre aproximadamente 2,5 veces más lenta en el ECS que en un medio sin obstrucciones 3 . Sin embargo, ambos α y λ varían con la edad, región y estado del cerebro y en condiciones patológicas 1 . Las alteraciones de estos parámetros se han relacionado con el desarrollo del cerebro, el envejecimiento, el sueño, la epilepsia y muchos otros procesos y enfermedades fundamentales del cerebro 1, 6 . Mientras que otras técnicas miden α y λ , RTI puede medir tanto en regiones localizadas de tejido vivo en tiempo real. Por esta razón, RTI se ha convertido en una herramienta indispensable para investigar los cambios en α y λ durante desafíos agudos y reversibles.
La teoría que apoya RTI fue originalmente validada por Nicholson y Phillips, y la técnica se ha utilizado ampliamente desde entonces 4 , 7 . Los experimentos que emplean RTI comienzan con la liberación de un pulso de TMA desde un microelectrodo fuente por iontoforesis en un gel de agarosa diluido. Una vez expulsados, los iones se difunden libremente lejos de la fuente puntual, eligiendo entre un número potencialmente infinito de trayectos aleatorios ( Figura 1d ). La concentración cambiante del ion se mide con el tiempo utilizando un microelectrodo selectivo de iones (ISM) situado aproximadamente100 μm de distancia ( Figura 1c ). Los cambios en la concentración de TMA se representan gráficamente y se ajustan a una curva que permite calcular tanto el D como el número de transporte del microelectrodo de iontoforesis (parámetros discutidos en el Protocolo). Con estos valores, el procedimiento se repite en una región cerebral de interés para obtener D * y para calcular tanto α como λ . El control del microelectrodo de iontoforesis, la recopilación de datos, la representación gráfica y la adaptación de la curva de concentración de TMA y el cálculo de los parámetros experimentales son típicamente realizados por los programas Wanda y Walter, específicamente diseñados para este fin (el software y sus manuales son Libremente disponible de los autores a petición).
La sección del Protocolo de esta revisión describe los procedimientos básicos necesarios para diseñar y realizar la RTI en rodajas de cerebro de roedores. La técnica también se ha utilizado en la no-barraIncluyendo los cortes del cerebro humano y las preparaciones in vivo del cerebro 1 , 4 , 6 , 8 , 9 . La sección Resultados representativos proporciona resultados ideales y no ideales para resaltar matices en la interpretación de datos. Finalmente, la sección de Discusión abarca brevemente técnicas de resolución de problemas, limitaciones de RTI, técnicas alternativas usadas para estudiar el ECS y aplicaciones futuras de RTI.
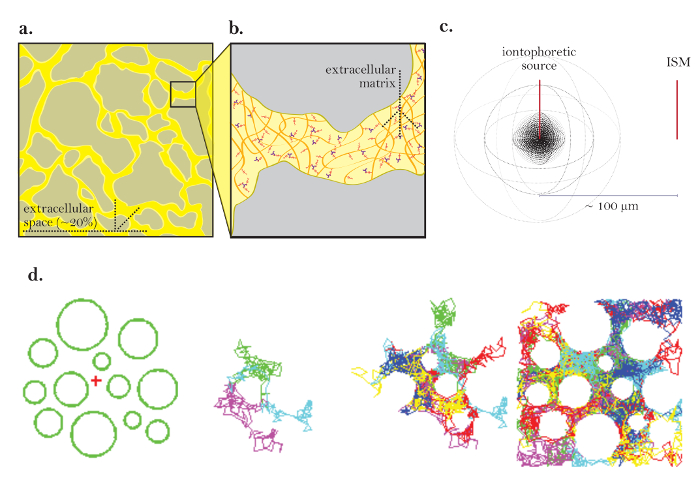
Figura 1: Diagramas de difusión a través de ECS. (A) Diagrama de ECS: Demuestra el tamaño y la ubicación de la ECS en una sección de cerebro típico. El amarillo marca el ECS entre los procesos grises de las células cerebrales. El volumen de ECS es aproximadamente 20% del volumen de tejido total ( es decir, la fracción de volumen = 0.2) en condiciones fisiológicas. B ) Diagrama ampliado del ECS: Destaca los parámetros físicos que contribuyen a la tortuosidad, incluyendo la geometría de las células cerebrales (gris) y la matriz extracelular (diagrama como una malla de glicosaminoglicanos multicolores y proteoglicanos). ( C ) Diagrama 3D de difusión de una fuente puntual: Demuestra el movimiento neto de moléculas inertes de una fuente iontoforética a una ISM. Excluyendo barreras de difusión y captación celular, las moléculas se difunden hacia el exterior en todas las direcciones, produciendo un frente de concentración esférica. El ISM cuantifica la concentración local de las moléculas inertes liberadas de la fuente iontoforética. D ) Simulación por computadora de la difusión en ECS del cerebro: [Extremo izquierdo] Configuración para la simulación de Monte Carlo; Las esferas verdes representan los procesos de las células cerebrales y la cruz roja representa una fuente puntual. Esta configuración modela el tejido cerebral diagrama en la Figura 1a . [Imágenes medias] 3 y6 moléculas que realizan movimientos al azar mientras que difunden a través del espacio extracelular del cerebro, demostrado en 2 dimensiones. [Derecha] Caminatas aleatorias de muchas moléculas liberadas de la fuente puntual. El movimiento neto de todas las moléculas desde la fuente puntual está hacia fuera como se representa en la Figura 1c . Los paseos aleatorios acumulados delimitan los espacios entre las celdas ( es decir, el ECS, véase la referencia 5 para una explicación adicional). Haga clic aquí para ver una versión más grande de esta figura.
Protocol
Representative Results
Discussion
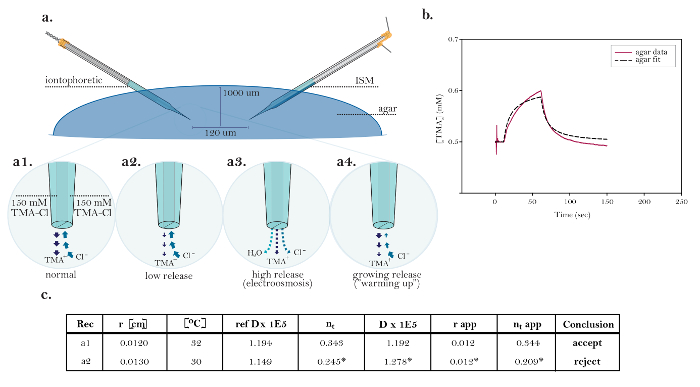
Figura 10: Datos no ideales que demuestran problemas técnicos comunes. (A) Los diagramas de problemas técnicos comunes con microelectrodos de iontoforesis: Comparación de la liberación normal de TMA de un microelectrodo funcionamiento iontoforesis con tres fuentes que demuestran problemas técnicos. [Aumento alto, a1] La corriente en una fuente iontoforética ideal es llevada igualmente por la …
Disclosures
The authors have nothing to disclose.
Acknowledgements
El trabajo fue apoyado por NIH NINDS concesión R01 NS047557.
Materials
| A/D and D/A converter | National Instruments Corporation | NI USB-6221 DAQ | The NI USB-6221 is still sold as a 'Legacy' device by NI. They recommend using NI USB-6341 X Series DAQs for new installations, however we have not tested the newer units. We describe the use of the NI USB-6221 with MATLAB and Windows 7 (32-bit). Alternatives: the much older PCI-MIO-16E-4 A/D converter (Used under Windows XP or older OS only) with BNC-2090 BNC connector panel and SH68-68-EP cable. As noted in the Wanda Manual, an experimental MATLAB program to use Axon Binary Files is available. |
| agarose | Lonza | NuSieve GTG Agarose #50081 | to prepare dilute agarose gel for RTI measurements |
| amplifier for ISM | Dagan | Model IX2-700 Dual Intracellular Preamplifier | ion and reference voltage amplifier with N=0.1 (for reference barrel) and N=0.001 (for ion barrel) headstages |
| biological compound miscroscope (with 4x and 10x objective) | for chipping the microelectrode tips and inspecting microelectrodes; various suppliers, e.g. AmScope | ||
| borosilicate theta capillary glass tubing | Harvard Apparatus | Warner Instruments model TG200-4; order #64-0811 | double-barreled glass tubing for ion-selective microelectrodes and iontophoretic microelectrodes; O.D. 2.0 mm, I.D. 1.4 mm, septum 0.2 mm, length 10 cm |
| brush | Winsor & Newton | University Series 233, size 0 | round shoft handle brush, available from Amazon |
| bunsen burner | Fisher | ||
| camera for visualizing micropipettes | Olympus | OLY-150 | requires monitor, IR filter on substage illuminator is optional |
| chart recorder | to record continuously voltages on ion-selective microelectrode during calibration in tetramethylammonium standards and during RTI experiment; e.g. Kipp & Zonen type BD112 dual-cannel chart recorded, available refurbished | ||
| chlorotrimethylsilane, puriss., > 99% | Sigma-Aldrich | catalog # 92360 | for silanization; CAUTION: flammable, acute toxicity (oral, dermal, inhalation), skin corrosion, eye damage, reacts violently with water, see Sigma-Aldrich Safety Information for full description |
| Commercial Software | The MathWorks | MATLAB, Data acquisition toolbox | for data acquisition and analysis using Wanda and Walter programs. Note that an academic license is available. |
| eye protective goggles | Fisher | ||
| fixed-stage compound microscope | Olympus | BX51WI | can use other compound microscopes with fixed stages |
| forceps | Fine Science Tools | #11251-10 | to chip glass capillary; Dumond #5, preferably used and no longer needed for fine work |
| fume hood | for silanization and filling the tip of ion-selective barrel with liquid ion exchanger; various supliers, e.g. Captair with approriate filter sold by Erlab | ||
| glass microscope slide | Fisher | #12-550A | to chip microelectrode tips |
| heater/stirrer | Fisher | Corning PC-420D | to prepare dilute agarose gel and stir solutions |
| iontophoretic unit | Dagan | ION-100 and PS-100 | ION-100 is a single channel iontophoresis unit +/- 130 V compliance; PS-100 is an external power supply; alternatives: e.g. Axoprobe-1A made by Axon Instruments (now Molecular Devices), out of production, check for availability of refurbished units (eBay and other sites) |
| liquid ion exchanger (LIX) for tetramethylammonium | World Precision Instruments | IE190 Potassium Ion Exchanger | Note: this is equivalent to the original Corning potassium exchanger 477317 based on tetraphenlyborate – do not confuse with neutral carrier potassium exchanger originating from the laboartory of Dr. Simon, ETH, Zurich, which does not sense tetramethylammonium, and is sold by Fluka. You can also make liquid ion exchanger for tetramethylammonium yourself: 3% by weight potassium tetrakis = (p-chlorophenyl) borate dissolved in 2,3-dimethylnitrobenzene. Buy chemicals from Fluka (now part of Sigma). See Oehme and Simon (1976) Anal. Chim. Acta 86: 21-25; CAUTION: The toxicological properties of this liquid ion exchanger have not been fully determined. Ingestion or contact with the human body may be harmful. Exercise due care! Liquid ion exchangers should be stored in a cool place out of direct sunlight. |
| microelectrode holder | WPI | M3301EH | to hold ion-selective microeletrode prefabricate for silanization and filling the tip of ion-selective barrel with liquid ion exchanger; WPI sells two versions of this holder, clear M3301EH and black M3301EH. In our experience, the clear M3301EH appears to be sturdier then the black M3301EH. |
| micromanipulator | Narishige | MM-3 | to position ion-selective microelectrode prefabricate during silanization and filling the tip of ion-selective barrel with liquid ion exchanger; can be substituted with any three-axis micromanipulator in good working condition |
| micropipette puller | Sutter Instruments | Model P-97 | to pull double-barreled glass tubing; other pullers can be used as long as they can accommodate large diameter double-barreled glass tubing |
| microprobe thermometer | Physiotemp | Model BAT-12R | fine probe of this thermometer is placed close to recording site |
| needle | BD | Syringes and Needles # 305122 (25 gauge) | for silanization; BD PrecisionGlide needles 25 G x 5/8 in (0.5mm x 16mm) |
| objective 5x dry | Olympus | MPlan N | |
| objective 10x water immersion | Olympus | UMPlan FL N | 10x objective is water immersion, numerical aperture is 0.3, working distance is 3.3 mm |
| plastic containers (with lids) | Fisher | #14-375-148 | to store tetramethylammonium standard solutions and microelectrodes |
| platform and x-y translation stage for fixed-stage microscope | EXFO | Gibraltar Burleigh | platform holds slice chamber, micromanipulators and accesorries, x-y translational stage moves microscope without compromising recording stability |
| porous minicup | for RTI measurements in a dilute agarose gel; homemade | ||
| reusable adhesive | Bostik | Blu-Tack | for securing microelectrodes to holding vessel and other uses; various suppliers, available from Amazon |
| robotic micromanipulator with precise x,y,z positioning | Sutter Instruments | MP-285 | two mircomanipulators are needed to hold separately ion-selective microelectrode and iontophoretic microelectrode. Also possible to glue micropipettes in a spaced array (see text). |
| signal conditioning unit with low-pass filter | Axon Instruments | CyberAmp 320 or 380 | no longer available from the manufacturer but may be available from E-Bay; alternatives: e.g. FLA-01 Filter/Amplifier from Cygnus Technology. This is a single channel instrument with a minimum cutoff at 10 Hz using a multipole Bessel filter but the company may be willing to modify it for a lower cutoff frequency (2 Hz) if needed. |
| silver wire | A-M Systems | #7830 | diameter 0.015", bare (no coating) |
| slice chamber | Harvard Apparatus | Warner Model RC-27L | this is submersion slice chamber; do not use interface slice chamber |
| stereomicroscope | for silanization and filling the tip of ion-selective barrel with liquid ion exchanger; horizontally mounted; various suppliers | ||
| syringe, 10 mL | BD | Syringes and Needles #309604 | to backfill microelectrodes and for silanization; BD Luer-Lok tip |
| syringe filter 0.22µm pore | Whatman | #6780-1302 | to filter backfill solutions; available from Fisher |
| syringe needle, 28 gauge, 97mm | World Precision Instruments | MicroFil MF28G-5 | to backfill microelectrodes |
| Teflon (=PTFE) tubing | Component Supply | STT-28 PTFE tube light wall (28 gauge) | for silanization of ion-selective barrel; fits on BD PrecisionGlide needles 25 G x 5/8 in. Note: Teflon is essential, PVC tubing would melt by hot wax. |
| temperature control system | Harvard Apparatus | Warner Models TC-344B and SH-27A | TC-344B is a dual automatic temperature controller, SH-27A is an in-line heater; controller and heater work with Warner slice chambers |
| tetramethyammonium (TMA) chloride | Sigma-Aldrich | T-3411 | 5 M solution; CAUTION: acute toxicity (oral, dermal, inhalation), carcinogenicity, hazardous to the aquatic environment, see Sigma-Aldrich Safety Information for full description |
| vibrating blade microtome | Leica | VT1000S | to cut brain slices |
| xylenes | Fisher | X5-1 | for silanization; CAUTION: flammable, acute toxicity (oral, dermal, inhalation), skin corrosion, eye damage, carcinogenicity, see Fisher Safety Information for full description |
References
- Sykova, E., Nicholson, C. Diffusion in brain extracellular space. Physiol Rev. 88 (4), 1277-1340 (2008).
- Nicholson, C. Diffusion and related transport mechanisms in brain tissue. Rep Prog Phys. 64 (7), 815-884 (2001).
- Nicholson, C. Ion-selective microelectrodes and diffusion measurements as tools to explore the brain cell microenvironment. J Neurosci Methods. 48 (3), 199-213 (1993).
- Nicholson, C., Phillips, J. M. Ion diffusion modified by tortuosity and volume fraction in the extracellular microenvironment of the rat cerebellum. J Physiol. 321, 225-257 (1981).
- Nicholson, C., Sykova, E. Extracellular space structure revealed by diffusion analysis. Trends Neurosci. 21 (5), 207-215 (1998).
- Xie, L. L., et al. Sleep drives metabolite clearance from the adult brain. Science. 342 (6156), 373-377 (2013).
- Hrabetova, S., Nicholson, C., Michael, A. C., Borland, L. M. Biophysical properties of brain extracellular space explored with ion-selective microelectrodes, integrative optical imaging and related techniques. Electrochemical Methods for Neuroscience Neuroscience. , 167-204 (2007).
- Rice, M. E., Okada, Y. C., Nicholson, C. Anisotropic and heterogeneous diffusion in the turtle cerebellum: implications for volume transmission. J Neurophysiol. 70 (5), 2035-2044 (1993).
- Vargova, L., et al. Diffusion parameters of the extracellular space in human gliomas. Glia. 42 (1), 77-88 (2003).
- Haack, N., Durry, S., Kafitz, K. W., Chesler, M., Rose, C. Double-barreled and concentric microelectrodes for measurement of extracellular ion signals in brain tissue. J Vis Exp. (103), (2015).
- Xiao, F., Hrabetova, S. Enlarged extracellular space of aquaporin-4-deficient mice does not enhance diffusion of Alexa Fluor 488 or dextran polymers. Neuroscience. 161 (1), 39-45 (2009).
- Sherpa, A. D., Pvan de Nes, ., Xiao, F., Weedon, J., Hrabetova, S. Gliotoxin-induced swelling of astrocytes hinders diffusion in brain extracellular space via formation of dead-space microdomains. Glia. 62 (7), 1053-1065 (2014).
- Kume-Kick, J., et al. Independence of extracellular tortuosity and volume fraction during osmotic challenge in rat neocortex. J Physiol. 542 (Pt 2), 515-527 (2002).
- Saghyan, A., Lewis, D. P., Hrabe, J., Hrabetova, S. Extracellular diffusion in laminar brain structures exemplified by hippocampus. J Neurosci Methods. 205 (1), 110-118 (2012).
- Fedirko, N., Svichar, N., Chesler, M. Fabrication and use of high-speed, concentric H+- and Ca2+-selective microelectrodes suitable for in vitro extracellular recording. J Neurophys. 96 (2), 919-924 (2006).
- Nicholson, C. Diffusion from an injected volume of a substance in brain tissue with arbitrary volume fraction and tortuosity. Brain Res. 333 (2), 325-329 (1985).
- Nicholson, C., Tao, L. Hindered diffusion of high molecular weight compounds in brain extracellular microenvironment measured with integrative optical imaging. Biophys J. 65 (6), 2277-2290 (1993).
- Thorne, R. G., Nicholson, C. In vivo diffusion analysis with quantum dots and dextrans predicts the width of brain extracellular space. Proc Natl Acad Sci U S A. 103 (14), 5567-5572 (2006).
- Wolak, D. J., Thorne, R. G. Diffusion of macromolecules in the brain: implications for drug delivery. Mol Pharm. 10 (5), 1492-1504 (2013).

