Realtidsanalytik med tetrametylammonium för att kvantifiera volymfraktioner och tortuositet i hjärnens extracellulära utrymme
Summary
I detta protokoll beskrivs realtids-jontofores, en metod som mäter fysiska parametrar för det extracellulära utrymmet (ECS) av levande hjärnor. Spridningen av en inert molekyl som släpps ut i ECS används för att beräkna ECS-volymfraktionen och tortuositeten. Den är idealisk för att studera akuta reversibla förändringar i hjärnans ECS.
Abstract
Denna översikt beskriver de grundläggande begreppen och protokollet för att utföra den realtids jontoforesmetoden (RTI), guldstandarden för att utforska och kvantifiera den extracellulära rymden (ECS) hos den levande hjärnan. ECS omger alla hjärnceller och innehåller både interstitiell vätska och extracellulär matris. Transporten av många ämnen som krävs för hjärnaktivitet, inklusive neurotransmittorer, hormoner och näringsämnen, sker genom diffusion genom ECS. Förändringar i volymen och geometrin för detta utrymme uppträder under normala hjärnprocesser, som sömn och patologiska tillstånd, som ischemi. Strukturen och reglering av hjärnans ECS, i synnerhet i sjuka stater, förblir emellertid i stort sett oförskriven. RTI-metoden mäter två fysiska parametrar av levande hjärna: volymfraktion och tortuositet. Volymfraktion är andelen vävnadsvolym upptagen av ECS. Tortuosity är ett mått på det relativa hindret som ett ämne möter när det diffunderar genom hjärnans reGion jämfört med ett medium utan hinder. I RTI pulseras en inert molekyl från en källa-mikroelektrod till hjärnans ECS. När molekyler diffunderar bort från denna källa mäts den förändrade koncentrationen av jonen över tiden med användning av en jonselektiv mikroelektrode placerad ungefär 100 | im bort. Från den resulterande diffusionskurvan kan både volymfraktion och tortuositet beräknas. Denna teknik har använts i hjärnskivor från flera arter (inklusive människor) och in vivo för att studera akuta och kroniska förändringar i ECS. Till skillnad från andra metoder kan RTI användas för att undersöka både reversibla och irreversibla förändringar i hjärnans ECS i realtid.
Introduction
Det extracellulära utrymmet (ECS) är nätet av sammankopplade kanaler yttre till alla hjärnceller och innehåller både interstitiell vätska och extracellulär matris ( Figur 1a och Figur 1b ). Fördelningen av många ämnen som krävs för hjärncellsfunktionen, inklusive näringsämnen, hormoner och neurotransmittorer, uppträder genom diffusion genom ECS. Förändringar i de fysiska parametrarna för detta utrymme, inklusive volymen, geometrin och extracellulär matris, kan drastiskt påverka diffusion genom ECS och de lokala jonkoncentrationerna i bada hjärnceller som har en djupgående inverkan på hjärncellsfunktionen 1 , 2 .
Realtidsjontofores (RTI) används för att bestämma två strukturella egenskaper hos en hjärnområde: volymfraktion och tortuositet 3 , 4 ,"Xref"> 5. Volymfraktion ( a ) är andelen vävnadsvolym upptaget av ECS ( V ECS ) i förhållande till den totala vävnadsvolymen ( V- vävnad ) i en representativ elementär volym;
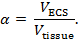
Tortuosity ( λ ) är det relativa hindret att ett ämne möter när det diffunderar genom en hjärnområde jämfört med ett medium utan hinder.
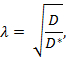
Där D * (cm 2 s -1 ) är substansens effektiva diffusionskoefficient i hjärnan och D (cm 2 s -1 ) är substansens fria diffusionskoefficient i ett fritt medium, såsom utspädd agarosgel.
Idag är det mest använda probprovet för RTI-metoden är det lilla katjontetrametylammoniumet (TMA). TMA har en molekylvikt av 74 g / mol, dissocieras fullständigt i lösning och har en positiv laddning. RTI-studier med denna jon har visat att a 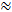 0,2 och λ
0,2 och λ 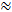 1,6 1 , 2 . Det betyder att ECS är ungefär 20% av den totala hjärnvolymen och att diffusionen av en liten inert molekyl uppträder ungefär 2,5 gånger långsammare i ECS än i ett medium utan hinder 3 . Både α och λ varierar emellertid med hjärnålder, region och tillstånd och i patologiska förhållanden 1 . Ändringar av dessa parametrar har kopplats till hjärnans utveckling, åldrande, sömn, epilepsi och många andra grundläggande processer och hjärnans sjukdomar 1, 6 . Medan andra tekniker mäter α och λ kan RTI mäta både i lokaliserade områden av levande vävnad i realtid. Av denna anledning har RTI blivit ett oumbärligt verktyg för att undersöka förändringar i a och λ under akuta och reversibla utmaningar.
1,6 1 , 2 . Det betyder att ECS är ungefär 20% av den totala hjärnvolymen och att diffusionen av en liten inert molekyl uppträder ungefär 2,5 gånger långsammare i ECS än i ett medium utan hinder 3 . Både α och λ varierar emellertid med hjärnålder, region och tillstånd och i patologiska förhållanden 1 . Ändringar av dessa parametrar har kopplats till hjärnans utveckling, åldrande, sömn, epilepsi och många andra grundläggande processer och hjärnans sjukdomar 1, 6 . Medan andra tekniker mäter α och λ kan RTI mäta både i lokaliserade områden av levande vävnad i realtid. Av denna anledning har RTI blivit ett oumbärligt verktyg för att undersöka förändringar i a och λ under akuta och reversibla utmaningar.
Teorin som stödjer RTI validerades ursprungligen av Nicholson och Phillips, och tekniken har använts i stor utsträckning sedan den tiden 4 , 7 . Experiment som använder RTI börjar med frisättningen av en puls av TMA från en källa-mikroelektrod genom jontofores till en utspädd agarosgel. Därefter diffusioneras joner fritt från punktkällan och väljer från ett potentiellt oändligt antal slumpmässiga vägar ( Figur 1d ). Den förändrade koncentrationen av jon mäts över tiden med användning av en jon-selektiv mikroelektrode (ISM) placerad grovt100 μm borta ( Figur 1c ). Förändringarna i TMA-koncentrationen grafiseras och monteras på en kurva som möjliggör beräkning av både D och transportnivån för jontofores mikroelektroden (parametrar som diskuteras i protokollet). Med dessa värden upprepas proceduren i en hjärnregion av intresse för att erhålla D * och att beräkna både a och λ . Kontroll av jontofores mikroelektroden, datainsamling, grafning och montering av TMA-koncentrationskurvan och beräkning av försöksparametrarna görs vanligtvis av programmen Wanda och Walter, som har utformats speciellt för detta ändamål (programvaran och deras manualer är Fritt tillgänglig från författarna på begäran).
Protokolldelen i denna översikt beskriver de grundläggande procedurer som behövs för att designa och utföra RTI i hjärnskivor av gnagare. Tekniken har också använts i non-rodEnt-modeller, inklusive humana hjärnskivor och hjärnpreparat in vivo 1 , 4 , 6 , 8 , 9 . Avsnittet Representativa resultat ger både ideala och ideala resultat för att markera nyanser i datatolkning. Slutligen behandlar diskussionsdelen kortfattat felsökningstekniker, begränsningar av RTI, alternativa tekniker som används för att studera ECS och framtida tillämpningar av RTI.
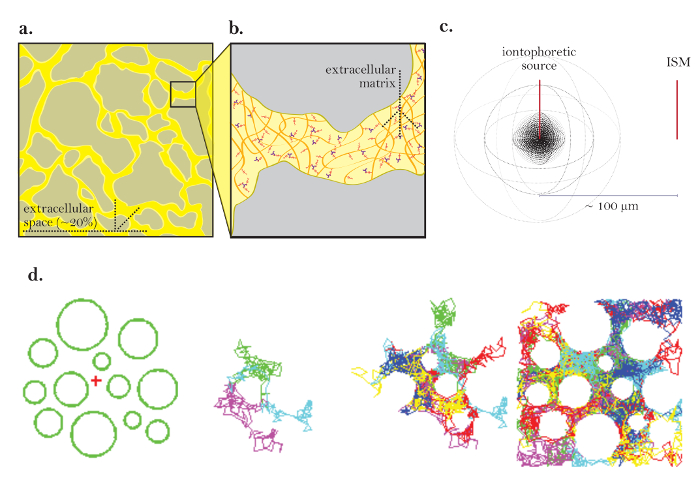
Figur 1: Diagram över diffusion genom ECS. (A) Diagram av ECS: Visar på storleken och placeringen av ECS i en typisk hjärnsektion. Gul markerar ECS mellan de grå hjärncellsprocesserna. Volymen av ECS är ungefär 20% av den totala vävnadsvolymen ( dvs. volymfraktionen = 0.2) under fysiologiska förhållanden. B ) Förstorat diagram över ECS: Uppmärksammar fysiska parametrar som bidrar till tortuositet, inklusive hjärncellsgeometri (grå) och extracellulär matris (diagrammatiserat som ett nät av mångfärgade glykosaminoglykaner och proteoglykaner). ( C ) 3D-diagram över diffusion från en punktkälla: Demonterar nätrörelsen av inerta molekyler från en jontoforetisk källa till en ISM. Exklusive diffusionsbarriärer och cellupptagning diffunderar molekylerna utåt i alla riktningar och producerar en sfärisk koncentrationsfront. ISM kvantifierar den lokala koncentrationen av de inerta molekylerna som frigörs från den jontoforetiska källan. ( D ) Datorsimulering av diffusion i hjärnans ECS: [Längst till vänster] Inställning för Monte Carlo-simulering; Gröna sfärer representerar hjärncellsprocesser och det röda korset representerar en punktkälla. Denna inställning modellerar hjärnvävnaden som visas i figur 1a . [Mellanbilder] 3 och6 molekyler som utför slumpmässiga rörelser som de diffunderar genom hjärnans extracellulära utrymme, visas i 2 dimensioner. [Farst till höger] Slumpmässiga promenader av många molekyler släppta från punktkällan. Nettoförflyttningen av alla molekyler från punktkällan är utåt såsom avbildas i figur 1c . De kumulativa slumpmässiga promenaderna skisserar mellanrummen mellan cellerna ( dvs. ECS, se referens 5 för ytterligare förklaring). Vänligen klicka här för att se en större version av denna figur.
Protocol
Representative Results
Discussion
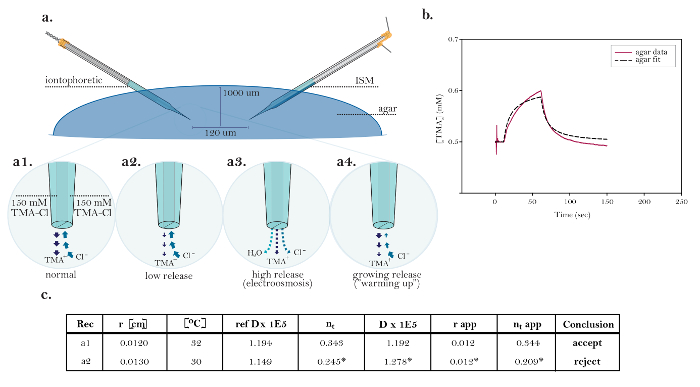
Figur 10: Icke-idealiska data som visar gemensamma tekniska problem. (A) diagram av gemensamma tekniska problem med jontofores microelectrodes: Jämförelse av normal frisättning av TMA från en fungerande jontofores mikroelektrod med tre källor visar tekniska frågor. [Hög förstoring, a1] Strömmen i en ideell jontoforetisk källa bärs lika med TMA-frigöring och kloridupptagning. [Hög först…
Disclosures
The authors have nothing to disclose.
Acknowledgements
Arbetet stöddes av NIH NINDS bidrag R01 NS047557.
Materials
| A/D and D/A converter | National Instruments Corporation | NI USB-6221 DAQ | The NI USB-6221 is still sold as a 'Legacy' device by NI. They recommend using NI USB-6341 X Series DAQs for new installations, however we have not tested the newer units. We describe the use of the NI USB-6221 with MATLAB and Windows 7 (32-bit). Alternatives: the much older PCI-MIO-16E-4 A/D converter (Used under Windows XP or older OS only) with BNC-2090 BNC connector panel and SH68-68-EP cable. As noted in the Wanda Manual, an experimental MATLAB program to use Axon Binary Files is available. |
| agarose | Lonza | NuSieve GTG Agarose #50081 | to prepare dilute agarose gel for RTI measurements |
| amplifier for ISM | Dagan | Model IX2-700 Dual Intracellular Preamplifier | ion and reference voltage amplifier with N=0.1 (for reference barrel) and N=0.001 (for ion barrel) headstages |
| biological compound miscroscope (with 4x and 10x objective) | for chipping the microelectrode tips and inspecting microelectrodes; various suppliers, e.g. AmScope | ||
| borosilicate theta capillary glass tubing | Harvard Apparatus | Warner Instruments model TG200-4; order #64-0811 | double-barreled glass tubing for ion-selective microelectrodes and iontophoretic microelectrodes; O.D. 2.0 mm, I.D. 1.4 mm, septum 0.2 mm, length 10 cm |
| brush | Winsor & Newton | University Series 233, size 0 | round shoft handle brush, available from Amazon |
| bunsen burner | Fisher | ||
| camera for visualizing micropipettes | Olympus | OLY-150 | requires monitor, IR filter on substage illuminator is optional |
| chart recorder | to record continuously voltages on ion-selective microelectrode during calibration in tetramethylammonium standards and during RTI experiment; e.g. Kipp & Zonen type BD112 dual-cannel chart recorded, available refurbished | ||
| chlorotrimethylsilane, puriss., > 99% | Sigma-Aldrich | catalog # 92360 | for silanization; CAUTION: flammable, acute toxicity (oral, dermal, inhalation), skin corrosion, eye damage, reacts violently with water, see Sigma-Aldrich Safety Information for full description |
| Commercial Software | The MathWorks | MATLAB, Data acquisition toolbox | for data acquisition and analysis using Wanda and Walter programs. Note that an academic license is available. |
| eye protective goggles | Fisher | ||
| fixed-stage compound microscope | Olympus | BX51WI | can use other compound microscopes with fixed stages |
| forceps | Fine Science Tools | #11251-10 | to chip glass capillary; Dumond #5, preferably used and no longer needed for fine work |
| fume hood | for silanization and filling the tip of ion-selective barrel with liquid ion exchanger; various supliers, e.g. Captair with approriate filter sold by Erlab | ||
| glass microscope slide | Fisher | #12-550A | to chip microelectrode tips |
| heater/stirrer | Fisher | Corning PC-420D | to prepare dilute agarose gel and stir solutions |
| iontophoretic unit | Dagan | ION-100 and PS-100 | ION-100 is a single channel iontophoresis unit +/- 130 V compliance; PS-100 is an external power supply; alternatives: e.g. Axoprobe-1A made by Axon Instruments (now Molecular Devices), out of production, check for availability of refurbished units (eBay and other sites) |
| liquid ion exchanger (LIX) for tetramethylammonium | World Precision Instruments | IE190 Potassium Ion Exchanger | Note: this is equivalent to the original Corning potassium exchanger 477317 based on tetraphenlyborate – do not confuse with neutral carrier potassium exchanger originating from the laboartory of Dr. Simon, ETH, Zurich, which does not sense tetramethylammonium, and is sold by Fluka. You can also make liquid ion exchanger for tetramethylammonium yourself: 3% by weight potassium tetrakis = (p-chlorophenyl) borate dissolved in 2,3-dimethylnitrobenzene. Buy chemicals from Fluka (now part of Sigma). See Oehme and Simon (1976) Anal. Chim. Acta 86: 21-25; CAUTION: The toxicological properties of this liquid ion exchanger have not been fully determined. Ingestion or contact with the human body may be harmful. Exercise due care! Liquid ion exchangers should be stored in a cool place out of direct sunlight. |
| microelectrode holder | WPI | M3301EH | to hold ion-selective microeletrode prefabricate for silanization and filling the tip of ion-selective barrel with liquid ion exchanger; WPI sells two versions of this holder, clear M3301EH and black M3301EH. In our experience, the clear M3301EH appears to be sturdier then the black M3301EH. |
| micromanipulator | Narishige | MM-3 | to position ion-selective microelectrode prefabricate during silanization and filling the tip of ion-selective barrel with liquid ion exchanger; can be substituted with any three-axis micromanipulator in good working condition |
| micropipette puller | Sutter Instruments | Model P-97 | to pull double-barreled glass tubing; other pullers can be used as long as they can accommodate large diameter double-barreled glass tubing |
| microprobe thermometer | Physiotemp | Model BAT-12R | fine probe of this thermometer is placed close to recording site |
| needle | BD | Syringes and Needles # 305122 (25 gauge) | for silanization; BD PrecisionGlide needles 25 G x 5/8 in (0.5mm x 16mm) |
| objective 5x dry | Olympus | MPlan N | |
| objective 10x water immersion | Olympus | UMPlan FL N | 10x objective is water immersion, numerical aperture is 0.3, working distance is 3.3 mm |
| plastic containers (with lids) | Fisher | #14-375-148 | to store tetramethylammonium standard solutions and microelectrodes |
| platform and x-y translation stage for fixed-stage microscope | EXFO | Gibraltar Burleigh | platform holds slice chamber, micromanipulators and accesorries, x-y translational stage moves microscope without compromising recording stability |
| porous minicup | for RTI measurements in a dilute agarose gel; homemade | ||
| reusable adhesive | Bostik | Blu-Tack | for securing microelectrodes to holding vessel and other uses; various suppliers, available from Amazon |
| robotic micromanipulator with precise x,y,z positioning | Sutter Instruments | MP-285 | two mircomanipulators are needed to hold separately ion-selective microelectrode and iontophoretic microelectrode. Also possible to glue micropipettes in a spaced array (see text). |
| signal conditioning unit with low-pass filter | Axon Instruments | CyberAmp 320 or 380 | no longer available from the manufacturer but may be available from E-Bay; alternatives: e.g. FLA-01 Filter/Amplifier from Cygnus Technology. This is a single channel instrument with a minimum cutoff at 10 Hz using a multipole Bessel filter but the company may be willing to modify it for a lower cutoff frequency (2 Hz) if needed. |
| silver wire | A-M Systems | #7830 | diameter 0.015", bare (no coating) |
| slice chamber | Harvard Apparatus | Warner Model RC-27L | this is submersion slice chamber; do not use interface slice chamber |
| stereomicroscope | for silanization and filling the tip of ion-selective barrel with liquid ion exchanger; horizontally mounted; various suppliers | ||
| syringe, 10 mL | BD | Syringes and Needles #309604 | to backfill microelectrodes and for silanization; BD Luer-Lok tip |
| syringe filter 0.22µm pore | Whatman | #6780-1302 | to filter backfill solutions; available from Fisher |
| syringe needle, 28 gauge, 97mm | World Precision Instruments | MicroFil MF28G-5 | to backfill microelectrodes |
| Teflon (=PTFE) tubing | Component Supply | STT-28 PTFE tube light wall (28 gauge) | for silanization of ion-selective barrel; fits on BD PrecisionGlide needles 25 G x 5/8 in. Note: Teflon is essential, PVC tubing would melt by hot wax. |
| temperature control system | Harvard Apparatus | Warner Models TC-344B and SH-27A | TC-344B is a dual automatic temperature controller, SH-27A is an in-line heater; controller and heater work with Warner slice chambers |
| tetramethyammonium (TMA) chloride | Sigma-Aldrich | T-3411 | 5 M solution; CAUTION: acute toxicity (oral, dermal, inhalation), carcinogenicity, hazardous to the aquatic environment, see Sigma-Aldrich Safety Information for full description |
| vibrating blade microtome | Leica | VT1000S | to cut brain slices |
| xylenes | Fisher | X5-1 | for silanization; CAUTION: flammable, acute toxicity (oral, dermal, inhalation), skin corrosion, eye damage, carcinogenicity, see Fisher Safety Information for full description |
References
- Sykova, E., Nicholson, C. Diffusion in brain extracellular space. Physiol Rev. 88 (4), 1277-1340 (2008).
- Nicholson, C. Diffusion and related transport mechanisms in brain tissue. Rep Prog Phys. 64 (7), 815-884 (2001).
- Nicholson, C. Ion-selective microelectrodes and diffusion measurements as tools to explore the brain cell microenvironment. J Neurosci Methods. 48 (3), 199-213 (1993).
- Nicholson, C., Phillips, J. M. Ion diffusion modified by tortuosity and volume fraction in the extracellular microenvironment of the rat cerebellum. J Physiol. 321, 225-257 (1981).
- Nicholson, C., Sykova, E. Extracellular space structure revealed by diffusion analysis. Trends Neurosci. 21 (5), 207-215 (1998).
- Xie, L. L., et al. Sleep drives metabolite clearance from the adult brain. Science. 342 (6156), 373-377 (2013).
- Hrabetova, S., Nicholson, C., Michael, A. C., Borland, L. M. Biophysical properties of brain extracellular space explored with ion-selective microelectrodes, integrative optical imaging and related techniques. Electrochemical Methods for Neuroscience Neuroscience. , 167-204 (2007).
- Rice, M. E., Okada, Y. C., Nicholson, C. Anisotropic and heterogeneous diffusion in the turtle cerebellum: implications for volume transmission. J Neurophysiol. 70 (5), 2035-2044 (1993).
- Vargova, L., et al. Diffusion parameters of the extracellular space in human gliomas. Glia. 42 (1), 77-88 (2003).
- Haack, N., Durry, S., Kafitz, K. W., Chesler, M., Rose, C. Double-barreled and concentric microelectrodes for measurement of extracellular ion signals in brain tissue. J Vis Exp. (103), (2015).
- Xiao, F., Hrabetova, S. Enlarged extracellular space of aquaporin-4-deficient mice does not enhance diffusion of Alexa Fluor 488 or dextran polymers. Neuroscience. 161 (1), 39-45 (2009).
- Sherpa, A. D., Pvan de Nes, ., Xiao, F., Weedon, J., Hrabetova, S. Gliotoxin-induced swelling of astrocytes hinders diffusion in brain extracellular space via formation of dead-space microdomains. Glia. 62 (7), 1053-1065 (2014).
- Kume-Kick, J., et al. Independence of extracellular tortuosity and volume fraction during osmotic challenge in rat neocortex. J Physiol. 542 (Pt 2), 515-527 (2002).
- Saghyan, A., Lewis, D. P., Hrabe, J., Hrabetova, S. Extracellular diffusion in laminar brain structures exemplified by hippocampus. J Neurosci Methods. 205 (1), 110-118 (2012).
- Fedirko, N., Svichar, N., Chesler, M. Fabrication and use of high-speed, concentric H+- and Ca2+-selective microelectrodes suitable for in vitro extracellular recording. J Neurophys. 96 (2), 919-924 (2006).
- Nicholson, C. Diffusion from an injected volume of a substance in brain tissue with arbitrary volume fraction and tortuosity. Brain Res. 333 (2), 325-329 (1985).
- Nicholson, C., Tao, L. Hindered diffusion of high molecular weight compounds in brain extracellular microenvironment measured with integrative optical imaging. Biophys J. 65 (6), 2277-2290 (1993).
- Thorne, R. G., Nicholson, C. In vivo diffusion analysis with quantum dots and dextrans predicts the width of brain extracellular space. Proc Natl Acad Sci U S A. 103 (14), 5567-5572 (2006).
- Wolak, D. J., Thorne, R. G. Diffusion of macromolecules in the brain: implications for drug delivery. Mol Pharm. 10 (5), 1492-1504 (2013).

