使用Tg(Vtg1:mcherry)斑马鱼胚胎测试内分泌干扰化合物的雌激素效应
Summary
目前这里是使用斑马鱼胚胎Tg(vtg1:mCherry)来检测雌激素效应的详细协议。该协议涵盖鱼类的繁殖和胚胎的治疗,并强调内分泌干扰化合物(EDC)引起的荧光信号的检测、文献和评估。
Abstract
环境中有许多内分泌干扰化合物(EDC),尤其是雌激素物质。由于这些物质的化学多样性,很难发现这些物质;因此,越来越多地使用效果检测方法,如雌激素效应敏感生物监测器/生物致病生物。这些生物监测生物体包括几种鱼类模型。该协议涵盖使用斑马鱼Tg(vtg1:mCherry)转基因线作为生物监测生物体,包括鱼类的繁殖和胚胎的治疗,重点是检测、记录和评估EDC诱导的荧光信号。这项工作的目标是演示使用Tg(vtg1:mCherry)转基因线胚胎来检测雌激素效应。这项工作记录了使用转基因斑马鱼胚胎Tg(vtg1:mCherry)通过测试两种雌激素物质α-泽拉不醇来检测雌激素效应。所述协议只是设计测定的基础;测试方法可根据测试端点和样本而变化。此外,它可以与其他测定方法相结合,从而促进转基因线的未来使用。
Introduction
在我们的环境中,有大量内分泌干扰化合物(EDC)是我们环境中最危险的物质之一。这些主要是从自然资源中污染水的雌激素化合物。属于该组的物质的化学多样性使得测试其存在变得困难,因为检测这些物质需要不同的分析方法。根据它们的化学结构,很难确定一种物质是否真的能够充当雌激素。此外,这些物质永远不会以纯形式存在于环境中,因此它们的影响可能受其他化合物的影响,太1。这个问题可以通过效果检测方法解决,例如使用生物监测器/生物致病生物,显示雌激素效应2,3,4,5。3,4,52
最近,各种细胞系6和酵母为基础的测试系统22,33已经开发出来检测雌激素效应。然而,这些通常只能检测物质与雌激素受体2,3,的结合。此外,它们无法模拟生物体中复杂的生理过程,或检测生命阶段的激素敏感阶段;因此,它们往往导致错误的结果。
众所周知,某些基因对生物体中的雌激素反应敏感。通过分子生物学方法检测基因产品也可以在蛋白质或mRNA级别8,9,9但通常涉及动物牺牲。8动物保护法已经变得更加严格,对替代性测试系统的需求也日益增长,这种试验系统可以最大限度地减少实验中使用的动物的数量和痛苦,或者用另一个模型系统10取代动物模型。随着荧光蛋白的发现和生物标志物线的产生,转基因技术提供了很好的替代方案。有了这些线,雌激素敏感基因的激活可以在体内测试。
在脊椎动物中,鱼类在环境风险评估中的潜力是突出的。与哺乳动物模型相比,它们有许多优点:作为水生生物,它们能够通过整个身体吸收污染物,产生大量的后代,而且它们的一些物种的特点是生成时间短。它们的内分泌系统和生理过程与其他脊椎动物,甚至哺乳动物,包括人类12有很大的相似之处。
几种用于检测鱼类雌激素效应的基因也已知。最重要的是雌激素受体芳香酶-b,胆碱-H,和维泰洛宁(vtg)7,13。7,13最近,一些产生雌激素的生物传感器线也创造了从鱼模型在实验室使用,如从斑马鱼(达尼奥雷里奥)4,5,14,15,16,17。4,5,14,15,16,17斑马鱼在创建生物传感器线的主要优点是胚胎和幼虫的透明体,因为荧光报告器信号可以在体内轻松研究,而不会牺牲动物10。除了动物保护,它也是一个有价值的功能,因为它允许研究同一个人的反应在治疗的不同时间18。
这些实验使用维泰洛根因记者转基因斑马鱼线15。用于开发Tg(vtg1:mCherry)的转基因结构具有长(3.4 kbp)天然维泰洛根-1启动子。雌激素受体(ER)是由配体激活的增强蛋白,是类固醇/核受体超级家庭的代表。ER结合到特定的DNA序列称为雌激素反应元素(EREs),具有高亲和力和转活性基因表达对雌二醇和其他雌激素物质的反应,所以在启动子中更多的ERE导致更强的反应19。在Tg(vtg1:mCherry)的启动区域有17个ERE位点,它们有望模仿原生vtg基因15的表达。在性成熟的女性中,荧光信号有连续的表达。然而,在雄性和胚胎中,肝脏中的表达只有在雌激素治疗时才能看到(图1)。
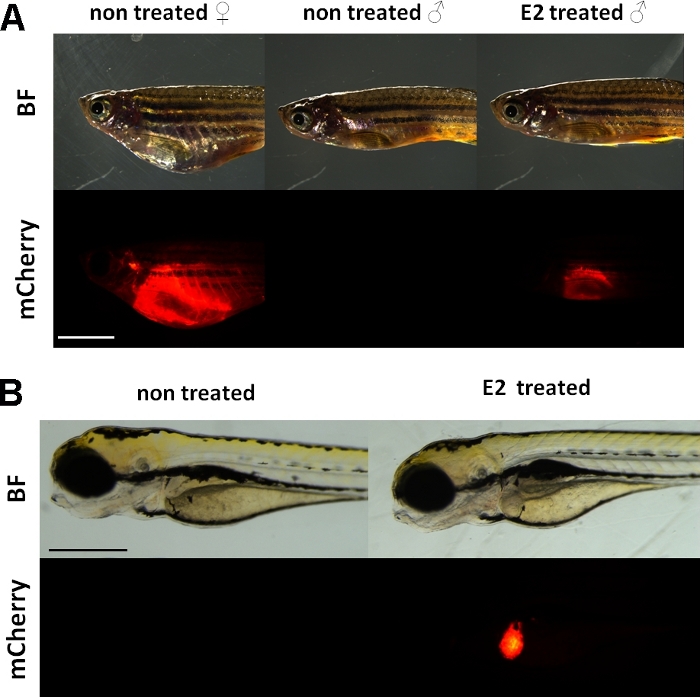
图1:vtg1:mCherry转基因成年斑马鱼和5dpf胚胎肝脏的红色荧光信号,17-β-雌二醇(E2)诱导后。在女性和男性治疗E2(25μg/L暴露时间:48小时)肝脏强荧光是可见的,即使通过色素的皮肤。未经治疗的雄性(A)看不到荧光信号。E2 诱导(50 μg/L 暴露时间:0-120 hpf)后,还可以观察到 5 dpf 胚胎肝脏中的红色荧光信号,这在控制胚胎(B) 中不可见。虽然荧光信号持续存在于成年女性体内,但主要为男性和胚胎,适合检测雌激素效应。(BF:亮场,mCherry:红色荧光滤光片视图,单纯图像,比例杆 A:5mm,比例杆B:250μm)请单击此处查看此图的较大版本。
与内源性维泰洛源类似,mCherry 记者只在肝脏中表达。由于维泰洛根宁只在雌激素存在的情况下产生,因此控制装置中没有荧光信号。因为表达只在肝脏,评估结果要容易得多15。
该线的胚胎的敏感性和可用性已研究的各种雌激素化合物混合物,以及环境样本15,20,在大多数情况下剂量反应15,20关系被记录(图2)。然而,在剧毒,主要是肝毒性,物质(如泽拉酮),只有非常弱的荧光信号可能可见于治疗胚胎的肝脏,最大强度荧光信号可以达到一个非常小的浓度范围内,这使得很难建立剂量效应关系20。
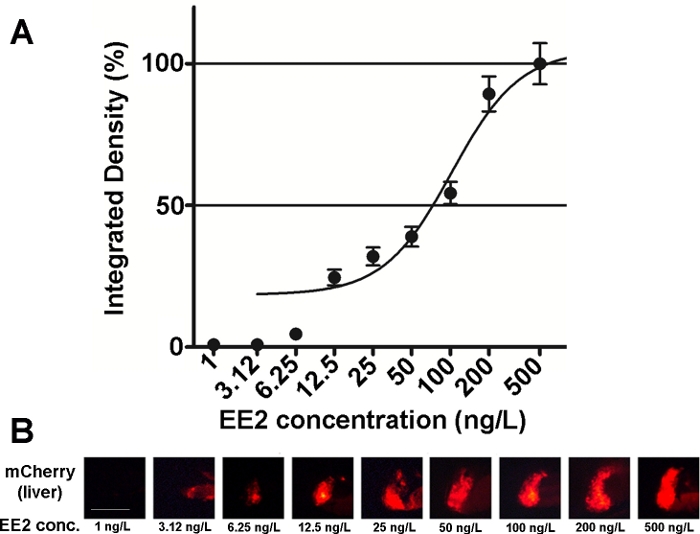
图2:肝脏的剂量反应图(A)和荧光图像(mCherry),在5dpf vtg1:mCherry幼虫中,暴露于17-β-乙二醇二醇(EE2)。结果表示为从信号强度和受影响区域大小(+SEM,n = 60)生成的集成密度。100% 是指观测到的最大值。荧光信号强度随着浓度的逐渐增加。比例线 = 250 μm. 请单击此处查看此图的较大版本。
环境中存在几种雌激素物质, 如17-μ-雌二醇(环境浓度:0.1±5.1纳克/升)21,17-β-乙酰二醇(环境浓度:0.16~0.2μg/L)22,泽拉酮 (环境浓度: 0.095~0.22 μg/L)23, 双酚-A (环境浓度: 0.45~17.2毫克/升)24.当在转基因胚胎的帮助下以纯活性形式测试这些物质时,用于荧光标志检测的最低观测效果浓度(LOEC)为17-β–雌二醇的100纳克/升, 1 ng/L 代表 17-α-乙酰二醇,100 ng/L 代表泽拉酮,1 mg/L 代表双酚-A(96-120 hpf 处理),非常接近或非常接近15.的环境浓度范围。Tg(vtg1:mCherry)转基因线有助于在直接接触后检测废水样品中的雌激素。线是敏感作为常用酵母雌激素测试,生物卢米尼森酵母雌激素(BLYES)测定15。在这条线的帮助下,使用化学混合物20证实了β-环糊精对泽拉酮诱导毒性的保护作用。
在最近的一份报告中,在两种雌激素泽拉酮(ZEA)代谢物的帮助下,在体内使用转基因线,α-泽拉醇(+-ZOL和+-ZOL)25。协议基线适合研究几种化合物或环境样本对Tg(vtg1:mCherry)胚胎的雌激素效应。
Protocol
Representative Results
Discussion
在毒理学研究中,生物监测器/生物杀病剂对雌激素效应的使用一直在蔓延。体内模型发挥着突出的作用,因为与体外测试不同,它们不仅提供有关细胞或受体反应的信息,还允许对生物体内复杂过程进行调查。研究雌激素效应的几条转基因线已经产生于斑马鱼,其中一条用于这些研究。此处描述的方法说明了用于测试此线胚胎的协议,以便检测纯活性成分体内的雌激素活性。
<p class="jov…Disclosures
The authors have nothing to disclose.
Acknowledgements
这项工作得到了国家研究、发展和创新基金国家研究、发展和创新办公室的支持;赠款协议:NVKP_16-1-2016-0003,EFOP-3.6.3-VEKOP-16-2017-0008项目由欧盟共同资助,以及由创新和技术部授予的Szent István大学主题卓越项目NKFIH-831-10/2019。
Materials
| 24 well tissue culture plate | Jet Biofil | TCP011024 | |
| Calcium-chloride (CaCl2) | Reanal Laborvegyszer Ltd. | 16383-0-27-39 | |
| GraphPad Prism 6.01 software | GraphPad Software Inc. | ||
| ImageJ software | National Institutes of Health, USA | Public access software, downloadable from: http://imagej.nih.gov/ | |
| Leica Application Suite X calibrated software | Leica Microsystems GmbH. | We used the softver described in the experiments, but any photographic software complies with the tests | |
| Leica M205 FA stereomicroscope, Leica DFC 7000T camera | Leica Microsystems GmbH. | We used the equipments described in the experiments, but any fluorescent stereomicroscope is suitable for the tests | |
| Magnesium-sulphate (MgSO4) | Reanal Laborvegyszer Ltd. | 20342-0-27-38 | |
| mCherry filter | Leica Microsystems GmbH. | ||
| Mehyl-cellulose | Sigma Aldrich Ltd. | 274429 | |
| Microloader pipette tip | Eppendorf GmbH. | 5242956003 | |
| Pasteur pipette | VWR International LLC. | 612-1684 | |
| Petri-dish | Jet Biofil | TCD000060 | |
| Potassium-chloride (KCl) | Reanal Laborvegyszer Ltd. | 18050-0-01-33 | |
| Sodium-chloride (NaCl) | Reanal Laborvegyszer Ltd. | 24640-0-01-38 | |
| Tricane-methanesulfonate (MS-222) | Sigma Aldrich Ltd. | E10521 |
References
- Sumpter, J. P. Endocrine Disrupters in the Aquatic Environment : An Overview. Acta Hydrochimica et Hydrobiologica. 33 (1), 9-16 (2005).
- Routledge, E. J., Sumpter, J. P. Estrogenic activity of surfactants and some of their degradation products assessed using a recombinant yeast screen. Environmental Toxicology and Chemistry. 15 (3), 241-248 (1996).
- Sanseverino, J., et al. Use of Saccharomyces cerevisiae BLYES Expressing Bacterial Bioluminescence for Rapid, Sensitive Detection of Estrogenic Compounds. Applied and Environmental Microbiology. 71 (8), 4455-4460 (2008).
- Fetter, E., et al. Effect-directed analysis for estrogenic compounds in a fluvial sediment sample using transgenic cyp19a1b-GFP zebrafish embryos. Aquatic Toxicology. 154, 221-229 (2014).
- Gorelick, D. A., Halpern, M. E. Visualization of estrogen receptor transcriptional activation in zebrafish. Endocrinology. 152 (7), 2690-2703 (2011).
- Rider, C. V., Hartig, P. C., Cardon, M. C., Wilson, V. S. Development of a competitive binding assay system with recombinant estrogen receptors from multiple species. Toxicology Letters. 184 (2), 85-89 (2009).
- Gunnarsson, L., Kristiansson, E., Förlin, L., Nerman, O., Larsson, J. Sensitive and robust gene expression changes in fish exposed to estrogen – a microarray approach. BMC Genomics. 8 (149), 1-9 (2007).
- Vander Ven, L. T. M., et al. Vitellogenin expression in zebrafish Danio rerio evaluation by histochemistry, immunohistochemistry, and in situ mRNA hybridisation. Aquatic Toxicology. 65 (1), 1-11 (2003).
- Bakos, K., et al. Developmental toxicity and estrogenic potency of zearalenone in zebrafish (Danio rerio). Aquatic Toxicology. 136-137, 13-21 (2013).
- Strähle, U., et al. Zebrafish embryos as an alternative to animal experiments – A commentary on the definition of the onset of protected life stages in animal welfare regulations. Reproductive Toxicology. 33 (2), 128-132 (2012).
- Tsang, M. Zebrafish : A Tool for Chemical Screens. Birth Defects Research, Part C. 90 (3), 185-192 (2010).
- Hill, A. J., Teraoka, H., Heideman, W., Peterson, R. E. Zebrafish as a model vertebrate for investigating chemical toxicity. Toxicological Sciences. 86 (1), 6-19 (2005).
- Lee, C., Na, J. G., Lee, K., Park, K. Choriogenin mRNA induction in male medaka, Oryzias latipes as a biomarker of endocrine disruption. Aquatic Toxicology. 61 (3-4), 233-241 (2002).
- Chen, H., et al. Generation of a fluorescent transgenic zebrafish for detection of environmental estrogens. Aquatic Toxicology. 96 (1), 53-61 (2010).
- Bakos, K., et al. Estrogen sensitive liver transgenic zebrafish (Danio rerio) line (Tg(vtg1:mCherry)) suitable for the direct detection of estrogenicity in environmental samples. Aquatic Toxicology. 208, 157-167 (2019).
- Abdelmoneim, A., Clark, C., Mukai, M. Fluorescent reporter zebrafish line for estrogenic compound screening generated using a CRISPR/Cas9-mediated knock-in system. Toxicological Sciences. 173 (2), 336-346 (2019).
- Tong, S. K., et al. A cyp19a1b-GFP (aromatase B) transgenic zebrafish line that expresses GFP in radial glial cells. Genesis. 47 (2), 67-73 (2009).
- Segner, H. Zebrafish (Danio rerio) as a model organism for investigating endocrine disruption. Comparative Biochemistry and Physiology, Part C: Toxicology and Pharmacology. 149 (2), 187-195 (2009).
- Klinge, C. M. Estrogen receptor interaction with estrogen response elements. Nucleic Acids Res. 29 (14), 2905-2919 (2001).
- Faisal, Z., et al. Protective effects of beta-cyclodextrins vs. zearalenone-induced toxicity in HeLa cells and Tg(vtg1:mCherry) zebrafish embryos. Chemosphere. 240, 1-11 (2020).
- Kolpin, D. W., et al. Pharmaceuticals, hormones, and other organic wastewater contaminants in U.S. streams, 1999-2000: A national reconnaissance. Environmental Science and Technology. 36 (6), 1202-1211 (2002).
- Kuch, H. M., Ballschmiter, K. Determination of endocrine-disrupting phenolic compounds and estrogens in surface and drinking water by HRGC-(NCI)-MS in the picogram per liter range. Environmental Science and Technology. 35 (15), 3201-3206 (2001).
- Lundgren, M. S., Novak, P. J. Quantification of phytoestrogens in industrial waste streams. Environmental Toxicology and Chemistry. 28 (11), 2318-2323 (2009).
- Masoner, J. R., Kolpin, D. W., Furlong, E. T., Cozzarelli, I. M., Gray, J. L. Landfill leachate as a mirror of today’s disposable society: Pharmaceuticals and other contaminants of emerging concern in final leachate from landfills in the conterminous United States. Environmental Toxicology and Chemistry. 35 (4), 906-918 (2016).
- Panel on Additives and Products or Substances used in Animal Feed (FEEDA). EFSA Statement on the establishment of guidelines for the assessment of additives from the functional group ‘substances for reduction of the contamination of feed by mycotoxins’ 1 EFSA. EFSA Journal. 8 (7), 1-8 (2010).
- Braunbeck, T., et al. Towards an alternative for the acute fish LC(50) test in chemical assessment: the fish embryo toxicity test goes multi-species – an update. Altex. 22 (50), 87-102 (2005).
- Schneider, C. A., Rasband, W. S., Eliceiri, K. W. NIH Image to ImageJ: 25 years of image analysis. Nature Methods. 9 (7), 671-675 (2012).
- Ober, E. A., Field, H. A., Stainier, D. Y. R. From endoderm formation to liver and pancreas development in zebrafish. Mechanisms of Development. 120 (1), 5-18 (2003).
- Tao, T., Peng, J. Liver development in zebrafish (Danio rerio). Journal of Genetics and Genomics. 36 (6), 325-334 (2009).
- Shier, W. T., Shier, A. C., Xie, W., Mirocha, C. J. Structure-activity relationships for human estrogenic activity in zearalenone mycotoxins. Toxicon. 39 (9), 1435-1438 (2001).
- Panel, E., Chain, F. Appropriateness to set a group health-based guidance value for zearalenone and its modified forms EFSA Panel on Contaminants in the Food Chain (CONTAM). EFSA Journal. 14, 4425 (2016).
- Binder, E. M. Managing the risk of mycotoxins in modern feed production. Animal Feed Science and Technology. 133 (1-2), 149-166 (2007).
- Risa, A., Krifaton, C., Kukolya, J., Kriszt, B., Cserháti, M., Táncsics, A. Aflatoxin B1 and Zearalenone-Detoxifying Profile of Rhodococcus Type Strains. Current Microbiology. 75 (7), 907-917 (2018).

