Met behulp van Tg (Vtg1:mcherry) Zebrafish Embryo's om de oestrogene effecten van endocriene verstorende verbindingen te testen
Summary
Aanwezig is een gedetailleerd protocol voor het gebruik van zebravis embryo’s Tg (vtg1: mCherry) voor de detectie van oestrogene effecten. Het protocol heeft betrekking op de voortplanting van de vis en de behandeling van embryo’s, en benadrukt de detectie, documentatie en de evaluatie van fluorescerende signalen veroorzaakt door hormoonontregelende verbindingen (EDC).
Abstract
Er zijn veel hormoonontregelende verbindingen (EDC) in het milieu, vooral oestrogene stoffen. De opsporing van deze stoffen is moeilijk vanwege hun chemische diversiteit; daarom worden steeds meer effectdetectiemethoden gebruikt, zoals oestrogene effectgevoelige biomonitor/bio-indicatororganismen. Deze biomonitoringorganismen omvatten verschillende vismodellen. Dit protocol heeft betrekking op het gebruik van zebravis Tg(vtg1: mCherry) transgene lijn als biomonitoringorganisme, met inbegrip van de voortplanting van vis en de behandeling van embryo’s, met de nadruk op de detectie, documentatie en evaluatie van fluorescerende signalen veroorzaakt door EDC. Het doel van het werk is de demonstratie van het gebruik van de Tg(vtg1: mCherry) transgene lijnembryo’s om oestrogene effecten op te sporen. Dit werk documenteert het gebruik van transgene zebravisembryo’s Tg(vtg1: mCherry) voor de detectie van oestrogene effecten door het testen van twee oestrogene stoffen, α- en β-zearalenol. Het beschreven protocol is slechts een basis voor het ontwerpen van tests; de testmethode kan worden gevarieerd op basis van de testeindpunten en de monsters. Bovendien kan het worden gecombineerd met andere testmethoden, waardoor het toekomstige gebruik van de transgene lijn wordt vergemakkelijkt.
Introduction
Er is een aanzienlijk aantal hormoonontregelende verbindingen (EDC) die tot de gevaarlijkste stoffen in ons milieu behoren. Dit zijn voornamelijk oestrogene verbindingen die water uit natuurlijke hulpbronnen vervuilen. De chemische diversiteit van de stoffen die tot de groep behoren, maakt het testen op hun aanwezigheid moeilijk, aangezien verschillende analysemethoden nodig zijn voor de detectie ervan. Op basis van hun chemische structuur is het zeer moeilijk om te bepalen of een stof daadwerkelijk in staat is om op te treden als een oestrogeen. Bovendien zijn deze stoffen nooit in zuivere vorm in het milieu aanwezig, dus de effecten ervan kunnen ook door andere verbindingen worden beïnvloed1. Dit probleem kan worden opgelost door effectdetectiemethoden, zoals het gebruik van biomonitor/bio-indicatororganismen die oestrogene effecten vertonen2,3,4,5.
Onlangs is een verscheidenheid van cellijn6 en gist-gebaseerde testsystemen2,3 ontwikkeld om oestrogene effecten te detecteren. Deze zijn echter over het algemeen alleen in staat om de binding van de stof aan de oestrogeenreceptor2,3op te sporen . Bovendien zijn ze niet in staat om complexe fysiologische processen in het organisme te modelleren, of om hormoongevoelige fasen van levensfasen op te sporen; ze leiden dus vaak tot valse resultaten.
Het is bekend dat bepaalde genen gevoelig reageren op oestrogeen in levende organismen7. De detectie van genproducten door moleculaire biologie methoden is ook mogelijk op het eiwit of mRNA niveau8,9, maar meestal gaat het om dierenoffers. De wetgeving inzake dierenbescherming is strenger geworden en er is een groeiende vraag naar alternatieve testsystemen die het aantal en het lijden van dieren die bij experimenten worden gebruikt of de vervanging van het diermodel door een ander modelsysteem10minimaliseren. Met de ontdekking van fluorescerende eiwitten en de creatie van biomarkerlijnen bieden transgene technologieën een goed alternatief11. Met deze lijnen kan de activering van een oestrogeengevoelig gen in vivo worden getest.
Onder gewervelde dieren is het potentieel van vissen bij de milieurisicobeoordeling uitstekend. Ze bieden veel voordelen ten opzichte van zoogdiermodellen: als aquatische organismen zijn ze in staat om verontreinigende stoffen door hun hele lichaam te absorberen, een groot aantal nakomelingen te produceren, en sommige van hun soorten worden gekenmerkt door korte generatietijd. Hun endocriene systeem en fysiologische processen vertonen grote gelijkenissen met andere gewervelde dieren en zelfs met zoogdieren, waaronder mensen12.
Verschillende genen voor de detectie van oestrogene effecten bij vissen zijn ook bekend. De belangrijkste zijn de oestrogeenreceptoren aromatase-b, choriogenin-H, en vitellogenine (vtg)7,13. Onlangs zijn er ook verschillende oestrogeenproducerende biosensorlijnen gemaakt van vismodellen die in het laboratorium worden gebruikt, zoals van zebravissen (Danio rerio)4,5,14,15,16,17. Het belangrijkste voordeel van zebravissen bij het maken van biosensorlijnen is het transparante lichaam van de embryo’s en larven, omdat het fluorescerende reportersignaal vervolgens gemakkelijk in vivo kan worden bestudeerd zonder het dier op te offeren10. Naast de bescherming van dieren, het is ook een waardevol kenmerk als het mogelijk maakt voor het bestuderen van de reactie van hetzelfde individu op verschillende tijdstippen van de behandeling18.
Deze experimenten maken gebruik van een vitellogenin reporter transgene zebravis lijn15. De transgene constructie die wordt gebruikt voor de ontwikkeling van Tg(vtg1:mCherry) heeft een lange (3,4 kbp) natuurlijke vitellogenin-1 promotor. De oestrogeenreceptor (ER) is een enhancer eiwit geactiveerd door liganden dat is een vertegenwoordiger van de steroïde / nucleaire receptor superfamilie. ER bindt aan specifieke DNA-sequenties genaamd oestrogeen respons elementen (EREs) met hoge affiniteit en transactiveert genexpressie in reactie op estradiol en andere oestrogene stoffen, dus hoe meer ERE in de promotor veroorzaakt een sterkere respons19. Er zijn 17 ERE-sites in het promotorgebied van de Transgene-bouwer Tg(vtg1:mCherry) en van hen wordt verwacht dat ze de expressie van het inheemse vtg-gen15nabootsen. Er is een continue expressie van het fluorescerende signaal bij seksueel gerijpte vrouwen. Bij mannen en embryo’s is de expressie in de lever echter alleen zichtbaar bij behandeling met oestrogene stoffen (figuur 1).
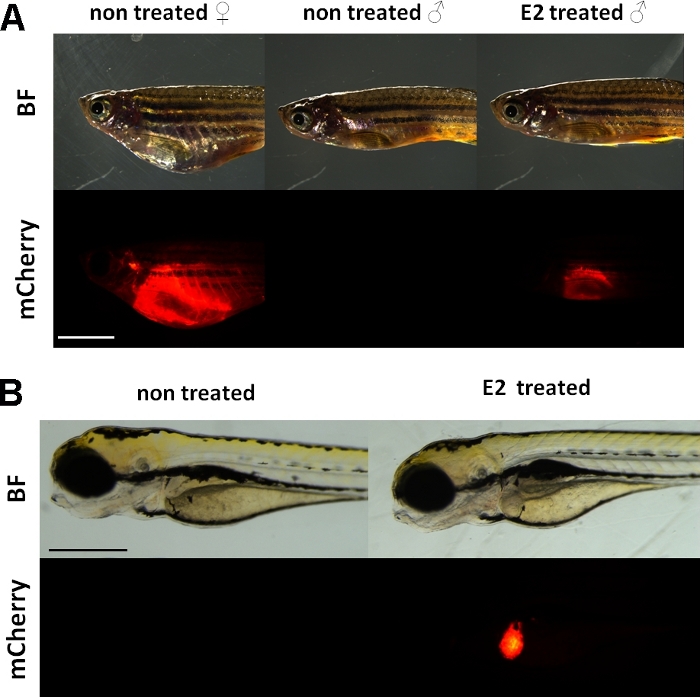
Figuur 1: Rood fluorescerend signaal in de lever van vtg1:mCherry transgene volwassen zebravis en 5 dpf embryo’s, na 17-ß-estradiol (E2) inductie. Bij vrouwen en bij mannen die met E2 worden behandeld (25 μg/L blootstellingstijd:48 uur) is sterke fluorescentie van de lever zelfs zichtbaar via de gepigmenteerde huid. Er is geen fluorescerend signaal zichtbaar bij onbehandelde mannen(A). Na E2-inductie (50 μg/L-blootstellingstijd: 0-120 pk) kan ook een rood fluorescerend signaal in de lever van 5 dpf-embryo’s worden waargenomen, wat niet zichtbaar is bij controleembryo’s (B). Terwijl het fluorescerende signaal continu aanwezig is bij volwassen vrouwtjes, zijn voornamelijk mannetjes en embryo’s van de lijn geschikt voor het detecteren van oestrogene effecten. (BF: helder veld, mCherry: rode fluorescerende filterweergave, enkele effen beelden, schaalbalk A: 5mm, schaalbalk B: 250 μm) Klik hier om een grotere versie van dit cijfer te bekijken.
Net als bij de endogene vitellogenine, wordt de mCherry-verslaggever alleen uitgedrukt in de lever. Omdat vitellogenine alleen wordt geproduceerd in aanwezigheid van oestrogeen, is er geen fluorescerend signaal in de controles. Omdat de uitdrukking alleen in de lever zit, is de evaluatie van de resultaten veel gemakkelijker15.
De gevoeligheid en bruikbaarheid van de embryo’s van deze lijn zijn onderzocht op verschillende oestrogene samengestelde mengsels en ook op milieumonsters15,20, en in de meeste gevallen werden dosisresponsrelaties gedocumenteerd ( figuur2). In het geval van zeer toxische, voornamelijk hepatoxische stoffen (bijvoorbeeld zearalenon) kan echter slechts een zeer zwak fluorescerend signaal zichtbaar zijn in de lever van behandelde embryo’s en kan het veroorzaakte maximale fluorescerende signaal worden bereikt binnen een zeer klein concentratiebereik, waardoor het moeilijk is om dosis-effectrelaties vast te stellen20.
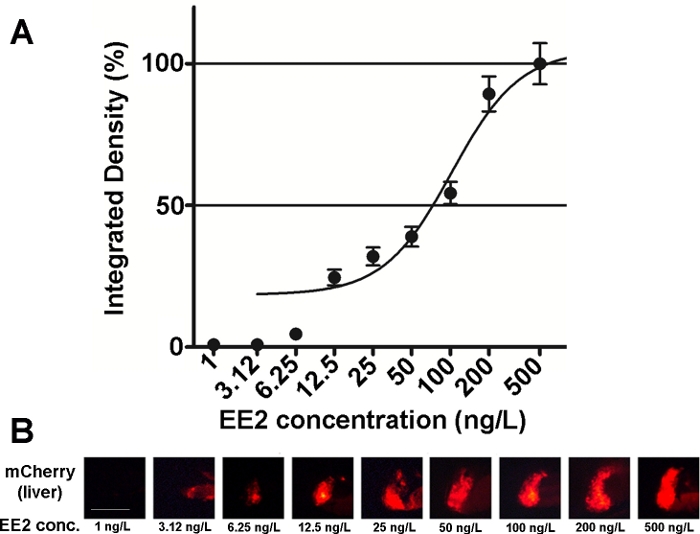
Figuur 2: Dosisresponsdiagram (A) en fluorescerende beelden (mCherry) van de lever (B) blootgesteld aan 17-α-ethynilestradiol (EE2), in 5 dpf vtg1:mCherry larven. De resultaten worden uitgedrukt als geïntegreerde dichtheid gegenereerd uit de signaalsterkte en de grootte van het getroffen gebied (±SEM, n = 60). 100% verwijst naar het waargenomen maximum. Fluorescerende signaalintensiteit nam geleidelijk toe met concentratie. Schaalbalk = 250 μm. Klik hier om een grotere versie van dit cijfer te bekijken.
Er zijn verschillende oestrogene stoffen aanwezig in het milieu, zoals 17-β-estradiol (milieuconcentratie: 0,1–5,1 ng/L)21, 17-α-ethynylestradiol (milieuconcentratie: 0,16–0,2 μg/L L)22, zearalenon (milieuconcentratie: 0,095–0,22 μg/L)23, bisfenol-A (milieuconcentratie: 0,45–17,2 mg/L)24. Bij het testen van deze stoffen in zuiver actieve vorm met behulp van mCherry transgene embryo’s waren de laagste waargenomen effectconcentraties (LOEC) voor fluorescerende tekendetectie 100 ng/L voor 17-ß-estradiol, 1 ng/L voor 17-α-ethynilestradiol, 100 ng/L voor zearalenon en 1 mg/L voor bisfenol-A (96-120 hpf behandeling), die zeer dicht bij of binnen het bereik van milieuconcentraties van de stoffen15ligt. De transgene lijn Tg(vtg1:mCherry) kan helpen bij het detecteren van oestrogeen in afvalwatermonsters na directe blootstelling. De lijn is zo gevoelig als de veelgebruikte gist oestrogeen test, de bioluminiscente gist oestrogeen (BLYES) test15. Met behulp van deze lijn, de beschermende effecten van bèta-cyclodextrins tegen zearalenon-geïnduceerde toxiciteit is bevestigd met behulp van chemische mengsels20.
In een recent rapport werd het in vivo gebruik van de transgene lijn aangetoond met behulp van twee oestrogene zearalenon (ZEA) metabolieten, α- en β-zearalenol (α-ZOL en β-ZOL)25. De baseline van het protocol is geschikt om de oestrogene effecten van verschillende verbindingen of milieumonsters op Tg(vtg1:mCherry) embryo’s te bestuderen.
Protocol
Representative Results
Discussion
Het gebruik van biomonitoren/bio-indicatoren voor oestrogene effecten is verspreid in toxicologische studies. In vivo modellen spelen een uitstekende rol, omdat ze in tegenstelling tot in vitro tests niet alleen informatie geven over de respons van een cel of een receptor, maar ook het onderzoek van complexe processen in het organisme mogelijk maken. Verschillende transgene lijnen voor het bestuderen van oestrogene effecten zijn geproduceerd uit zebravissen, waarvan Tg(vtg1:mCherry) werd gebruikt voor deze studi…
Disclosures
The authors have nothing to disclose.
Acknowledgements
Dit werk werd ondersteund door het National Research, Development and Innovation Office (NKFIH) van het Nationaal Fonds voor Onderzoek, Ontwikkeling en Innovatie (NKFIA); Subsidieovereenkomst: NVKP_16-1-2016-0003, EFOP-3.6.3-VEKOP-16-2017-00008 project medegefinancierd door de Europese Unie, en het thematische excellenceprogramma NKFIH-831-10/2019 van de Szent István University, toegekend door het Ministerie van Innovatie en Technologie.
Materials
| 24 well tissue culture plate | Jet Biofil | TCP011024 | |
| Calcium-chloride (CaCl2) | Reanal Laborvegyszer Ltd. | 16383-0-27-39 | |
| GraphPad Prism 6.01 software | GraphPad Software Inc. | ||
| ImageJ software | National Institutes of Health, USA | Public access software, downloadable from: http://imagej.nih.gov/ | |
| Leica Application Suite X calibrated software | Leica Microsystems GmbH. | We used the softver described in the experiments, but any photographic software complies with the tests | |
| Leica M205 FA stereomicroscope, Leica DFC 7000T camera | Leica Microsystems GmbH. | We used the equipments described in the experiments, but any fluorescent stereomicroscope is suitable for the tests | |
| Magnesium-sulphate (MgSO4) | Reanal Laborvegyszer Ltd. | 20342-0-27-38 | |
| mCherry filter | Leica Microsystems GmbH. | ||
| Mehyl-cellulose | Sigma Aldrich Ltd. | 274429 | |
| Microloader pipette tip | Eppendorf GmbH. | 5242956003 | |
| Pasteur pipette | VWR International LLC. | 612-1684 | |
| Petri-dish | Jet Biofil | TCD000060 | |
| Potassium-chloride (KCl) | Reanal Laborvegyszer Ltd. | 18050-0-01-33 | |
| Sodium-chloride (NaCl) | Reanal Laborvegyszer Ltd. | 24640-0-01-38 | |
| Tricane-methanesulfonate (MS-222) | Sigma Aldrich Ltd. | E10521 |
References
- Sumpter, J. P. Endocrine Disrupters in the Aquatic Environment : An Overview. Acta Hydrochimica et Hydrobiologica. 33 (1), 9-16 (2005).
- Routledge, E. J., Sumpter, J. P. Estrogenic activity of surfactants and some of their degradation products assessed using a recombinant yeast screen. Environmental Toxicology and Chemistry. 15 (3), 241-248 (1996).
- Sanseverino, J., et al. Use of Saccharomyces cerevisiae BLYES Expressing Bacterial Bioluminescence for Rapid, Sensitive Detection of Estrogenic Compounds. Applied and Environmental Microbiology. 71 (8), 4455-4460 (2008).
- Fetter, E., et al. Effect-directed analysis for estrogenic compounds in a fluvial sediment sample using transgenic cyp19a1b-GFP zebrafish embryos. Aquatic Toxicology. 154, 221-229 (2014).
- Gorelick, D. A., Halpern, M. E. Visualization of estrogen receptor transcriptional activation in zebrafish. Endocrinology. 152 (7), 2690-2703 (2011).
- Rider, C. V., Hartig, P. C., Cardon, M. C., Wilson, V. S. Development of a competitive binding assay system with recombinant estrogen receptors from multiple species. Toxicology Letters. 184 (2), 85-89 (2009).
- Gunnarsson, L., Kristiansson, E., Förlin, L., Nerman, O., Larsson, J. Sensitive and robust gene expression changes in fish exposed to estrogen – a microarray approach. BMC Genomics. 8 (149), 1-9 (2007).
- Vander Ven, L. T. M., et al. Vitellogenin expression in zebrafish Danio rerio evaluation by histochemistry, immunohistochemistry, and in situ mRNA hybridisation. Aquatic Toxicology. 65 (1), 1-11 (2003).
- Bakos, K., et al. Developmental toxicity and estrogenic potency of zearalenone in zebrafish (Danio rerio). Aquatic Toxicology. 136-137, 13-21 (2013).
- Strähle, U., et al. Zebrafish embryos as an alternative to animal experiments – A commentary on the definition of the onset of protected life stages in animal welfare regulations. Reproductive Toxicology. 33 (2), 128-132 (2012).
- Tsang, M. Zebrafish : A Tool for Chemical Screens. Birth Defects Research, Part C. 90 (3), 185-192 (2010).
- Hill, A. J., Teraoka, H., Heideman, W., Peterson, R. E. Zebrafish as a model vertebrate for investigating chemical toxicity. Toxicological Sciences. 86 (1), 6-19 (2005).
- Lee, C., Na, J. G., Lee, K., Park, K. Choriogenin mRNA induction in male medaka, Oryzias latipes as a biomarker of endocrine disruption. Aquatic Toxicology. 61 (3-4), 233-241 (2002).
- Chen, H., et al. Generation of a fluorescent transgenic zebrafish for detection of environmental estrogens. Aquatic Toxicology. 96 (1), 53-61 (2010).
- Bakos, K., et al. Estrogen sensitive liver transgenic zebrafish (Danio rerio) line (Tg(vtg1:mCherry)) suitable for the direct detection of estrogenicity in environmental samples. Aquatic Toxicology. 208, 157-167 (2019).
- Abdelmoneim, A., Clark, C., Mukai, M. Fluorescent reporter zebrafish line for estrogenic compound screening generated using a CRISPR/Cas9-mediated knock-in system. Toxicological Sciences. 173 (2), 336-346 (2019).
- Tong, S. K., et al. A cyp19a1b-GFP (aromatase B) transgenic zebrafish line that expresses GFP in radial glial cells. Genesis. 47 (2), 67-73 (2009).
- Segner, H. Zebrafish (Danio rerio) as a model organism for investigating endocrine disruption. Comparative Biochemistry and Physiology, Part C: Toxicology and Pharmacology. 149 (2), 187-195 (2009).
- Klinge, C. M. Estrogen receptor interaction with estrogen response elements. Nucleic Acids Res. 29 (14), 2905-2919 (2001).
- Faisal, Z., et al. Protective effects of beta-cyclodextrins vs. zearalenone-induced toxicity in HeLa cells and Tg(vtg1:mCherry) zebrafish embryos. Chemosphere. 240, 1-11 (2020).
- Kolpin, D. W., et al. Pharmaceuticals, hormones, and other organic wastewater contaminants in U.S. streams, 1999-2000: A national reconnaissance. Environmental Science and Technology. 36 (6), 1202-1211 (2002).
- Kuch, H. M., Ballschmiter, K. Determination of endocrine-disrupting phenolic compounds and estrogens in surface and drinking water by HRGC-(NCI)-MS in the picogram per liter range. Environmental Science and Technology. 35 (15), 3201-3206 (2001).
- Lundgren, M. S., Novak, P. J. Quantification of phytoestrogens in industrial waste streams. Environmental Toxicology and Chemistry. 28 (11), 2318-2323 (2009).
- Masoner, J. R., Kolpin, D. W., Furlong, E. T., Cozzarelli, I. M., Gray, J. L. Landfill leachate as a mirror of today’s disposable society: Pharmaceuticals and other contaminants of emerging concern in final leachate from landfills in the conterminous United States. Environmental Toxicology and Chemistry. 35 (4), 906-918 (2016).
- Panel on Additives and Products or Substances used in Animal Feed (FEEDA). EFSA Statement on the establishment of guidelines for the assessment of additives from the functional group ‘substances for reduction of the contamination of feed by mycotoxins’ 1 EFSA. EFSA Journal. 8 (7), 1-8 (2010).
- Braunbeck, T., et al. Towards an alternative for the acute fish LC(50) test in chemical assessment: the fish embryo toxicity test goes multi-species – an update. Altex. 22 (50), 87-102 (2005).
- Schneider, C. A., Rasband, W. S., Eliceiri, K. W. NIH Image to ImageJ: 25 years of image analysis. Nature Methods. 9 (7), 671-675 (2012).
- Ober, E. A., Field, H. A., Stainier, D. Y. R. From endoderm formation to liver and pancreas development in zebrafish. Mechanisms of Development. 120 (1), 5-18 (2003).
- Tao, T., Peng, J. Liver development in zebrafish (Danio rerio). Journal of Genetics and Genomics. 36 (6), 325-334 (2009).
- Shier, W. T., Shier, A. C., Xie, W., Mirocha, C. J. Structure-activity relationships for human estrogenic activity in zearalenone mycotoxins. Toxicon. 39 (9), 1435-1438 (2001).
- Panel, E., Chain, F. Appropriateness to set a group health-based guidance value for zearalenone and its modified forms EFSA Panel on Contaminants in the Food Chain (CONTAM). EFSA Journal. 14, 4425 (2016).
- Binder, E. M. Managing the risk of mycotoxins in modern feed production. Animal Feed Science and Technology. 133 (1-2), 149-166 (2007).
- Risa, A., Krifaton, C., Kukolya, J., Kriszt, B., Cserháti, M., Táncsics, A. Aflatoxin B1 and Zearalenone-Detoxifying Profile of Rhodococcus Type Strains. Current Microbiology. 75 (7), 907-917 (2018).

