שימוש Tg (Vtg1: mcherry) עוברי דג Zebrafish כדי לבדוק את ההשפעות אסטרוגניים של תרכובות משבשי האנדוקרינית
Summary
הנוכחי הוא פרוטוקול מפורט עבור השימוש של עוברי הדגים Tg (vtg1: mCherry) לאיתור אפקטים אסטרוגניים. הפרוטוקול מכסה את התפשטות הדג והטיפול של עוברים, ומדגיש את האיתור, תיעוד, והערכה של אותות פלורסנט הנגרמת על ידי תרכובות משבשים האנדוקרינית (EDC).
Abstract
יש הרבה תרכובות הפרעה אנדוקרינית (EDC) בסביבה, במיוחד החומרים אסטרוגניים. הגילוי של חומרים אלה קשה בשל הגיוון הכימי שלהם; לכן, יותר ויותר השפעה-זיהוי שיטות משמשות, כגון האסטרוגניים רגיש ביואוטור/אורגניזמים bioindicator. האורגניזמים הללו כוללים מספר דגמי דגים. פרוטוקול זה מכסה את השימוש של הצינור הטרנסגניים Tg (vtg1: mCherry) בתור אורגניזם ביוטרי, כולל הפצת הדגים והטיפול בעוברים, עם דגש על איתור, תיעוד, והערכה של אותות פלורסנט הנגרמת על ידי edc. מטרת העבודה היא הדגמה של השימוש בעוברים קו Tg (vtg1: mCherry) כדי לזהות אפקטים אסטרוגניים. העבודה הזאת מתעד את השימוש בעוברים הטרנסגניים (vtg1: mCherry) לאיתור אפקטים אסטרוגניים על ידי בדיקת שני חומרים אסטרוגניים, α-ו β-zearאלנבי. הפרוטוקול המתואר הוא רק בסיס לעיצוב מוסר; שיטת הבדיקה יכולה להיות מגוונת בהתאם לנקודות הקצה של הבדיקה ולדגימות. כמו-כן, ניתן לשלב אותה בשיטות שיטה אחרות, ובכך להקל על השימוש העתידי בקווים הטרנסגניים.
Introduction
יש מספר משמעותי של תרכובות משבשי אנדוקריניות (EDC) הינם בין החומרים המסוכנים ביותר בסביבה שלנו. אלו תרכובות אסטרוגניים בעיקר לזהם מים ממשאבי הטבע. המגוון הכימי של החומרים השייכים לקבוצה גורם בדיקה לנוכחותם קשה, כמו שיטות אנליטיות שונות נדרשות לגילוי שלהם. מבוסס על המבנה הכימי שלהם קשה מאוד לקבוע אם החומר הוא בעצם מסוגל לפעול כמו אסטרוגן. בנוסף, חומרים אלה אינם נוכחים אף פעם בצורה טהורה בסביבה, כך שההשפעות שלהם עשויות להיות מושפעות מתרכובות אחרות,1מדי. בעיה זו ניתן לפתור על ידי אפקט-זיהוי שיטות, כגון השימוש של ביואוטור/bioindicator אורגניזמים הרואים אפקטים אסטרוגניים2,3,4,5.
לאחרונה, מגוון של קו תא6 ו שמרים מבוססי מערכות מבחן2,3 פותחו כדי לזהות אפקטים אסטרוגניים. עם זאת, אלה הם בדרך כלל רק מסוגלים לזהות את הכריכה של החומר לקולטן אסטרוגן2,3. בנוסף, הם אינם יכולים לדגמן תהליכים פיזיולוגיים מורכבים באורגניזם, או כדי לזהות שלבים רגישים להורמונים של שלבי החיים; לפיכך, הם מובילים לעתים קרובות לתוצאות כוזבות.
ידוע כי גנים מסוימים להגיב ברגישות לאסטרוגן חיים אורגניזמים7. זיהוי של מוצרי הגן על ידי שיטות ביולוגיה מולקולרית אפשרי גם על חלבון או mrna רמה8,9, אבל בדרך כלל כרוך הקרבת בעלי חיים. חוקי הגנת בעלי חיים הפכו להיות חמורים יותר, ויש ביקוש הולך וגובר למערכות בדיקה חלופיות הממזער את מספר והסבל של בעלי חיים המשמשים בניסויים או בהחלפת המודל החי עם מערכת מודל אחרת10. עם גילוי של חלבונים פלורסנט ויצירת קווי סמנים, הטכנולוגיות הטרנסגניים לספק חלופה טובה11. עם הקווים האלה, ההפעלה של הגן רגיש לאסטרוגן ניתן לבחון ב vivo.
בין החוליות, הפוטנציאל של דגים בהערכת הסיכון הסביבתי הוא יוצא מן ההכלל. הם מציעים יתרונות רבים על פני דגמי היונקים: להיות אורגניזמים מימיים, הם מסוגלים לקלוט מזהמים בכל גופם, לייצר מספר רב של צאצאים, וחלק מהמין שלהם מאופיין בזמן הדור הקצר. המערכת האנדוקרינית והתהליכים הפיזיולוגיים שלהם מראים דמיון רב עם בעלי חוליות אחרים ואפילו עם יונקים, כולל בני אדם12.
כמה גנים לגילוי של תופעות אסטרוגניים דגים ידועים גם. החשובים ביותר הם קולטני אסטרוגן ארומטאז-b, כוראוגנב-H, ו vitellogenin (vtg)7,13. לאחרונה, מספר שורות אסטרוגן המייצרים ביוסנסור יש גם נוצר מדגמי דגים המשמשים במעבדה, כגון מן דג זברה (danio rerio)4,5,14,15,16,17. היתרון העיקרי של דג דג זברה ביצירת קווי ביוסנסור הוא הגוף השקוף של העוברים והזחלים, כי אות הכתב הפלורסנט יכול להיות בקלות למדו בvivo מבלי להקריב את החיה10. בנוסף להגנה על בעלי חיים, היא גם תכונה רבת ערך כפי שהיא מאפשרת ללמוד את התגובה של אותו אדם בתקופות שונות של הטיפול18.
הניסויים האלה משתמשים. בכתב מהונדס לכתבת קו15 המבנה הטרנסגנטי המשמש לפיתוח של Tg (vtg1: mCherry) יש ארוך (3.4 kbp) מקדם טבעי vitellogenin-1. קולטן אסטרוגן (ER) הוא חלבון משפר מופעל על ידי ליגנדס כי הוא נציג של סטרואידים/משפחה קולטן גרעינית. ER נקשר רצפי DNA ספציפיים הנקראים אלמנטים אסטרוגן תגובה (סרס) עם זיקה גבוהה וביטוי גנטי transactivates פעיל בתגובה אסטרדיול וחומרים אסטרוגניים אחרים, כך הרבה יותר ב-היזם גורם תגובה חזקה יותר19. ישנם 17 אתרי ERE באזור המקדם של המבנה הטרנזגני Tg (vtg1: mCherry) והם צפויים לחקות את הביטוי של ה-vtg הגן היליד15. יש ביטוי מתמשך של אות פלורסנט בנשים מובחלות מינית. עם זאת, אצל זכרים והעובר הביטוי בכבד ניתן לראות רק על הטיפול בחומרים אסטרוגניים (איור 1).
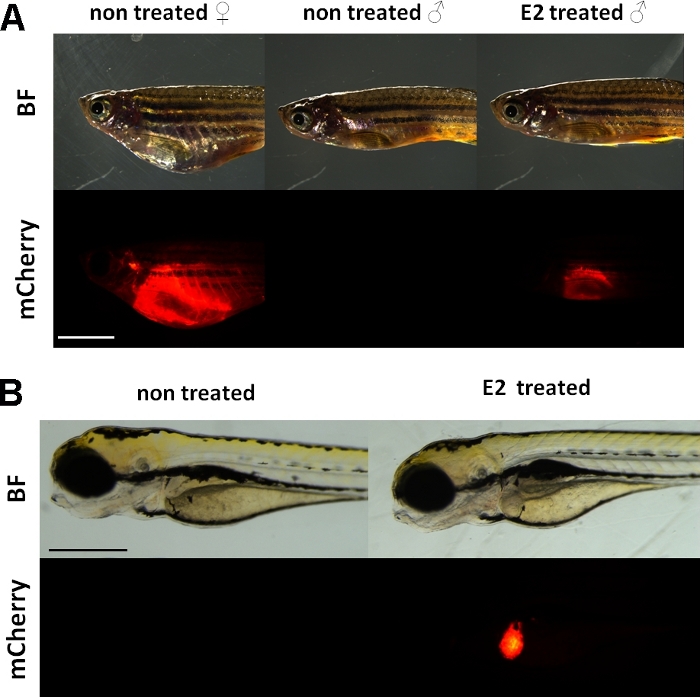
איור 1: אות פלורסנט אדום בכבד של vtg1: mCherry הטרנסגניים בוגרים ו 5 העוברים dpf, בעקבות 17-אני-estradiol (E2) אינדוקציה. אצל נקבה ואצל גבר שטופלו E2 (25 μg/L חשיפה זמן: 48 שעות) זריחה חזקה של הכבד הוא גלוי אפילו דרך העור פיגמנט. אין אות פלורסנט נראה בלתי מטופל זכר (א). בעקבות E2 אינדוקציה (50 μg/L חשיפה זמן: 0-120 hpf), אות פלורסנט אדום בכבד של 5 עוברים dpf יכול להיות גם נצפתה, אשר אינו גלוי בעוברי שליטה (ב). בעוד האות פלורסנט הוא ברציפות להציג נשים למבוגרים, בעיקר זכרים ועוברים של הקו מתאימים לגילוי אפקטים אסטרוגניים. (BF: שדה בהיר, mCherry: תצוגת פלורסנט אדום התצוגה, תמונות רגיל יחיד, סרגל קנה מידה A: 5mm, סרגל בקנה מידה B: 250 μm) אנא לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.
העיתונאי מטעם הדובדבן. מתבטא רק בכבד בגלל vitellogenin מיוצר רק בנוכחות של אסטרוגן, אין אות פלורסנט בפקדים. בגלל הביטוי הוא רק בכבד, הערכת התוצאות היא הרבה יותר קל15.
הרגישות והשימושיות של העוברים קו זה נחקרו על תערובות מורכבות אסטרוגניים שונים גם על דגימות סביבתיות15,20, וברוב המקרים יחסים במינון-תגובה תועדו (איור 2). עם זאת, במקרה של רעיל מאוד, בעיקר hepatotoxic, חומרים (למשל, zearאלנבי), רק אות ניאון חלשה מאוד עשוי להיות גלוי בכבד של עוברים מטופלים ואת האות פלורסנט בעוצמה מקסימלית שנגרמו ניתן להגיע בתוך טווח ריכוז קטן מאוד, מה שמקשה להקים מינון-אפקט יחסים20.
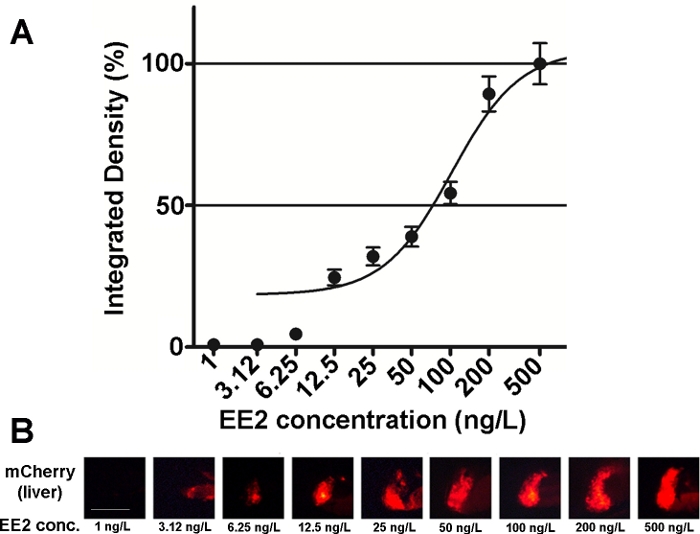
איור 2: דיאגרמת מינון-תגובה (A) ותמונות פלורסנט (mCherry) של הכבד (ב) חשוף ל -17-α-ethynilestradiol (EE2), ב 5 dpf vtg1: הזחלים של שרי. התוצאות מבוטאות כדחיסות משולבת שנוצרת מעוצמת האות ומגודל האזור המושפע (± SEM, n = 60). 100% מתייחס למקסימום שנצפה. עוצמת אות פלורסנט גדלה בהדרגה עם ריכוז. סרגל בקנה מידה = 250 μm. נא לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.
ישנם כמה חומרים אסטרוגניים הנמצאים בסביבה, כגון 17-β-estradiol (ריכוז סביבתי: 0.1 – 5.1 ng/L)21, 17-α-אתנוליסטרנול (ריכוז סביבתי: 0.16 – 0.2/l)22, zearאלנבי (ריכוז סביבתי: 0.095 – 0.22 μg/l)23, ביספינול-A (ריכוז סביבתי: 0.45 – 17.2 mg/l)24. בעת בדיקת חומרים אלה בטופס פעיל טהור בעזרת עוברי הטרנסגניים mCherry, ריכוזי האפקט הנצפה הנמוך ביותר (LOEC) עבור זיהוי הסימנים פלורסנט היו 100 ng/L עבור 17-אני-estradiol, 1 ng/L עבור 17-α-ethynol, 100 ng/L עבור zearalenone, ו 1 מ”ג/L עבור ביייננול-A (96 – 120 hpf טיפול), אשר קרוב מאוד או בתוך מגוון של ריכוזי הסביבה של החומרים15. הקו הטרנסגניים Tg (vtg1: mCherry) יכול לסייע בזיהוי אסטרוגניות בדגימות שפכים לאחר חשיפה ישירה. הקו רגיש כמו בדיקת אסטרוגן שמרים נפוץ, מבחן אסטרוגן שמרים (BLYES) בחינה15. בעזרת קו זה, השפעות ההגנה של ביתא-ציקלודטרינים נגד רעילות הנגרמת על-ידי כימיקלים אושרה באמצעות תערובות כימיות20.
בדו ח האחרונות, השימוש vivo של הקו הטרנסגניים הוכח בעזרתו של שני אסטרוגניים zearאלנבי (ZEA) מטבוליטים, α-ו β-zearאלנבי (α-ZOL ו β-ZOL)25. בסיס הפרוטוקול מתאים ללמוד את ההשפעות אסטרוגניים של מספר תרכובות או דגימות סביבתיות על Tg (vtg1: mCherry) עוברים.
Protocol
Representative Results
Discussion
השימוש biomonitors/bioindicators לתופעות אסטרוגניים התפשט במחקרים הרעילות. במודלים vivo לשחק תפקיד מצטיין, כי בניגוד בדיקות חוץ גופית, הם לא רק לספק מידע על התגובה של תא או קולטן, אלא גם לאפשר את החקירה של תהליכים מורכבים באורגניזם. מספר קווים טרנסגניים לחקר השפעות אסטרוגניים הופקו מ-zebrafish, אחד מהם Tg (vt…
Disclosures
The authors have nothing to disclose.
Acknowledgements
עבודה זו נתמכת על ידי המשרד הלאומי למחקר, פיתוח וחדשנות (NKFIH) מקרן המחקר, הפיתוח והחדשנות של המדינה (NKFIA); הסכם גרנט: NVKP_16-1-2016-0003, EFOP-3.6.3-וקופ-16-2017-00008 פרויקט ממומן על ידי האיחוד האירופי, ואת תוכנית מצוינות נושאית NKFIH-831-10/2019 של אוניברסיטת Szent István, הוענק על ידי המשרד לחדשנות וטכנולוגיה.
Materials
| 24 well tissue culture plate | Jet Biofil | TCP011024 | |
| Calcium-chloride (CaCl2) | Reanal Laborvegyszer Ltd. | 16383-0-27-39 | |
| GraphPad Prism 6.01 software | GraphPad Software Inc. | ||
| ImageJ software | National Institutes of Health, USA | Public access software, downloadable from: http://imagej.nih.gov/ | |
| Leica Application Suite X calibrated software | Leica Microsystems GmbH. | We used the softver described in the experiments, but any photographic software complies with the tests | |
| Leica M205 FA stereomicroscope, Leica DFC 7000T camera | Leica Microsystems GmbH. | We used the equipments described in the experiments, but any fluorescent stereomicroscope is suitable for the tests | |
| Magnesium-sulphate (MgSO4) | Reanal Laborvegyszer Ltd. | 20342-0-27-38 | |
| mCherry filter | Leica Microsystems GmbH. | ||
| Mehyl-cellulose | Sigma Aldrich Ltd. | 274429 | |
| Microloader pipette tip | Eppendorf GmbH. | 5242956003 | |
| Pasteur pipette | VWR International LLC. | 612-1684 | |
| Petri-dish | Jet Biofil | TCD000060 | |
| Potassium-chloride (KCl) | Reanal Laborvegyszer Ltd. | 18050-0-01-33 | |
| Sodium-chloride (NaCl) | Reanal Laborvegyszer Ltd. | 24640-0-01-38 | |
| Tricane-methanesulfonate (MS-222) | Sigma Aldrich Ltd. | E10521 |
References
- Sumpter, J. P. Endocrine Disrupters in the Aquatic Environment : An Overview. Acta Hydrochimica et Hydrobiologica. 33 (1), 9-16 (2005).
- Routledge, E. J., Sumpter, J. P. Estrogenic activity of surfactants and some of their degradation products assessed using a recombinant yeast screen. Environmental Toxicology and Chemistry. 15 (3), 241-248 (1996).
- Sanseverino, J., et al. Use of Saccharomyces cerevisiae BLYES Expressing Bacterial Bioluminescence for Rapid, Sensitive Detection of Estrogenic Compounds. Applied and Environmental Microbiology. 71 (8), 4455-4460 (2008).
- Fetter, E., et al. Effect-directed analysis for estrogenic compounds in a fluvial sediment sample using transgenic cyp19a1b-GFP zebrafish embryos. Aquatic Toxicology. 154, 221-229 (2014).
- Gorelick, D. A., Halpern, M. E. Visualization of estrogen receptor transcriptional activation in zebrafish. Endocrinology. 152 (7), 2690-2703 (2011).
- Rider, C. V., Hartig, P. C., Cardon, M. C., Wilson, V. S. Development of a competitive binding assay system with recombinant estrogen receptors from multiple species. Toxicology Letters. 184 (2), 85-89 (2009).
- Gunnarsson, L., Kristiansson, E., Förlin, L., Nerman, O., Larsson, J. Sensitive and robust gene expression changes in fish exposed to estrogen – a microarray approach. BMC Genomics. 8 (149), 1-9 (2007).
- Vander Ven, L. T. M., et al. Vitellogenin expression in zebrafish Danio rerio evaluation by histochemistry, immunohistochemistry, and in situ mRNA hybridisation. Aquatic Toxicology. 65 (1), 1-11 (2003).
- Bakos, K., et al. Developmental toxicity and estrogenic potency of zearalenone in zebrafish (Danio rerio). Aquatic Toxicology. 136-137, 13-21 (2013).
- Strähle, U., et al. Zebrafish embryos as an alternative to animal experiments – A commentary on the definition of the onset of protected life stages in animal welfare regulations. Reproductive Toxicology. 33 (2), 128-132 (2012).
- Tsang, M. Zebrafish : A Tool for Chemical Screens. Birth Defects Research, Part C. 90 (3), 185-192 (2010).
- Hill, A. J., Teraoka, H., Heideman, W., Peterson, R. E. Zebrafish as a model vertebrate for investigating chemical toxicity. Toxicological Sciences. 86 (1), 6-19 (2005).
- Lee, C., Na, J. G., Lee, K., Park, K. Choriogenin mRNA induction in male medaka, Oryzias latipes as a biomarker of endocrine disruption. Aquatic Toxicology. 61 (3-4), 233-241 (2002).
- Chen, H., et al. Generation of a fluorescent transgenic zebrafish for detection of environmental estrogens. Aquatic Toxicology. 96 (1), 53-61 (2010).
- Bakos, K., et al. Estrogen sensitive liver transgenic zebrafish (Danio rerio) line (Tg(vtg1:mCherry)) suitable for the direct detection of estrogenicity in environmental samples. Aquatic Toxicology. 208, 157-167 (2019).
- Abdelmoneim, A., Clark, C., Mukai, M. Fluorescent reporter zebrafish line for estrogenic compound screening generated using a CRISPR/Cas9-mediated knock-in system. Toxicological Sciences. 173 (2), 336-346 (2019).
- Tong, S. K., et al. A cyp19a1b-GFP (aromatase B) transgenic zebrafish line that expresses GFP in radial glial cells. Genesis. 47 (2), 67-73 (2009).
- Segner, H. Zebrafish (Danio rerio) as a model organism for investigating endocrine disruption. Comparative Biochemistry and Physiology, Part C: Toxicology and Pharmacology. 149 (2), 187-195 (2009).
- Klinge, C. M. Estrogen receptor interaction with estrogen response elements. Nucleic Acids Res. 29 (14), 2905-2919 (2001).
- Faisal, Z., et al. Protective effects of beta-cyclodextrins vs. zearalenone-induced toxicity in HeLa cells and Tg(vtg1:mCherry) zebrafish embryos. Chemosphere. 240, 1-11 (2020).
- Kolpin, D. W., et al. Pharmaceuticals, hormones, and other organic wastewater contaminants in U.S. streams, 1999-2000: A national reconnaissance. Environmental Science and Technology. 36 (6), 1202-1211 (2002).
- Kuch, H. M., Ballschmiter, K. Determination of endocrine-disrupting phenolic compounds and estrogens in surface and drinking water by HRGC-(NCI)-MS in the picogram per liter range. Environmental Science and Technology. 35 (15), 3201-3206 (2001).
- Lundgren, M. S., Novak, P. J. Quantification of phytoestrogens in industrial waste streams. Environmental Toxicology and Chemistry. 28 (11), 2318-2323 (2009).
- Masoner, J. R., Kolpin, D. W., Furlong, E. T., Cozzarelli, I. M., Gray, J. L. Landfill leachate as a mirror of today’s disposable society: Pharmaceuticals and other contaminants of emerging concern in final leachate from landfills in the conterminous United States. Environmental Toxicology and Chemistry. 35 (4), 906-918 (2016).
- Panel on Additives and Products or Substances used in Animal Feed (FEEDA). EFSA Statement on the establishment of guidelines for the assessment of additives from the functional group ‘substances for reduction of the contamination of feed by mycotoxins’ 1 EFSA. EFSA Journal. 8 (7), 1-8 (2010).
- Braunbeck, T., et al. Towards an alternative for the acute fish LC(50) test in chemical assessment: the fish embryo toxicity test goes multi-species – an update. Altex. 22 (50), 87-102 (2005).
- Schneider, C. A., Rasband, W. S., Eliceiri, K. W. NIH Image to ImageJ: 25 years of image analysis. Nature Methods. 9 (7), 671-675 (2012).
- Ober, E. A., Field, H. A., Stainier, D. Y. R. From endoderm formation to liver and pancreas development in zebrafish. Mechanisms of Development. 120 (1), 5-18 (2003).
- Tao, T., Peng, J. Liver development in zebrafish (Danio rerio). Journal of Genetics and Genomics. 36 (6), 325-334 (2009).
- Shier, W. T., Shier, A. C., Xie, W., Mirocha, C. J. Structure-activity relationships for human estrogenic activity in zearalenone mycotoxins. Toxicon. 39 (9), 1435-1438 (2001).
- Panel, E., Chain, F. Appropriateness to set a group health-based guidance value for zearalenone and its modified forms EFSA Panel on Contaminants in the Food Chain (CONTAM). EFSA Journal. 14, 4425 (2016).
- Binder, E. M. Managing the risk of mycotoxins in modern feed production. Animal Feed Science and Technology. 133 (1-2), 149-166 (2007).
- Risa, A., Krifaton, C., Kukolya, J., Kriszt, B., Cserháti, M., Táncsics, A. Aflatoxin B1 and Zearalenone-Detoxifying Profile of Rhodococcus Type Strains. Current Microbiology. 75 (7), 907-917 (2018).

