Använda Tg (Vtg1:mcherry) Zebrafish embryon för att testa de östrogena effekterna av endokrin hormonstörande föreningar
Summary
Närvarande här är ett detaljerat protokoll för användning av zebrafisk embryon Tg(vtg1: mCherry) för påvisande av östrogena effekter. Protokollet omfattar förökning av fisk och behandling av embryon, och betonar detektion, dokumentation och utvärdering av fluorescerande signaler som orsakas av hormonstörande föreningar (EDC).
Abstract
Det finns många hormonstörande föreningar (EDC) i miljön, särskilt östrogena ämnen. Detektion av dessa ämnen är svårt på grund av deras kemiska mångfald. Därför används allt mer effekt-upptäcka metoder, såsom östrogena effekt-känsliga biomonitor/bioindicator organismer. Dessa biomonitoring organismer inkluderar flera fiskmodeller. Detta protokoll omfattar användning av transgen linje zebrafisk Tg(vtg1: mCherry) som en bioövervakningsorganism, inklusive förökning av fisk och behandling av embryon, med tonvikt på detektion, dokumentation och utvärdering av fluorescerande signaler som induceras av EDC. Målet med arbetet är demonstration av användningen av Tg (vtg1: mCherry) transgena linje embryon för att upptäcka östrogena effekter. Detta arbete dokument användningen av transgena zebrafisk embryon Tg(vtg1: mCherry) för upptäckt av östrogena effekter genom att testa två östrogena ämnen, α- och β-zearalenol. Det beskrivna protokollet är endast en grund för att utforma analyser. Testmetoden kan varieras beroende på testslutpunkterna och proverna. Dessutom kan det kombineras med andra analysmetoder, vilket underlättar den framtida användningen av den transgena linjen.
Introduction
Det finns ett betydande antal hormonstörande föreningar (EDC) som är bland de farligaste ämnena i vår miljö. Dessa är främst östrogena föreningar som förorenar vatten från naturresurser. Den kemiska mångfalden av de ämnen som tillhör gruppen gör det svårt att testa deras närvaro, eftersom det krävs olika analysmetoder för att de ska kunna upptäckas. Baserat på deras kemiska struktur är det mycket svårt att avgöra om ett ämne faktiskt kan fungera som ett östrogen. Dessutom förekommer dessa ämnen aldrig i ren form i miljön, så deras effekter kan påverkas av andra föreningar, för1. Detta problem kan lösas genom effekt-upptäcka metoder, såsom användning av biomonitor/ bioindicator organismer som visar östrogena effekter2,3,4,5.
Nyligen, en mängd celllinje6 och jäst-baserade testsystem2,3 har utvecklats för att upptäcka östrogena effekter. Emellertid, dessa är i allmänhet endast kunna upptäcka bindning av ämnet till östrogenreceptorn2,3. Dessutom kan de inte modellera komplexa fysiologiska processer i organismen, eller att upptäcka hormonkänsliga faser av livsstadier; därför leder de ofta till falska resultat.
Det är känt att vissa gener reagerar känsligt på östrogen i levande organismer7. Detektion av genprodukter genom molekylärbiologiska metoder är också möjligt på protein- eller mRNA-nivå8,9, men innebär vanligtvis djuroffer. Djurskyddslagar har blivit strängare, och det finns en växande efterfrågan på alternativa testsystem som minimerar antalet och lidandet hos djur som används i experiment eller ersätter djurmodellen med ett annat modellsystem10. Med upptäckten av fluorescerande proteiner och skapandet av biomarkörlinjer ger transgen teknik ett bra alternativ11. Med dessa linjer, aktivering av en östrogen-känslig gen kan testas in vivo.
Bland ryggradsdjur är fiskens potential i miljöriskbedömningen enastående. De erbjuder många fördelar jämfört med däggdjursmodeller: att vara vattenlevande organismer, de kan absorbera föroreningar genom hela kroppen, producera ett stort antal avkommor, och några av deras arter kännetecknas av kort generationstid. Deras endokrina system och fysiologiska processer visar stora likheter med andra ryggradsdjur och även med däggdjur, inklusive människor12.
Flera gener för att upptäcka östrogena effekter hos fisk är också kända. De viktigaste är östrogenreceptorerna aromatas-b, choriogenin-H och vitellogenin (vtg)7,13. Nyligen har flera östrogenproducerande biosensorlinjer också skapats från fiskmodeller som används i laboratoriet, till exempel från zebrafiskar (Danio rerio)4,5,14,15,16,17. Den största fördelen med zebrafiskar i att skapa biosensor linjer är den genomskinliga kroppen av embryon och larver, eftersom fluorescerande reporter signal kan sedan lätt studeras in vivo utan att offra djuret10. Förutom djurskydd är det också en värdefull funktion eftersom det gör det möjligt att studera reaktionen hos samma individ vid olika tidpunkter av behandlingen18.
Dessa experiment använder en vitellogenin reporter transgena zebrafisk linje15. Transgenen konstruktion som används för utveckling av Tg (vtg1:mCherry) har en lång (3,4 kbp) naturlig vitellogenin-1 promotor. Östrogenreceptorn (ER) är ett förstärkare protein som aktiveras av ligander som är en representant för steroid/nukleära receptorn superfamilj. ER binder till specifika DNA-sekvenser som kallas östrogen svarselement (EREs) med hög affinitet och transaktiverar genuttryck som svar på östradiol och andra östrogena ämnen, så ju mer ERE i promotorn orsakar ett starkare svar19. Det finns 17 ERE platser i promotorn regionen Tg (vtg1:mCherry) transgen konstruktion och de förväntas efterlikna uttrycket av den infödda vtggenen 15. Det finns ett kontinuerligt uttryck för fluorescerande signal hos sexuellt mognade kvinnor. Hos män och embryon syns dock uttrycket i levern endast vid behandling med östrogena ämnen (figur 1).
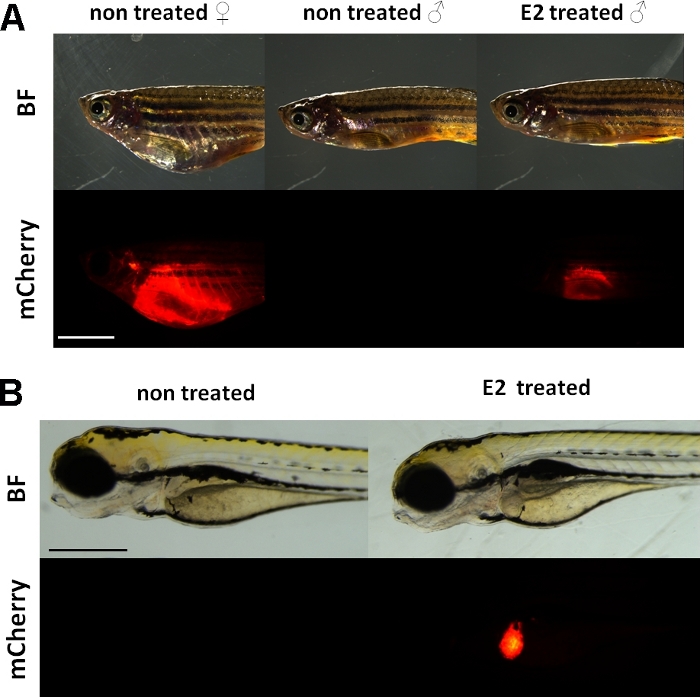
Figur 1: Röd fluorescerande signal i levern av vtg1:mRenasgen vuxen zebrafisk och 5 dpf embryon, efter 17-ß-estradiol (E2) induktion. Hos hona och hos hanar som behandlats med E2 (25 μg/L exponeringstid:48 timmar) syns stark fluorescens i levern även genom den pigmenterade huden. Ingen lysrörssignal syns hos obehandlad hane (A). Efter E2 induktion (50 μg/L exponeringstid: 0-120 hpf) kan en röd fluorescerande signal i levern på 5 dpf-embryon också observeras, vilket inte syns i kontrollembryon (B). Medan fluorescerande signal är kontinuerligt närvarande hos vuxna kvinnor, främst män och embryon i linjen är lämpliga för att upptäcka östrogena effekter. (BF: ljust fält, mCherry: röd lysrörsfiltervy, enkla vanliga bilder, Skalfält A: 5mm, skalstång B: 250 μm) Klicka här för att se en större version av denna siffra.
I likhet med den endogena vitellogenin uttrycks mCherry-reportern endast i levern. Eftersom vitellogenin endast produceras i närvaro av östrogen, det finns ingen fluorescerande signal i kontrollerna. Eftersom uttrycket är bara i levern, utvärderingen av resultaten är mycket lättare15.
Känsligheten och användbarheten hos denna linjes embryon har undersökts på olika östrogena föreningsblandningar och även på miljöprover15,,20,och i de flesta fall dokumenterades dos-responsförhållanden (figur 2). När det gäller mycket giftiga, huvudsakligen hepatotoxiska, ämnen (t.ex. iver) får dock endast en mycket svag lysrörssignal vara synlig i levern hos behandlade embryon och den maximala lysrörssignal som orsakas kan uppnås inom ett mycket litet koncentrationsområde, vilket gör det svårt att fastställa doseffektförhållanden20.
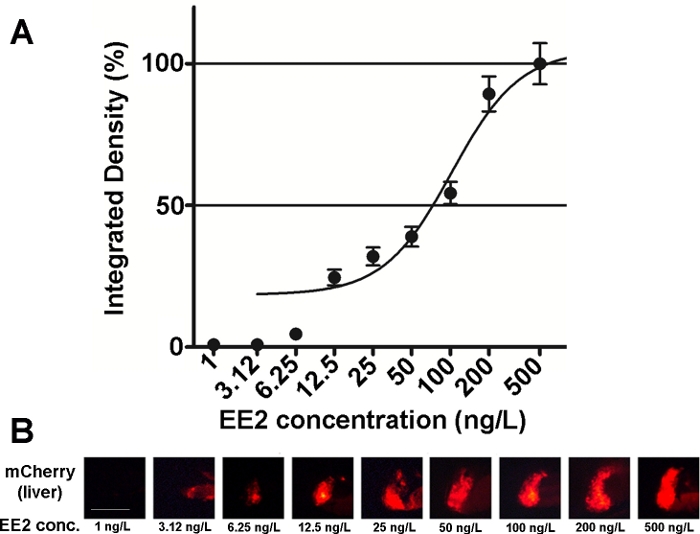
Figur 2: Dosresponsdiagram (A) och fluorescerande bilder (mCherry) i levern (B) som utsätts för 17-α-ethynilestradiol (EE2), i 5 dpf vtg1:mCherry larver. Resultaten uttrycks som integrerad densitet som genereras från signalstyrkan och storleken på det drabbade området (±SEM, n = 60). 100% avser det observerade maximivärdet. Fluorescerande signalintensitet ökade gradvis med koncentration. Skala bar = 250 μm. Klicka här för att se en större version av denna siffra.
Det finns flera östrogena ämnen som finns i miljön, såsom 17–β-estradiol (miljökoncentration: 0,1–5,1 ng/L)21,17–α-etynylestradiol (miljökoncentration: 0,16–0,2 μg/L)22, iveradon (miljökoncentration: 0,095–0,22 μg/L)23, bisfenol-A (miljökoncentration: 0,45–17,2 mg/L)24. Vid testning av dessa ämnen i ren aktiv form med hjälp av mCherry-transgena embryon var de lägsta koncentrationerna av observerade effekter (LOEC) för fluorescerande teckendetektering 100 ng/L för 17-ß-estradiol. 1 ng/L för 17-α-ethynilestradiol, 100 ng/L för iardon och 1 mg/L för bisfenol-A (behandling med 96–120 hpf), som ligger mycket nära eller inom intervallet för miljökoncentrationerna av ämnena15. Den Tg (vtg1:mCherry) transgen linje kan hjälpa till att upptäcka östrogenitet i avloppsvatten prover efter direkt exponering. Linjen är lika känslig som den vanliga jäst östrogen test, den bioluminiscent jäst östrogen (BLYES) analys15. Med hjälp av denna linje har de skyddande effekterna av beta-cyklodextriner mot iaralenoninducerad toxicitet bekräftats med hjälp av kemiska blandningar20.
I en färsk rapport demonstrerades in vivo-användningen av den transgena linjen med hjälp av två östrogena zearalenon (ZEA) metaboliter, α- och β-zearalenol (α-ZOL och β-ZOL)25. Protokollet baslinjen är lämplig att studera de östrogena effekterna av flera föreningar eller miljöprover på Tg (vtg1:mCherry) embryon.
Protocol
Representative Results
Discussion
Användningen av biomonitorer/bioindikatorer för östrogena effekter har spridit sig i toxikologiska studier. In vivo-modeller spelar en enastående roll, eftersom de till skillnad från in vitro-tester inte bara ger information om svaret från en cell eller en receptor, utan också möjliggör undersökning av komplexa processer i organismen. Flera transgena linjer för att studera östrogena effekter har framställts från zebrafisk, varav en Tg(vtg1:mCherry) användes för dessa studier. Den metod som beskri…
Disclosures
The authors have nothing to disclose.
Acknowledgements
Detta arbete stöddes av National Research, Development and Innovation Office (NKFIH) från National Research, Development and Innovation Fund (NKFIA); Bidragsavtal: projektet NVKP_16-1-2016-0003, EFOP-3.6.3-VEKOP-16-2017-00008 som medfinansieras av Europeiska unionen och det tematiska excellence-programmet NKFIH-831-10/2019 vid Szent István University, som delas ut av ministeriet för teknik för innovation och innovation.
Materials
| 24 well tissue culture plate | Jet Biofil | TCP011024 | |
| Calcium-chloride (CaCl2) | Reanal Laborvegyszer Ltd. | 16383-0-27-39 | |
| GraphPad Prism 6.01 software | GraphPad Software Inc. | ||
| ImageJ software | National Institutes of Health, USA | Public access software, downloadable from: http://imagej.nih.gov/ | |
| Leica Application Suite X calibrated software | Leica Microsystems GmbH. | We used the softver described in the experiments, but any photographic software complies with the tests | |
| Leica M205 FA stereomicroscope, Leica DFC 7000T camera | Leica Microsystems GmbH. | We used the equipments described in the experiments, but any fluorescent stereomicroscope is suitable for the tests | |
| Magnesium-sulphate (MgSO4) | Reanal Laborvegyszer Ltd. | 20342-0-27-38 | |
| mCherry filter | Leica Microsystems GmbH. | ||
| Mehyl-cellulose | Sigma Aldrich Ltd. | 274429 | |
| Microloader pipette tip | Eppendorf GmbH. | 5242956003 | |
| Pasteur pipette | VWR International LLC. | 612-1684 | |
| Petri-dish | Jet Biofil | TCD000060 | |
| Potassium-chloride (KCl) | Reanal Laborvegyszer Ltd. | 18050-0-01-33 | |
| Sodium-chloride (NaCl) | Reanal Laborvegyszer Ltd. | 24640-0-01-38 | |
| Tricane-methanesulfonate (MS-222) | Sigma Aldrich Ltd. | E10521 |
References
- Sumpter, J. P. Endocrine Disrupters in the Aquatic Environment : An Overview. Acta Hydrochimica et Hydrobiologica. 33 (1), 9-16 (2005).
- Routledge, E. J., Sumpter, J. P. Estrogenic activity of surfactants and some of their degradation products assessed using a recombinant yeast screen. Environmental Toxicology and Chemistry. 15 (3), 241-248 (1996).
- Sanseverino, J., et al. Use of Saccharomyces cerevisiae BLYES Expressing Bacterial Bioluminescence for Rapid, Sensitive Detection of Estrogenic Compounds. Applied and Environmental Microbiology. 71 (8), 4455-4460 (2008).
- Fetter, E., et al. Effect-directed analysis for estrogenic compounds in a fluvial sediment sample using transgenic cyp19a1b-GFP zebrafish embryos. Aquatic Toxicology. 154, 221-229 (2014).
- Gorelick, D. A., Halpern, M. E. Visualization of estrogen receptor transcriptional activation in zebrafish. Endocrinology. 152 (7), 2690-2703 (2011).
- Rider, C. V., Hartig, P. C., Cardon, M. C., Wilson, V. S. Development of a competitive binding assay system with recombinant estrogen receptors from multiple species. Toxicology Letters. 184 (2), 85-89 (2009).
- Gunnarsson, L., Kristiansson, E., Förlin, L., Nerman, O., Larsson, J. Sensitive and robust gene expression changes in fish exposed to estrogen – a microarray approach. BMC Genomics. 8 (149), 1-9 (2007).
- Vander Ven, L. T. M., et al. Vitellogenin expression in zebrafish Danio rerio evaluation by histochemistry, immunohistochemistry, and in situ mRNA hybridisation. Aquatic Toxicology. 65 (1), 1-11 (2003).
- Bakos, K., et al. Developmental toxicity and estrogenic potency of zearalenone in zebrafish (Danio rerio). Aquatic Toxicology. 136-137, 13-21 (2013).
- Strähle, U., et al. Zebrafish embryos as an alternative to animal experiments – A commentary on the definition of the onset of protected life stages in animal welfare regulations. Reproductive Toxicology. 33 (2), 128-132 (2012).
- Tsang, M. Zebrafish : A Tool for Chemical Screens. Birth Defects Research, Part C. 90 (3), 185-192 (2010).
- Hill, A. J., Teraoka, H., Heideman, W., Peterson, R. E. Zebrafish as a model vertebrate for investigating chemical toxicity. Toxicological Sciences. 86 (1), 6-19 (2005).
- Lee, C., Na, J. G., Lee, K., Park, K. Choriogenin mRNA induction in male medaka, Oryzias latipes as a biomarker of endocrine disruption. Aquatic Toxicology. 61 (3-4), 233-241 (2002).
- Chen, H., et al. Generation of a fluorescent transgenic zebrafish for detection of environmental estrogens. Aquatic Toxicology. 96 (1), 53-61 (2010).
- Bakos, K., et al. Estrogen sensitive liver transgenic zebrafish (Danio rerio) line (Tg(vtg1:mCherry)) suitable for the direct detection of estrogenicity in environmental samples. Aquatic Toxicology. 208, 157-167 (2019).
- Abdelmoneim, A., Clark, C., Mukai, M. Fluorescent reporter zebrafish line for estrogenic compound screening generated using a CRISPR/Cas9-mediated knock-in system. Toxicological Sciences. 173 (2), 336-346 (2019).
- Tong, S. K., et al. A cyp19a1b-GFP (aromatase B) transgenic zebrafish line that expresses GFP in radial glial cells. Genesis. 47 (2), 67-73 (2009).
- Segner, H. Zebrafish (Danio rerio) as a model organism for investigating endocrine disruption. Comparative Biochemistry and Physiology, Part C: Toxicology and Pharmacology. 149 (2), 187-195 (2009).
- Klinge, C. M. Estrogen receptor interaction with estrogen response elements. Nucleic Acids Res. 29 (14), 2905-2919 (2001).
- Faisal, Z., et al. Protective effects of beta-cyclodextrins vs. zearalenone-induced toxicity in HeLa cells and Tg(vtg1:mCherry) zebrafish embryos. Chemosphere. 240, 1-11 (2020).
- Kolpin, D. W., et al. Pharmaceuticals, hormones, and other organic wastewater contaminants in U.S. streams, 1999-2000: A national reconnaissance. Environmental Science and Technology. 36 (6), 1202-1211 (2002).
- Kuch, H. M., Ballschmiter, K. Determination of endocrine-disrupting phenolic compounds and estrogens in surface and drinking water by HRGC-(NCI)-MS in the picogram per liter range. Environmental Science and Technology. 35 (15), 3201-3206 (2001).
- Lundgren, M. S., Novak, P. J. Quantification of phytoestrogens in industrial waste streams. Environmental Toxicology and Chemistry. 28 (11), 2318-2323 (2009).
- Masoner, J. R., Kolpin, D. W., Furlong, E. T., Cozzarelli, I. M., Gray, J. L. Landfill leachate as a mirror of today’s disposable society: Pharmaceuticals and other contaminants of emerging concern in final leachate from landfills in the conterminous United States. Environmental Toxicology and Chemistry. 35 (4), 906-918 (2016).
- Panel on Additives and Products or Substances used in Animal Feed (FEEDA). EFSA Statement on the establishment of guidelines for the assessment of additives from the functional group ‘substances for reduction of the contamination of feed by mycotoxins’ 1 EFSA. EFSA Journal. 8 (7), 1-8 (2010).
- Braunbeck, T., et al. Towards an alternative for the acute fish LC(50) test in chemical assessment: the fish embryo toxicity test goes multi-species – an update. Altex. 22 (50), 87-102 (2005).
- Schneider, C. A., Rasband, W. S., Eliceiri, K. W. NIH Image to ImageJ: 25 years of image analysis. Nature Methods. 9 (7), 671-675 (2012).
- Ober, E. A., Field, H. A., Stainier, D. Y. R. From endoderm formation to liver and pancreas development in zebrafish. Mechanisms of Development. 120 (1), 5-18 (2003).
- Tao, T., Peng, J. Liver development in zebrafish (Danio rerio). Journal of Genetics and Genomics. 36 (6), 325-334 (2009).
- Shier, W. T., Shier, A. C., Xie, W., Mirocha, C. J. Structure-activity relationships for human estrogenic activity in zearalenone mycotoxins. Toxicon. 39 (9), 1435-1438 (2001).
- Panel, E., Chain, F. Appropriateness to set a group health-based guidance value for zearalenone and its modified forms EFSA Panel on Contaminants in the Food Chain (CONTAM). EFSA Journal. 14, 4425 (2016).
- Binder, E. M. Managing the risk of mycotoxins in modern feed production. Animal Feed Science and Technology. 133 (1-2), 149-166 (2007).
- Risa, A., Krifaton, C., Kukolya, J., Kriszt, B., Cserháti, M., Táncsics, A. Aflatoxin B1 and Zearalenone-Detoxifying Profile of Rhodococcus Type Strains. Current Microbiology. 75 (7), 907-917 (2018).

