Manipulación optogenética de la actividad neuronal para modular el comportamiento en ratones que se mueven libremente
Summary
Con la manipulación optogenética de poblaciones neuronales específicas o regiones cerebrales, el comportamiento se puede modificar con alta resolución temporal y espacial en animales en movimiento libre. Mediante el uso de diferentes herramientas optogenéticas en combinación con fibras ópticas implantadas crónicamente, se puede realizar una variedad de modulaciones neuronales y pruebas de comportamiento.
Abstract
La modulación optogenética de los circuitos neuronales en ratones que se mueven libremente afecta el comportamiento agudo y a largo plazo. Este método es capaz de realizar manipulaciones de neuronas individuales y liberación de transmisor específico de la región, hasta circuitos neuronales enteros en el sistema nervioso central, y permite la medición directa de los resultados conductuales. Las neuronas expresan herramientas optogenéticas a través de una inyección de vectores virales que llevan el ADN de elección, como Channelrhodopsin2 (ChR2). La luz se introduce en regiones cerebrales específicas a través de implantes ópticos crónicos que terminan directamente por encima de la región objetivo. Después de dos semanas de recuperación y expresión de herramienta adecuada, los ratones se pueden utilizar repetidamente para pruebas conductuales con estimulación optogenética de las neuronas de interés.
La modulación optogenética tiene una alta resolución temporal y espacial que se puede lograr con alta especificidad celular, en comparación con los métodos comúnmente utilizados, como la estimulación química o eléctrica. La luz no daña el tejido neuronal y por lo tanto se puede utilizar para experimentos a largo plazo, así como para múltiples experimentos de comportamiento en un ratón. Las posibilidades de las herramientas optogenéticas son casi ilimitadas y permiten la activación o silenciamiento de neuronas enteras, o incluso la manipulación de un tipo de receptor específico por la luz.
Los resultados de tales experimentos conductuales con estimulación optogenética integrada visualizan directamente los cambios en el comportamiento causados por la manipulación. El comportamiento del mismo animal sin estimulación lumítica como línea de base es un buen control para los cambios inducidos. Esto permite una descripción detallada de los tipos neuronales o sistemas de neurotransmisores implicados en comportamientos específicos, como la ansiedad. La plasticidad de las redes neuronales también se puede investigar con gran detalle a través de la estimulación a largo plazo o observaciones conductuales después de la estimulación óptica. La optogenética ayudará a iluminar la señalización neuronal en varios tipos de enfermedades neurológicas.
Introduction
La modulación de los circuitos neuronales en el sistema nervioso central y sus resultados conductuales son importantes para entender cómo funciona el cerebro, especialmente en enfermedades psiquiátricas y tareas cognitivas como el aprendizaje y la memoria. Con la optogenética, las células individuales o las poblaciones celulares hasta circuitos enteros pueden ser moduladas por la luz. Las herramientas optogenéticas comunes como Channelrhodopsin2 (ChR2) o Archaerhodopsin (Arch) son capaces de activar o silenciar las neuronas, o aumentar o inhibir la liberación del transmisor en terminales de axón que se proyectan a regiones cerebrales distintas1,,2,,3,,4. Sin embargo, Arch debe utilizarse cuidadosamente, ya que se demostró que su activación en terminales presinápticos aumenta la liberación espontánea del transmisor5. Arch es una bomba de protones rectificadora hacia afuera que cambia el valor de pH dentro de la célula. Este ambiente alcalino induce la afluencia de calcio y mejora la liberación del transmisor5. Para modular específicamente las vías de señalización intracelular, se pueden crear quimeras receptoras compuestas por una herramienta optogenética activable ligera, como rhodopsin o cono opsin, junto con un receptor acoplado adecuada a la proteína G,6,7,8. La cantidad y variación de las herramientas optogenéticas disponibles ha aumentado significativamente durante la última década9.
El propósito de la optogenética es manipular los circuitos neuronales durante el comportamiento. La optogenética permite, por ejemplo, la medición de cambios agudos de comportamiento, como cambios en el comportamiento de ansiedad. Las herramientas optogenéticas se entregan en las regiones diana del cerebro a través de vectores virales. Con la ayuda de promotores y potenciadores especiales, o el sistema Cre-loxP, se puede garantizar la especificidad del tipo de célula para la expresión de herramientas optogenéticas(Figura 1A). Hay varias líneas de ratón modificadas genéticamente que expresan la enzima Cre-Recombinase en tipos celulares específicos solamente. Por ejemplo, los ratones Nex-Cre expresan la Cre-Recombinase en neuronas piramidales en la corteza y el hipocampo bajo el control del Nex-promotor10. Esta enzima es capaz de invertir secuencias de ADN, que están flanqueadas por lados loxP11. En consecuencia, la secuencia de ADN de una herramienta optogenética de doble hilo uterino, que está invertida y flanqueada por lados loxP, sólo puede ser transcrita por neuronas que poseen la Cre-Recombinase,pero no por otros tipos neuronales12,,13. En el caso de los ratones Nex-Cre, la herramienta optogenética se expresará únicamente en neuronas piramidales. La estimulación lumítica de ciertas regiones cerebrales se logra a través de la implantación crónica de fibras ópticas directamente por encima de la región de interés. Los animales pueden entonces ser acoplados a una fuente de luz adecuada y comportarse libremente en casi todo tipo de pruebas de comportamiento.
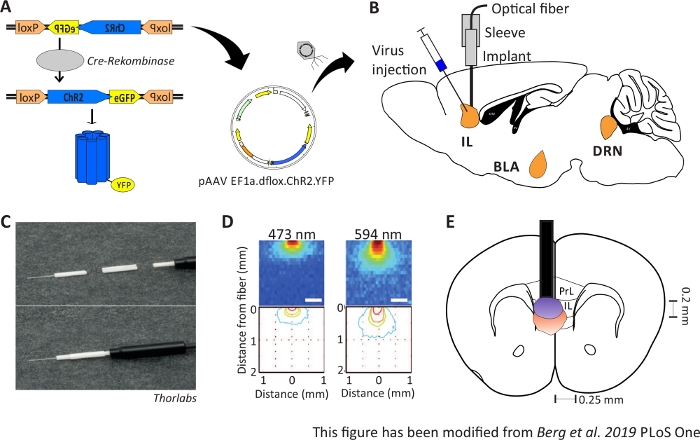
Figura 1: Inyección e implantación. A) Sistema Cre-loxP para ChR2-YFP. La herramienta optogenética de doble floxado se embala en un virus asociado al adeno (AAV) para inyección en el tejido cerebral. B) Vista sagitular de la inyección e implantación del virus de una interfaz neuronal óptica dentro/por encima de la región IL del mPFC. La inyección y la implantación se realizaron desde arriba. Se muestran todas las regiones de interés, IL, BLA y DRN. C) Vista detallada de la fibra óptica implantada, manguito y fuente de luz. D) Difusión de la estimulación de la luz láser azul y roja en el tejido cerebral de materia gris a partir de una fibra de luz de 200 m (Yizhar et al. 2011). La luz azul se extiende, como máximo, 0,5 mm en el tejido, luz roja de aproximadamente 1 mm. Codificación de color: rojo 50%, amarillo 10%, verde 5%, azul 1% si la luz llega a esta área. E) Vista coronal de la implantación unilateral directamente por encima de la IL izquierda con una fibra óptica de 200 m. La región IL tiene una anchura de 0,25 mm en cada hemisferio y una profundidad de 0,2 mm. Las bombillas azules y rojas son la placa de 5% de propagación de luz y se transfieren de Yizhar et al al al tamaño correcto. LoxP: locus de X-over P1; ChR2: Channelrhodopsin; YFP: proteína fluorescente amarilla; dflox: doble floxado; IL: corteza inmórbida; BLA: amígdala basolateral; DRN: núcleos de raphe dorsal; PrL: región prelímpico. Esta cifra ha sido modificada de Berg 201948. Haga clic aquí para ver una versión más grande de esta figura.
Se utilizan enfoques optogenéticos, ya que permite una alta resolución temporal y espacial14 y una modulación específica del tipo de celda. Además, es posible utilizar repetitivamente el dispositivo implantado sin tratamiento adicional. Después de una cirugía estereotáctica, donde se realiza la inyección de un virus adeno-asociado que lleva la herramienta optogenética y la implantación de la fibra óptica, los ratones pueden recuperarse durante dos semanas. Hemos elegido un tiempo de recuperación de sólo 2 semanas, porque este es el tiempo suficiente para recuperarse de la cirugía y para que el virus se exprese. Como los experimentos conductuales son seguidos por inmunohistoquímica, tenemos que asegurarnos de que los ratones no se envejezcas demasiado durante el experimento; de lo contrario, la calidad del tejido disminuye. No muestran impedimentos de comportamiento evidentes del implante y se involucran en el comportamiento típico de la jaula. Por supuesto, la implantación se acompaña de una lesión quirúrgica significativa; por lo tanto, los ratones son monitoreados intensivamente. Después de la cirugía, los ratones necesitan ser alojados en un solo lugar, ya que los ratones alojados en grupo tienden a herirse a las heridas e implantes frescos de los demás. Sin embargo, las condiciones de la vivienda tienen un gran impacto en el nivel de ansiedad de los ratones machos, ya que los ratones de una sola casa muestran niveles de ansiedad más bajos15 y en general síntomas menos depresivos16.
La manipulación química o eléctrica de los circuitos cerebrales carece de la alta especificidad del tipo celular de la optogenética y tiene una resolución temporal y espacial más baja14,17,18. Dependiendo de la pregunta experimental, la estimulación eléctrica o química puede tener diferentes ventajas. Cuando también es necesario estimular los terminales de fibra en una región específica, la estimulación eléctrica es el mejor método. La estimulación química es una buena opción para cuando los receptores específicos del transmisor en toda una región deben ser activados por agonistas. Otra gran ventaja de la optogenética en comparación con la estimulación química o eléctrica es que endógenamente, las neuronas no son sensibles a la luz, lo que evita la aparición de efectos secundarios19. De hecho, altas intensidades de luz pueden inducir efectos de calentamiento8,20, pero debido a los grupos de control adecuados, los efectos conductuales debido a la manipulación optogenética pueden ser eliminados.
La investigación del comportamiento de los roedores, especialmente en lo que respecta a las enfermedades psiquiátricas, ha mejorado considerablemente con la optogenética en animales que se mueven libremente, ya que permite la modulación directa de receptores individuales hasta poblaciones celulares específicas21 y circuitos22. La posibilidad de medir los efectos agudos de tales modulaciones, así como los efectos conductuales a largo plazo después de un tiempo definido23 o después de la estimulación crónica24, permite una amplia flexibilidad de los diseños experimentales y proporciona información muy detallada sobre los circuitos cerebrales. La estimulación de la luz se puede utilizar para modular las neuronas situadas en el lugar de inyección de la herramienta optogenética. Cuando tanto la inyección como la implantación abordan la misma región cerebral, los cuerpos celulares y los axones que se proyectan de principios de neuronas e interneuronas en esta región pueden dirigirsea 3,,6,,8. Sin embargo, la fibra ligera también se puede implantar en una región diferente de la inyectada. En este caso, la estimulación de la luz puede modular la liberación del transmisor en terminales de axón en áreas de proyección de la región inyectada25,26,27.
En el estudio aquí, optogenética se utiliza en combinación con experimentos para analizar el comportamiento relacionado con la ansiedad. Las enfermedades psiquiátricas relacionadas con la ansiedad afectan a más de un tercio de la población mundial28,29,30 y causan una alta carga económica31. Los afectados sufren de una sensación de excitación, tensión y preocupación seguida de comportamiento de evasión32,,33. Estas emociones negativas de origen crónico, que se centran principalmente en eventos futuros34,interfieren fuertemente con la vida diaria de los pacientes. Tratamientos comunes como benzodiazepinas o inhibidores selectivos de la recaptación de serotonina (ISRS) sólo son exitosos en algunos de los pacientes. Una gran cantidad de personas no responden al tratamiento en los35años, lo que demuestra que el mecanismo subyacente a tales enfermedades aún no se entiende completamente. La corteza prefrontal medial (mPFC) es conocida por desempeñar un papel importante en el desarrollo y manifestación de la ansiedad21,,25,27,36,37,38. Específicamente, la sobreactivación de la región de la corteza infralimbia (IL) en el mPFC podría ser parte de trastornos relacionados con la ansiedad39,,40. El experimento de ejemplo descrito aquí podría ayudar a entender cómo las modulaciones en la región IL del mPFC influyen en el comportamiento de ansiedad. Además, el desarrollo de nuevas estrategias terapéuticas para enfermedades psiquiátricas relacionadas con la ansiedad también puede ser apoyado potencialmente.
Los ratones Nex-Cre macho de 2-6 meses de edad se utilizan para expresar ChR2 específicamente en neuronas piramidales dentro de la región IL del mPFC41. Los ratones Nex-Cre tienen un fondo C57Bl/6 y expresan la enzima Cre-recombinase específicamente en las neuronas piramidales. Durante una cirugía estereotáctica, se inyecta ADN ChR2 de doble flox en la región de IL a través de vectores virales asociados con adeno. El implante óptico se coloca directamente encima de la región de interés (Figura 1B) y el implante se fija con cemento dental. Los animales de control reciben una inyección de tdTomato-DNA de doble flox en la misma región para imitar la expresión específica de la célula.
Los animales son alojados en grupo hasta el día de la cirugía y después son alojados en una sola casa para evitar lesiones de otros ratones. Los ratones se alojan en bastidores individuales de jaula ventilada (IVC) en jaulas TypI-L para ratones de una sola casa. El ciclo luz-oscuridad sigue un ritmo de 12:12 h, la fase de luz a partir de las 10 AM. Todos los experimentos conductuales se realizan en la fase oscura, que se asemeja a la fase activa de los roedores. El agua y los pellets de alimentos estándar están disponibles ad libitum. Después de dos semanas de recuperación, lo que garantiza una expresión suficiente de ChR2 en las neuronas piramidales, los ratones se utilizan para experimentos conductuales.
El Campo Abierto (OF) es un laberinto cuadrado de 50 cm x 50 cm con paredes de 40 cm de altura. El suelo se divide en 16 cuadrados donde el interior 4 representa el centro. El comportamiento medido es: 1) tiempo invertido en el centro, 2) número de entradas centrales y 3) distancia total movida. Durante este experimento, hay 4 ensayos que suman 20 minutos. En los ensayos 1 y 3, no se produce estimulación lumínica, y en los ensayos 2 y 4, se realiza una estimulación de 20 Hz con pulso de luz de 5 ms y 1 mW de intensidad de luz de 473 nm (Figura 2A). En los ensayos posteriores, se tuvo en cuenta la habituación en el área de prueba, pero el uso de animales de control inyectados falsas indican cómo se expresa la habituación.
El Laberinto de Barnes es un experimento para el aprendizaje y la memoria. Es una plataforma circular de 92 cm de diámetro y contiene 20 agujeros equidistantes alrededor de la circunferencia. 19 de los agujeros están cerrados y debajo de un agujero se presenta una caja de escape. Durante 4 días consecutivos, los ratones tienen 4 ensayos de entrenamiento para aprender la ubicación de la caja de escape. El día 5, se retira la cajade escape, y se prueba a los ratones en cuanto a cuánto tiempo necesitan encontrar el agujero correcto. El comportamiento medido es: 1) Tiempo hasta que se encuentre el cuadro de escape/agujero correcto, 2) Número de visitas y errores de destino, y 3) Distancia movida hasta que se encuentre en el cuadro de escape. La estimulación lumítica en diferentes grupos se realiza ya sea durante la adquisición o consolidación, que tienen lugar en los días de entrenamiento 1-4, o durante la recuperación el día de la prueba, que es el día 5 (Figura 2D).
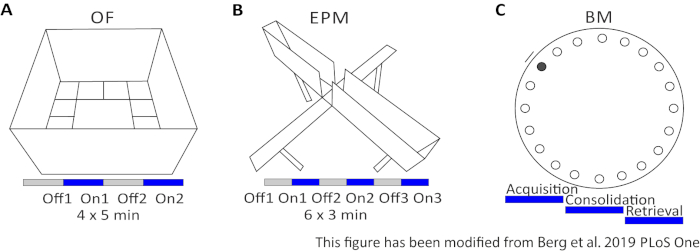
Figura 2: Experimentos conductuales con protocolos optogenéticos. A) Dibujo esquemático del experimento Campo Abierto con el protocolo de estimulación de luz correspondiente. C) Dibujo esquemático del experimento Elevated-Plus Maze con el protocolo de estimulación de la luz correspondiente. D) Dibujo esquemático del experimento Barnes Maze con el protocolo de estimulación de la luz correspondiente. EPM: Laberinto Elevado-Plus; OF: Campo abierto; BM: Prueba de laberinto de Barnes. Esta cifra ha sido modificada de Berg 201948. Haga clic aquí para ver una versión más grande de esta figura.
Para la estimulación optogenética, la intensidad y frecuencia de la luz deben adaptarse a la herramienta optogenética y al tipo neuronal que se está investigando. La menor intensidad lumínica posible debe utilizarse para evitar daños en el tejido, ya que varios estudios han demostrado que hay posibles efectos de calentamiento debido a la intensidad de la luz fuerte8,20. Para ChR2, una estimulación de 20 Hz con un pulso de luz de 5 ms se utiliza comúnmente2. Como ChR2 es bastante sensible a la luz, la intensidad de la luz de 1 mW es suficiente. El protocolo de estimulación de la luz alterna entre la luz apagada y los ensayos para medir directamente los cambios de comportamiento. Las condiciones externas de la habitación para los experimentos conductuales deben permanecer estables para todo el grupo de animales. Las condiciones importantes a tener en cuenta son el ruido (tenga en cuenta que los propios dispositivos pueden hacer ruido), el olor (limpiar siempre las configuraciones de comportamiento con etanol), la intensidad de la luz y el experimentador. El experimentador siempre debe ser la misma persona. Además, la hora del día de los experimentos debe ser la misma para todos los animales de un grupo, se prefiere unas horas después del inicio de la fase oscura en la instalación.
El objetivo de este experimento es aumentar la relación excitación/inhibición (E/I) en la región de IL a través de una fuerte activación de las neuronas piramidales excitatorias. Una relación E/I mejorada en esta región especial de la corteza se sabe para aumentar los niveles de ansiedad en ratones40,42,43,44.
Protocol
Representative Results
Discussion
El uso de la luz para manipular la señalización neuronal ha sido el método de elección desde hace casi una década. Desde 2005, el número de artículos publicados sobre el desarrollo de nuevas herramientas optogenéticas4,6,8,14,49,50,51 y estudios donde tales herramientas se utilizan para investigar circuitos cerebrales21,23,40,43,52, altamente aumentado. Por un lado, con la enorme diversidad de herramientas optogenéticas inyectables, variantes de implantación, líneas transgénicas de ratón y experimentos conductuales, la posibilidad de experimentos es múltiple e ilimitada. Por otro lado, la posibilidad de hacer fallas en la elección de condiciones experimentales es muy alta y los experimentos son tan específicos, que a menudo la comparabilidad con otros estudios es difícil.
Pasos críticos
Un paso crítico importante de este protocolo es la planificación adecuada. La elección de la herramienta optogenética debe coincidir con la cuestión científica. ¿Sólo es necesario manipular la actividad general de una neurona o sinapsis? Entonces las herramientas proporcionadas comercialmente como ChR221,25,,27 y Arch37 son una buena opción. Pero aparte de eso, Si un sistema de neurotransmisores especial o incluso un solo receptor debe ser manipulado, una quimera del receptor individual es a menudo la mejor opción3,6. Varias quimeras receptoras con GPCR, los llamados Opto-XRs, y las pautas para producirlas ya están disponibles4,,50. Aparte de la elección de las herramientas optogenéticas, la línea del ratón en combinación con el experimento conductual también es crítica. Diferentes cepas de fondo, como por ejemplo C57Bl/6 y BALB/cByJ, muestran diferentes fenotipos de comportamiento en algunos aspectos53,54. Los ratones C57Bl/6 tienen una ansiedad basal baja y se pueden utilizar para la manipulación ansiogénica, mientras que BALB/cByJ muestran niveles de ansiedad más altos y, por lo tanto, son más sensibles a los fármacos ansiolíticos. Además, las variantes transgénicas de estas cepas de fondo también pueden variar en su fenotipo48. Con una combinación adecuada de promotores específicos junto con una herramienta optogenética y una línea de ratón transgénico, casi todas las poblaciones celulares deseadas pueden ser objetivo.
Un paso crítico durante la cirugía es apuntar a la ubicación correcta. Con la ayuda del atlas cerebral del ratón, las coordenadas adecuadas para el eje anterior-posterior, y el eje medial-lateral, y la profundidad de la estructura se pueden establecer45. En realidad, cada cráneo tiene una forma y un tamaño ligeramente diferentes. Por lo tanto, el factor F46 para ajustar las coordenadas estereotácticas es bastante importante, al igual que la fijación correcta de la nariz y el oído durante la cirugía estereotáctica. Si la cabeza del ratón está inclinada, la cánula de inyección no se dirigirá a la región de interés deseada.
Además, el diámetro de la cánula de inyección también es crítico. Si es demasiado pequeño, ningún virus puede ser liberado en el tejido, si es demasiado ancho, la cánula filtrará la solución de virus en su camino a la región de interés. Si la fibra óptica implantada termina directamente encima de la región de destino, la expresión del virus en las regiones de la corteza anterior no importa. Pero si el implante se coloca por encima de otras regiones para estimular los terminales de axón, los axones de las regiones de la corteza superior también se activarán por la luz y falsificarán los datos obtenidos. Como ejemplo: La región il y la región prelimbia (PrL) se proyectan a la amígdala basal55,56 pero tienen funciones y roles completamente diferentes en la modulación de la ansiedad26,57. Si el implante se coloca por encima de la amígdala para activar terminales de axón desde la región de IL, y durante la solución del virus de inyección también se colocó en la PrL debido a la cánula de inyección incorrecta, el riesgo de activar también terminales de axón desde el PrL es muy alto.
Durante la preparación del cráneo para la fijación del implante, el uso disperso de imprimación y unión es crucial para una fijación confiable y duradera. Si el sistema de adhesión de 2 componentes no se aplica delgadamente, el cemento dental podría desprenderse del cráneo después de un par de días o semanas. Además, el cráneo también tiene que ser completamente secado antes de fijar el implante, ya que de lo contrario el cemento no se fijará correctamente al cráneo.
También existen pasos críticos en la parte de comportamiento de este protocolo. En primer lugar, la construcción del laberinto es muy importante. En cada configuración de comportamiento, existen varias variantes en la literatura con respecto al tamaño y la forma, así como para el propio procedimiento58,,59,,60. Es importante elegir una variante que haga que los datos sean comparables y reproducibles. Además, deben tenerse en cuenta los requisitos especiales para las líneas de ratón utilizadas43,48. En los datos representativos del EPM se puede ver que varios ratones Nex-Cre cayeron del laberinto o se deslizaron varias veces(Figura 2b). Para estos ratones, un laberinto con una pequeña pared alrededor de los brazos abiertos habría sido una mejor alternativa.
En segundo lugar, es fundamental mantener todas las condiciones de la habitación externa constantes61,de lo contrario diferentes grupos de ratones no serían comparables en absoluto. En este sentido, es muy importante elegir el momento del experimento como uno en el que la configuración experimental está vacante y el experimentador siempre está presente. Además, se deben considerar eventos en el edificio, tales como trabajos de construcción, pruebas de cualquier sistema (alarma de incendio) o el día de limpieza de la instalación del ratón, con el fin de evitar interferencias con los datos obtenidos.
Por último, las condiciones de manejo y alojamiento son fundamentales para los experimentos de comportamiento. Cuando se realiza una implantación, los ratones necesitan ser alojados por el riesgo de lesiones de otros ratones. Para garantizar una buena comparabilidad entre grupos y un error bajo dentro de un grupo, cada ratón debe tener el mismo tamaño de jaula y enriquecimiento. Para los experimentos relacionados con la ansiedad, la vivienda individual tiene algunas ventajas, ya que los ratones macho alojados en singe muestran un nivel de ansiedad basal más bajo, menos variación en su nivel de ansiedad, y síntomas menos depresivos15,,16. Los ratones macho alojados en grupo podrían diferir fuertemente en su nivel de ansiedad debido a la jerarquía entre los ratones. Además de la vivienda, también es importante un manejo constante e igualitario de todos los ratones y grupos. Agarrar el ratón para conectar la fibra ligera en el implante es muy estresante. Por lo tanto, este procedimiento tiene que ser el mismo para cada ratón, lo que significa la misma técnica y el mismo experimentador. Además, el tiempo de habituación en la jaula de espera, que está destinado a calmar al ratón del procedimiento de conexión estresante, también necesita tener las mismas condiciones en duración, basura y posición al laberinto. El manejo dentro de la instalación del ratón también es crítico para el rendimiento conductual posterior. Los animales experimentales y de control no deben ser limpiados en diferentes días o por diferentes personas, ya que esto también es estresante para ratones. Además, el día de limpieza no debe ser el día experimental para evitar diferencias en el comportamiento.
Solución de problemas
Hay varios problemas que pueden ocurrir durante el protocolo. Por ejemplo, perforar un todo en el cráneo durante la cirugía estereotáctica podría dañar los vasos sanguíneos. Por lo general, se produce un sangrado fuerte, especialmente por encima del bregma y la lambda. Si esto sucede, no trate de detener el sangrado con palos de algodón, ya que tienden a extender aún más sangrado fuera del vaso debido a su absorbencia, en su lugar, enjuague directamente con NaCl.
También puede suceder que la inyección de presión de la solución de virus no está funcionando. En este caso, podría ser que la parafilm, una costra del agujero de la rebaba o el tejido cerebral, está obstruyendo la punta de la cánula. En este caso, retire la cánula lentamente fuera del cerebro sin cambiar el eje X o Y y use una pinza para extraer 1-2 mm de la parte frontal de la punta de la cánula. Antes de reducir la cánula de nuevo, pruebe la funcionalidad aplicando una pequeña cantidad de presión para ver si el virus sale de la punta de la cánula. Para evitar el estreñimiento, baje la cánula con una velocidad constante y no detenga el movimiento hasta que se alcance la profundidad más profunda del lado de inyección. Si se extrae demasiado de la punta de la cánula y el diámetro es demasiado grande, la cánula dañará el tejido y se aumentará el riesgo de aplicar el virus a la vez. Por lo tanto, asegúrese de que sólo la parte obstruida de la punta se elimina cuidadosamente.
Durante el experimento de comportamiento, la configuración del experimento en el software de seguimiento de vídeo (por ejemplo, Ethovision XT) puede causar problemas. Si, por ejemplo, la salida de luz no funciona correctamente, esto puede deberse a varias razones. El Pulser tiene que ser abierto, programado e iniciado antes de que se abra Ethovision XT. El hardware debe seleccionarse correctamente en la “Configuración experimental” (paso 3.2.2.4). Si se selecciona la IO-Box incorrecta, o algo que no sea “Costume Hardware”, el dispositivo Pulser no puede ser controlado por Ethovision. Si la prueba de la salida de luz se realiza correctamente, pero el protocolo de luz programado en “Configuración de control de prueba” no funciona durante la adquisición, la referencia de subreberción o subreberción podría ubicarse incorrectamente o las condiciones y acciones no están claras. Por ejemplo: ¿pertenece la referencia a la subreberción correcta? ¿La referencia está programada correctamente (por ejemplo, con qué frecuencia se ejecuta la subreberción)?
Además, puede suceder que durante la “configuración de detección” el animal sea rastreado adecuadamente, pero durante la adquisición hay muestras donde no se encuentra el sujeto. En este caso, compruebe si la iluminación en la sala experimental ha cambiado, o si algo produjo sombras no deseadas dentro del laberinto. Toda la parte inferior del laberinto tiene que tener el mismo color, ya que el ajuste sólo funcionará para una combinación específica. Si por cualquier razón no se pueden evitar diferentes colores de fondo o sombras, defina la configuración de detección en la parte más oscura del laberinto.
Para cambiar cualquier configuración después de la adquisición de los primeros animales, no aplique estos cambios en la configuración ya utilizada. Duplíquelos para ajustarlos. Esto también significa que la versión de prueba ya registrada ya no es válida para el análisis de datos. En tal caso, registre todos los animales para este grupo experimental con la configuración original, y cree un nuevo experimento después donde se analizan los videos grabados en lugar de seguimiento en vivo. En este experimento “de vídeo”, se pueden utilizar varios ajustes para el análisis sin perder comparabilidad entre animales o incluso datos.
Limitaciones y aplicaciones futuras
Este método de manipulación del comportamiento con optogenética en animales que se mueven libremente también incluye limitaciones. Durante la cirugía, la proximidad de los dos implantes está restringida. Para la doble implantación, la distancia entre los dos implantes debe ser mínimamente la anchura del aparato para sostener el implante. El aparato necesita bajar el segundo implante en el agujero de la rebaba, mientras que los primeros implantes ya están fijos. Una solución para esto podría ser una implantación en ángulo, donde las puntas de la fibra de vidrio pueden estar muy cerca mientras que las férulas cerámicas por encima del cráneo tienen mayor distancia23,,55,56,57,62,63. Una desventaja de una implantación en ángulo es la difusión de la luz. Cuando la punta de la fibra está inclinada en lugar de desde la recta superior, el área estimulada es diferente. En el caso de dos regiones objetivo cercanas, es necesario tener en cuenta la posición cambiada de la estimulación de la luz.
Durante el experimento conductual, la construcción del laberinto podría interferir con el cable óptico conectado al animal. Algunas pruebas de comportamiento, como la caja oscura clara, contienen un área interior64,65,y otros laberintos contienen compartimentos que el ratón necesita para entrar. Estos experimentos no se pueden realizar con esta configuración. Alternativamente, un sistema inalámbrico podría ser una opción22,26,66. Pero afortunadamente algunos laberintos, como el Barnes Maze, se pueden organizar de tal manera, que los ratones son capaces de entrar en los compartimentos relevantes67.
Además de aquellos con zonas cerradas, los laberintos que son demasiado anchos pueden causar también problemas. Cuanto más grande sea el área del laberinto, más tiempo debe ser el cable para permitir que el animal vaya a todas las posiciones del laberinto. Hay que tener cuidado de que el animal no sea capaz de pisar el cable o agarrarlo y morderlo. Una solución para eso podría ser una construcción que enrolla el cable redundante. Una desventaja es que el arrastre para desenrollar el cable es difícil para los ratones. Esta solución se adaptaría mejor a las ratas. Otra posible opción podría ser hacer la estimulación de la luz de antemano, en lugar de durante el experimento, por supuesto esto sólo es factible si se produce un efecto a largo plazo debido a la estimulación de la luz23.
Comparación con métodos existentes/alternativos
Los métodos alternativos serían la estimulación química o eléctrica duranteelcomportamiento8,18. Agonistas químicos o antagonistas son capaces de activar o silenciar las neuronas a través de receptores específicos y también pueden manipular sistemas de neurotransmisores individuales38,,68. Por un lado, la especificidad del receptor es bastante alta para los productos químicos, porque el agonista o antagonista específico sólo activan ciertos receptores39. Por otro lado, la especificidad de los subtipos de receptores del mismo grupo de neurotransmisores es a menudo insuficiente. La mayoría de los productos químicos se unen a al menos dos sub-tipos con diferentes probabilidades69. Además, los productos químicos no pueden distinguir entre los tipos de células neuronales siempre y cuando posean los mismos tipos de receptores. Más allá de esto, la resolución temporal y espacial es pobre para las manipulaciones químicas en comparación con la optogenética. Agonistas o antagonistas a menudo se administran por vía oral35 o a través de inyecciones sistémicas57,70. Si la infusión del producto químico se realiza directamente en el tejido cerebral, los efectos aparecen más rápido que con las aplicaciones orales, pero todavía en una escala de tiempo más lenta que con la estimulación de la luz. Como las sustancias químicas administradas se difunden en el cerebro y no son específicas para los tipos neuronales o regiones cerebrales, la manipulación de circuitos cerebrales específicos no es posible.
La estimulación eléctrica tiene una resolución temporal más alta que la estimulación química9,,14. La propagación en el tejido neuronal es menor que con la estimulación química y la resolución espacial es mejor que con la estimulación química. Sin embargo, la estimulación eléctrica carece de la posibilidad de abordar específicamente diferentes tipos de células neuronales o tipos de receptores, ya que cada neurona cercana al electrodo responderá a la estimulación eléctrica.
Los métodos alternativos al comportamiento en ratones que se mueven libremente son, por ejemplo, grabaciones electrofisiológicas en rebanadas cerebrales, donde las neuronas individuales o los axones se pueden modular con optogenéticas y los efectos provocados se pueden medir mediante la grabación de electrodos6,,71. Los experimentos in vitro ofrecen la posibilidad de investigar la base molecular y celular de las estimulaciones optogenéticas, pero tienen la limitación de que falta conectividad intrínseca y la entrada de otras regiones cerebrales. Otra opción es utilizar optogenética junto con imágenes multifotográficas1,72. En este caso, los ratones tienen la cabeza fija y pueden ser anestesiados o estar despiertos para resolver tareas simples.
Para realizar un experimento optogenético exitoso, una amplia gama de herramientas y aplicaciones están disponibles hoy en día. La selección de herramientas optogenéticas y la configuración del comportamiento es fundamental para responder a preguntas específicas de investigación. Si se elige la combinación correcta de herramientas y experimentos, la optogenética permite una investigación sin precedentes y en profundidad de los circuitos neuronales con alta resolución temporal y espacial. Esto ayudará a entender y desarrollar nuevas estrategias terapéuticas para las enfermedades psiquiátricas y la cognición.
Disclosures
The authors have nothing to disclose.
Acknowledgements
Gran agradecimiento al profesor Klaus-Armin Narve y a la Dra. Sandra Goebbels (Max-Plank-Institute of Experimental Medicine, Goettingen, Alemania) por proporcionar ratones Nex-Cre amablemente. Además, agradecemos a nuestro equipo de vídeo Yunus Dikici y Ruben Wiesner por la grabación y procesamiento del video de JoVE para este artículo. Además, gran agradecimiento a Kristin Claussen por su voz en off y Kimberly Anne Go por la corrección del manuscrito.
Los resultados presentados se obtuvieron en la Universidad Ruhr en Bochum y el video fue grabado en la Universidad de Bremen.
Este trabajo fue financiado por Deutsche Forschungsgemeinschaft (DFG, German Research Foundation) – Projektnummer 122679504 – SFB 874 y DFG MA 4692/3-2.
Materials
| Ketamin | Sigma-Aldrich | K2753-64 | Anestasia |
| 20 % Glucose | AlleMan Pharma | Injection s.c. for fast recovery | |
| Behavioral mazes | Costum made | Measure anxiety | |
| Bepanthen | Bayer | Ophthalmic oinment | |
| Betaisodona | Monodipharma | Sterilant containing iodine | |
| Betaisodona | Monodipharma | Iodine oinment | |
| Binocular | Olympus | SZ52, 110AL0.62x WD160 | Surgery |
| Ceramic ferrules | Thorlabs | CFLC230-10 | Implant |
| Ceramic Fiber Scribe | Thorlabs | CSW12.5 | Cutting of the glass fiber |
| Channelrhodopsin2-YFP virus | Penn Vector Core | Addgene 20298 | Optogenetic tool |
| Compressed air | Kontakt Chemie | Druckluft 67 | Drying of the skull |
| Coordinate system | Stoelting | Stereotactic coordinates for the surgery | |
| Correl Draw | Graphical software version 13 | ||
| Cryoslicer | MICROM | HM500OM | Production of brain slices for staining |
| Ethovision XT 14 | Noldus | Software for behavioral tracking | |
| Exel | Statistical Software | ||
| Ferrule Polishing Puck | Thorlabs | D50-F | Polishing implants round side |
| Fiber Patch Cord dual | Prizmatix | Optogenetics-Fiber 500, 1,20 m, Ferrule core 1,25 mm | Cables, which are connected with the two implants of a bilateral implantation |
| Fiber Patch Cord single | Prizmatix | Optogenetics-Fiber 500, 1,20 m, Ferrule core 1,25 mm | Cable, which is connected with the implant via a sleeve |
| Fiber Stripping Tool | Thorlabs | T06S13 | Stripping glass fiber for implant |
| Filter paper | VWR European | 516-0300 | Cut into pieces for the Novelty-Suppressed Feeding test |
| Food pellets | Mühle Levers | Höveler Nagerfutter | Nutrition for the mice |
| Glass pipettes | Harvard Apparatus | GC150-10 | Injection pipettes |
| Gradia direct-Flo | Henry Schein | 103322 | Fluid dental cementum |
| Heating lamp | efbe-Schott/Phillips | R95E | Prevent the mice from cooling after the surgery |
| Heating plate | Stoelting | Integrated into coordinate system | |
| Injection canula | Braun | 100 Sterican, 0,4 x 20 mm, Gr. 20 | All injections and to bore hole into the skull |
| Litter | T 1350 | Grounding for the Novelty-Supressed Feeding test | |
| Mouse cages | Zoonlab | 405 cm^2 | Single housing for experiments |
| Optibond FL | Kerr | 26684E | Preparation of the skull for implantation |
| Optical glass fiber | Thorlabs | FT200EMT | Light fiber for implant |
| Optogenetics-LED.STSI | Prizmatix | Optogenetic toolbox for light stimulation during behavioral experiments | |
| Paraformaldehyde | Sigma-Aldrich | 16005-1KG-R | Perfusion of mice to remove the brains |
| Polishing sheet 0.02 µm grit | Thorlabs | LFCF | Polishing implants round side |
| Polishing sheet 1 µm grit | Thorlabs | LF1D | Polishing implants round side |
| Polishing sheet 30 µm grit | Thorlabs | LF30D | Polishing implants round side |
| Polishing sheet 6 µm grit | Thorlabs | LF6D | Polishing implants round side |
| Pulser Software | Prizmatix | Software for light device control | |
| Rimadyl-Carprofen | Zoetis | Analgesia | |
| Sigma Plot | Software for statistics | ||
| Sleeve | Thorlabs | FT200EMT | Connection of implant and light cable |
| SodiumCloride (NaCl) | Braun | 3570410 | Rinsing of the skull |
| Superglue | Pattex Henkel | To Fix the glass fiber in the ferrule | |
| td-Tomato virus | Penn Vector Core | Addgene 51503 | Optogenetic tool |
| UV light | KoQGHJ | wireless, 1200 mW/cm^2 | Polymeration lamp for dental cementum |
| Xylavet-Xylazin | cp pharma | Anesthesia |
References
- Chow, B. Y., et al. High-performance genetically targetable optical neural silencing by light-driven proton pumps. Nature Letters. 463, 98-102 (2010).
- Zhao, S., et al. Cell type-specific channelrhodopsin-2 transgenic mice for optogenetic dissection of neural circuitry function. Nature Methods. 8, 745-752 (2011).
- Spoida, K., Masseck, O. A., Deneris, E. S., Herlitze, S. Gq/5-HT2c receptor signals activate a local GABAergic inhibitory feedback circuit to modulate serotonergic firing and anxiety in mice. Proceedings of the National Academy of Science of the United States of America. 111, 6479-6484 (2014).
- Kleinlogel, S. Optogenetic user’s guide to Opto-GPCRs modified GPCRs. Frontiers in Bioscience. 21, 794-805 (2016).
- Mahn, M., Prigge, M., Ron, S., Levy, R., Yizhar, O. Biophysical constraints of optogenetic inhibition at presynaptic terminals. Nature Neuroscience. 19, 554-556 (2016).
- Masseck, O. A., et al. Vertebrate Cone Opsins Enable Sustained and Highly Sensitive Rapid Control of Gi/o Signaling in Anxiety Circuitry. Neuron. 81, 1263-1273 (2014).
- Oh, E., Maejima, T., Liu, C., Deneris, E., Herlitze, S. Substitution of 5-HT 1A Receptor signaling by a light-activated G protein-coupled receptor. Journal of Biological Chemistry. 285, 30825-30836 (2010).
- Yizhar, O., Fenno, L. E., Davidson, T. J., Mogri, M., Deisseroth, K. Optogenetics in Neural Systems. Neuron Primer. 71, 9-34 (2011).
- Masseck, O. A., Manahan-Vaughan, D. A Guide to Optogenetic Applications, With special Focus on Behavioral and In Vivo Electrophysiological Experiments. HandboOk of In Vivo Neural Plasticity Techniques – A Systems Neuroscheince Approach to the Neural Basis of Memory and Cognition. , 557 (2019).
- Goebbels, S., et al. Genetic Targeting of Principal Neurons in Neocortex and Hippocampus of NEX-Cre Mice. Genesis. , 611-621 (2006).
- Yang, Y. S., Hughes, T. E. Cre Stoplight: A red/green fluorescent reporter of Cre recombinase expression in living cells. Biotechniques. 31, 1036-1041 (2001).
- Schnütgen, F., et al. A directional strategy for monitoring Cre-mediated recombination at the cellular level in the mouse. Nature Biotechnology. 21, 562-565 (2003).
- Taniguchi, H., et al. A Resource of Cre Driver Lines for Genetic Targeting of GABAergic Neurons in Cerebral Cortex. Neuron. 71, 995-1013 (2011).
- Deisseroth, K. Optogenetics. Nature Methods. 8, 268-273 (2011).
- Palanza, P., Gioiosa, L., Parmigiani, S. Social stress in mice: Gender differences and effects of estrous cycle and social dominance. Physiology and Behavior. 73, 411-420 (2001).
- Karolewicz, B., Paul, I. A. Group housing of mice increases immobility and antidepressant sensitivity in the forced swim and tail suspension tests. European Journal of Pharmacology. 415, 197-201 (2001).
- Masseck, O. A., Rubelowski, J. M., Spoida, K., Herlitze, S. Light- and drug-activated G-protein-coupled receptors to control intracellular signalling. Experimental Physiology. 96, 51-56 (2011).
- Aravanis, A. M., et al. An optical neural interface: in vivo control of rodent motor cortex with integrated fiberoptic and optogenetic technology. Journal of Neural Engineering. 4, (2007).
- Zhang, F., et al. Multimodal fast optical interrogation of neural circuitry. Nature Article. 446, 633-639 (2007).
- Owen, S. F., Liu, M. H., Kreitzer, A. C. Thermal constraints on in vivo optogenetic manipulations. Nature Neuroscience. 22, 1061-1065 (2019).
- Hare, B. D., et al. Optogenetic stimulation of medial prefrontal cortex Drd1 neurons produces rapid and long-lasting antidepressant effects. Nature Communication. 10, 1-12 (2019).
- Allsop, S. A., Vander Weele, C. M., Wichmann, R., Tye, K. M. Optogenetic insights on the relationship between anxiety-related behaviors and social deficits. Frontiers in Behavioral Neuroscience. 8, 1-14 (2014).
- Fuchikami, M., et al. Optogenetic stimulation of infralimbic PFC reproduces ketamine’s rapid and sustained antidepressant actions. Proceedings of the National Academy of Science of the United States of America. 112, 8106-8111 (2015).
- Correia, P. A., et al. Transient inhibition and long-term facilitation of locomotion by phasic optogenetic activation of serotonin neurons. Elife. 6, 1-26 (2017).
- Felix-Ortiz, A. C., Burgos-Robles, A., Bhagat, N. D., Leppla, C. A., Tye, K. M. Bidirectional modulation of anxiety-related and social behaviors by amygdala projections to the medial prefrontal cortex. Neuroscience. 321, 197-209 (2016).
- Marek, R., Xu, L., Sullivan, R. K. P., Sah, P. Excitatory connections between the prelimbic and infralimbic medial prefrontal cortex show a role for the prelimbic cortex in fear extinction. Nature Brief Communication. , (2018).
- Parfitt, G. M., et al. Bidirectional Control of Anxiety-Related Behaviors in Mice: Role of Inputs Arising from the Ventral Hippocampus to the Lateral Septum and Medial Prefrontal Cortex. Neuropsychopharmacology. 42, 1715-1728 (2017).
- Bandelow, B., Michaelis, S. Epidemiology of anxiety disorders in the 21st century. Dialogues in Clinical Neuroscience. 17, 327-335 (2015).
- Kessler, R. C., et al. Lifetime Prevalence and Age-of-Onset Distributions of DSM-IV Disorders in the National Comorbidity Survey Replication. Archives of General Psychiatry. 62, 593-602 (2005).
- Kessler, R. C., Petukhova, M., Sampson, N. A., Zaslavsky, A. M., Wittchen, H. U. Twelve-month and lifetime prevalence and lifetime morbid risk of anxiety and mood disorders in the United States. International Journal of Methods Psychiatric Research. 21, 169-184 (2014).
- Andlin-Sobocki, P., Wittchen, H. U. Cost of anxiety disorders in Europe. European Journal of Neurology. 12, 39-44 (2005).
- Forster, G. L., Novick, A. M., Scholl, J. L., Wall, M. J. The Role of the Amygdala in Anxiety Disorders. Intech. , 61-102 (2012).
- Liberzon, I. Neural circuits in anxiety and stress disorders a focused review. Therapeutics and Clinical Risk Management. 11, 115-126 (2015).
- Sylvers, P., Lilienfeld, S. O., LaPrairie, J. L. Differences between trait fear and trait anxiety: Implications for psychopathology. Clinical Psychology Review. 31, 122-137 (2011).
- Daws, L. C., Koek, W., Mitchell, N. C. Revisiting Serotonin Reuptake Inhibitors and the Therapeutic Potential of ‘Uptake-2’ in Psychiatric Disorders. ACS Chemical Neuroscience. 4, 16-21 (2013).
- Felix-Ortiz, A. C., et al. BLA to vHPC inputs modulate anxiety-related behaviors. Neuron Report. 79, 658-664 (2013).
- Padilla-Coreano, N., et al. Direct Ventral Hippocampal-Prefrontal Input Is Required for Anxiety-Related Neural Activity and Behavior. Neuron Article. 89, 857-866 (2016).
- Lisboa, S. F., Stecchini, M. F., Corrêa, F. M. A., Guimarães, F. S., Resstel, L. B. M. Different role of the ventral medial prefrontal cortex on modulation of innate and associative learned fear. Neuroscience. 171, 760-768 (2010).
- Bi, L. L., et al. Enhanced excitability in the infralimbic cortex produces anxiety-like behaviors. Neuropharmacology. 72, 148-156 (2013).
- Yizhar, O., et al. Neocortical excitation/inhibition balance in information processing and social dysfunction. Nature Article. 477, 171-178 (2011).
- Goebbels, S., et al. Genetic Targeting of Principal Neurons in Neocortex and Hippocampus of NEX-Cre Mice. Genesis. 44, 611-621 (2006).
- Rubenstein, J. L. R., Merzenich, M. M. Model of autism: increased ratio of excitation/ inhibition in key neural systems. Genes, Brain and Behavior. 2, 255-267 (2003).
- Berg, L., Eckardt, J., A, M. O. Enhanced activity of pyramidal neurons in the infralimbic cortex drives anxiety behavior. PLoS One. 14, 1-19 (2019).
- Meunier, C. N. J., Amar, M., Lanfumey, L., Hamon, M., Fossier, P. 5-HT1A receptors direct the orientation of plasticity in layer 5 pyramidal neurons of the mouse prefrontal cortex. Neuropharmacology. 71, 37-45 (2013).
- Paxinos, G., Franklin, K. B. J., Paxinos, G., Franklin, K. B. J., Paxinos, G., Franklin, K. B. J. . Mouse Brain in Stereotaxic Coordinates. 2, (2004).
- Gore, B. B., Soden, M. E., Zweifel, L. S. Manipulating gene expression in projection-specific neuronal populations using combinatorial viral approaches. Current Protocols in Neuroscience. 435, 1-6 (2014).
- Stujenske, J. M., Spellman, T., Gordon, J. A. Modeling the Spatiotemporal Dynamics of Light and Heat Propagation for InVivo Optogenetics. Cell Report. 12, 525-534 (2015).
- Berg, L. Imbalance of excitation and inhibition within the prefrontal cortex supports anxiety behavior. Ruhr-University Bochum. , (2019).
- Boyden, E. S. A history of optogenetics: The development of tools for controlling brain circuits with light. F1000 Biology Reports. 3, 1-12 (2011).
- Airan, R. D., Thompson, K. R., Fenno, L. E., Bernstein, H., Deisseroth, K. Temporally precise in vivo control of intracellular signalling. Nature. 458, 1025-1029 (2009).
- Sparta, D. R., et al. Construction of implantable optical fibers for long-term optogenetic manipulation of neural circuits. Nature Protocol. 7, 12-23 (2012).
- Covington, H. E., et al. Antidepressant Effect of Optogenetic Stimulation of the Medial Prefrontal Cortex. Journal of Neuroscience. 30, 16082-16090 (2010).
- Lepicard, E. M., Joubert, C., Hagneau, I., Perez-Diaz, F., Chapouthier, G. Differences in anxiety-related behavior and response to diazepam in BALB/cByJ and C57BL/6J strains of mice. Pharmacology, Biochemistry and Behavior. 67, 739-748 (2000).
- Schmidt, M. V., Müller, M. B. Animal models of anxiety. Elsevier. 3, 369-374 (2006).
- Cho, J. H., Deisseroth, K., Bolshakov, V. Y. Synaptic Encoding of Fear Extinction in mPFC-amygdala Circuits. Neuron Article. 80, 1491-1507 (2013).
- Adhikari, A., et al. Basomedial amygdala mediates top-down control of anxiety and fear. Nature. 527, 179-185 (2015).
- Suzuki, S., et al. The infralimbic and prelimbic medial prefrontal cortices have differential functions in the expression of anxiety-like behaviors in mice. Behavioural Brain Research. 304, 120-124 (2016).
- Carola, V., D’Olimpio, F., Brunamonti, E., Mangia, F., Renzi, P. Evaluation of the elevated plus-maze and open-field tests for the assessment of anxiety-related behaviour in inbred mice. Behavioural Brain Research. 134, 49-57 (2002).
- Prut, L., Belzung, C. The open field as a paradigm to measure the effects of drugs on anxiety-like behaviors: A review. European Journal of Pharmacology. 463, 3-33 (2003).
- Tye, K. M., et al. Amygdala circuitry mediating reversible and bidirectional control of anxiety. Nature Letter. 471, 358-362 (2011).
- Bouwknecht, J. A., et al. Differential effects of exposure to low-light or high-light open-field on anxiety-related behaviors: Relationship to c-Fos expression in serotonergic and non-serotonergic neurons in the dorsal raphe nucleus. Brain Research Bulletin. 72, 32-43 (2007).
- Overstreet, D. H., Knapp, D. J., Angel, R. A., Navarro, M., Breese, G. R. Reduction in repeated ethanol-withdrawal-induced anxiety-like behavior by site-selective injections of 5-HT1A and 5-HT2C ligands. Psychopharmacology. 187, 1-12 (2006).
- Takahashi, A., et al. Glutamate Input in the Dorsal Raphe Nucleus As a Determinant of Escalated Aggression in Male Mice. Journal of Neuroscience. 35, 6452-6463 (2015).
- Klemenhagen, K. C., Gordon, J. A., David, D. J., Hen, R., Gross, C. T. Increased Fear Response to Contextual Cues in Mice Lacking the 5-HT1A Receptor. Neuropsychopharmacology. 31, 101-111 (2006).
- Ramos, A. Animal models of anxiety: do I need multiple tests. Trends in Pharmacological Science. 29, 493-498 (2008).
- Isosaka, T., et al. Htr2a-Expressing Cells in the Central Amygdala Control the Hierarchy between Innate and Learned Fear. Cell. 163, 1153-1164 (2015).
- Regev, L., Goshen, I. Employing Optogenetics in Memory Research. Optogenetics: A Roadmap. , 219-256 (2017).
- Shah, A. A., Sjovold, T., Treit, D. Inactivation of the medial prefrontal cortex with the GABA A receptor agonist muscimol increases open-arm activity in the elevated plus-maze and attenuates shock-probe burying in rats. Brain Research. 1028, 112-115 (2004).
- Knight, A. R., et al. Pharmacological characterisation of the agonist radioligand binding site of 5-HT2A, 5-HT2B and 5-HT2C receptors. Naunyn-Schmiedebergs Archiv of Pharmacology. 370, 114-123 (2004).
- Graeff, F. G., Viana, M. B., Mora, P. O. Dual Role of 5-HT in Defense and Anxiety. Neuroscience and Biobehavioral Reviews. 21, 791-799 (1997).
- Cheriyan, J., Sheets, P. L. Altered Excitability and Local Connectivity of mPFC-PAG Neurons in a Mouse Model of Neuropathic Pain. Journal of Neuroscience. 38, 4829-4839 (2018).
- Boyden, E. S., Zhang, F., Bamberg, E., Nagel, G., Deisseroth, K. Millisecond-timescale, genetically targeted optical control of neural activity. Nature Neuroscience. 8, 1263-1268 (2005).

