SerbestÇe Hareket Eden Farelerde Davranışı Modüle Etmek Için Nöronal Aktivitenin Optogenetik Manipülasyonu
Summary
Belirli nöronal popülasyonların veya beyin bölgelerinin optogenetik manipülasyonu ile, davranış serbestçe hareket eden hayvanlarda yüksek zamansal ve mekansal çözünürlük ile değiştirilebilir. Kronik implante optik lifler ile birlikte farklı optogenetik araçlar kullanılarak, nöronal modülasyonlar ve davranışsal testler çeşitli yapılabilir.
Abstract
Serbestçe hareket eden farelerde nöronal devrelerin optogenetik modülasyonu akut ve uzun süreli davranışları etkiler. Bu yöntem, merkezi sinir sisteminde ki tüm nöronal devrelere kadar tek nöronların ve bölgeye özgü verici salınımının manipülasyonlarını gerçekleştirebilmekte ve davranışsal sonuçların doğrudan ölçülmesine olanak sağlamaktadır. Nöronlar, Channelrhodopsin2 (ChR2) gibi tercih edilen DNA’yı taşıyan viral vektörlerin enjeksiyonu yla optogenetik araçları ifade eder. Işık, hedef bölgenin hemen üzerinde sonlandırılabilen kronik optik implantlar aracılığıyla belirli beyin bölgelerine getirilir. Kurtarma ve uygun araç ekspresyonu iki hafta sonra, fareler tekrar tekrar ilgi nöronların optogenetik stimülasyon ile davranıştestleri için kullanılabilir.
Optogenetik modülasyon, kimyasal veya elektriksel stimülasyon gibi yaygın olarak kullanılan yöntemlerle karşılaştırıldığında, yüksek hücre özgüllüğü ile gerçekleştirilebilir yüksek zamansal ve mekansal çözünürlüğe sahiptir. Işık nöronal dokuya zarar vermez ve bu nedenle uzun süreli deneylerin yanı sıra bir farede birden fazla davranışsal deney için de kullanılabilir. Optogenetik araçların olanakları neredeyse sınırsızdır ve tüm nöronların aktivasyonuna veya susturulmasını, hatta belirli bir reseptör tipinin ışıkla manipüle edilmesini sağlar.
Entegre optogenetik stimülasyon ile yapılan bu tür davranışsal deneylerin sonuçları, manipülasyonun neden olduğu davranış değişikliklerini doğrudan görselleştirir. Bir temel olarak ışık stimülasyonu olmadan aynı hayvanın davranışı indüklenen değişiklikler için iyi bir kontrol. Bu nöronal türleri veya nörotransmitter sistemlerinbelirli davranışlar dahil ayrıntılı bir bakış sağlar, anksiyete gibi. Nöronal ağların plastisite de optik stimülasyon sonra uzun vadeli stimülasyon veya davranışsal gözlemler yoluyla ayrıntılı olarak araştırılabilir. Optogenetik nörolojik hastalıkların çeşitli nöronal sinyal aydınlatmak için yardımcı olacaktır.
Introduction
Merkezi sinir sisteminde nöronal devrelerin modülasyonu ve davranışsal sonuçları beynin nasıl çalıştığını anlamak için önemlidir, özellikle psikiyatrik hastalıklar ve öğrenme ve hafıza gibi bilişsel görevler. Optogenetik ile, tek hücre veya hücre popülasyonları kadar tüm devreler ışık tarafından modüle edilebilir. Channelrhodopsin2 (ChR2) veya Archaerhodopsin (Arch) gibi yaygın optogenetik araçlar nöronları etkinleştirmek veya susturmak, ya da artırmak veya farklı beyin bölgelerine projektör terminallerinde verici salınımı inhibe edebiliyoruz1,2,3,4. Ancak, Arch presinaptik terminallerde aktivasyonu spontan vericisalınımınıartırır gösterildiği gibi dikkatle kullanılması gerekir 5 . Arch, hücre içindeki pH değerini değiştiren dışa doğru düzeltici bir proton pompasıdır. Bu alkali ortam kalsiyum akını neden olur ve verici serbestartırır 5. Özellikle hücre içi sinyal yollarını modüle etmek için, rodopsin veya koni opsin gibi hafif bir aktive optogenetik araçtan oluşan reseptör kimeraları, yeterli bir G-protein birleştirilmiş reseptör ile birlikte, oluşturulabilir6,7,8. Mevcut optogenetik araçların miktarı ve varyasyonu son on yılda önemli ölçüde artmıştır9.
Optogenetik amacı davranış sırasında nöronal devreleri manipüle etmektir. Optogenetik, örneğin anksiyete davranışındaki değişiklikler gibi akut davranış değişikliklerinin ölçülmesini sağlar. Optogenetik aletler viral vektörler aracılığıyla beynin hedef bölgelerine ulaştırıldı. Özel organizatörler ve arttırıcılar veya Cre-loxP sistemi yardımıyla, optogenetik araçların ekspresyonu için hücre tipi özgüllüğü sağlanabilir (Şekil 1A). Sadece belirli hücre tiplerinde Cre-Rekombinaz enzimini ifade eden birkaç genetiği değiştirilmiş fare hattı vardır. Örneğin, Nex-Cre fareler Nex-promotor kontrolü altında korteks ve hipokampus piramidal nöronlarda Cre-Rekombimaz ifade10. Bu enzim, loxP kenarları11ile çevrili DNA dizilerini tersine çevirebilir. Sonuç olarak, ters ve loxP taraf tarafından çevrili bir çift floxed optogenetik aracın DNA dizisi, sadece Cre-Rekombinazsahip nöronlar tarafından transkripsiyonu olabilir , ama diğer nöronal türleri tarafından12,13. Nex-Cre fareler durumunda, optogenetik araç sadece piramidal nöronlar ifade edilecektir. Bazı beyin bölgelerinin ışık stimülasyonu daha sonra optik liflerin doğrudan ilgi alanının üzerinde kronik implantasyonu ile elde edilir. Hayvanlar daha sonra uygun bir ışık kaynağına birleştiğinde ve serbestçe davranış testleri hemen hemen her türlü davranış.
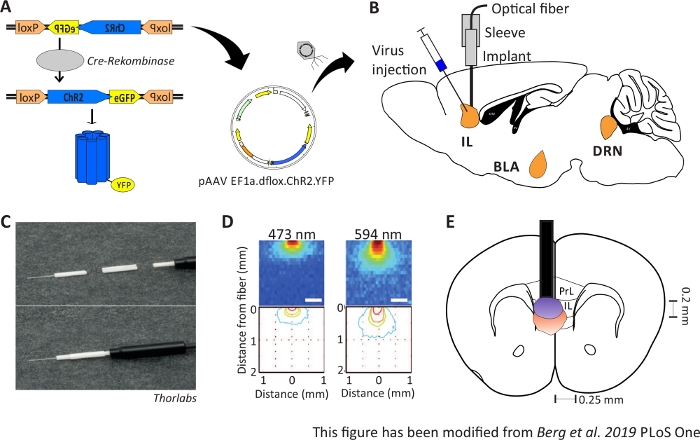
Şekil 1: Enjeksiyon ve implantasyon. A) ChR2-YFP için cre-loxP sistemi. Çift floxed optogenetik araç beyin dokusuiçine enjeksiyon için bir adeno ilişkili virüs (AAV) içinde paketlenir. B) MPFC’nin IL bölgesine/üstüne optik nöronal arayüz enjeksiyonunun ve implantasyonunun sagittal görünümü. Enjeksiyon ve implantasyon yukarıdan yapıldı. Tüm ilgi alanları IL, BLA ve DRN gösterilir. C)İmplante edilen optik fiber, kol ve ışık kaynağının ayrıntılı görünümü. D) Gri madde beyin dokusunda 200 μm ışık lifi ile mavi ve kırmızı lazer ışık stimülasyonunun yayılması (Yizhar ve ark. 2011). Mavi ışık, maksimum, doku içine 0,5 mm, yaklaşık 1 mm kırmızı ışık yayılır. Renk kodlaması: kırmızı %50, sarı %10, yeşil %5, ışık bu alana ulaşırsa mavi %1. E)200 μm optik fiber ile sol IL’nin hemen üzerinde tek taraflı implantasyonun koronal görünümü. IL bölgesi her yarımkürede 0,25 mm genişliğe ve 0,2 mm derinliğe sahiptir. Mavi ve kırmızı ampuller % 5 ışık yayılan yatılı ve Doğru boyuta Yizhar ve ark aktarılır. LoxP: X-over P1 locus; ChR2: Channelrhodopsin; YFP: sarı floresan protein; dflox: çift floxed; IL: infralimbic korteks; BLA: basolateral amigdala; DRN: dorsal raphe çekirdekleri; PrL: prelimbic bölge. Bu rakam Berg 201948’dendeğiştirilmiştir. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
Hem yüksek zamansal hem de mekansal çözünürlük14 ve hücre tipine özgü modülasyon sağlayan optogenetik yaklaşımlardan yararlanılır. Ayrıca, implante edilen cihazı daha fazla tedavi edilmeden tekrar tekrar kullanmak mümkündür. Optogenetik alettaşıyan adeno-ilişkili bir virüsün enjeksiyonu ve optik fiber inplantasyonunun yapıldığı stereotaktik cerrahiden sonra fareler iki hafta boyunca iyileşebilir. Biz sadece 2 haftalık bir iyileşme süresi seçtik, bu ameliyat tan kurtarmak için yeterli zaman çünkü ve virüs ifade etmek için. Davranışsal deneyler immünohistokimya tarafından takip edilir gibi, fareler deney sırasında çok yaşlı olsun emin olmak gerekir; aksi takdirde doku kalitesi azalır. İmplanttan belirgin davranış bozuklukları göstermez ler ve tipik kafes davranışlarına girişinler. Tabii ki, implantasyon önemli bir cerrahi lezyon eşlik eder; bu nedenle, fareler yoğun bir şekilde izlenir. Ameliyattan sonra, grup fareler birbirlerinin taze yaraları ve implantları zarar eğilimindedir gibi, fareler, tek ev olması gerekir. Ancak, konut koşulları erkek farelerin anksiyete düzeyi üzerinde büyük bir etkisi var, tek ev fareler düşük anksiyete düzeyleri göstermek gibi15 ve genel olarak daha az depresif benzeri belirtiler16.
Beyin devrelerinin kimyasal veya elektriksel manipülasyon optogenetik yüksek hücre tipi özgüllüğü eksikliği ve daha düşük bir zamansal ve mekansal çözünürlükvar 14,17,18. Deneysel soruya bağlı olarak, elektrikveya kimyasal stimülasyon farklı avantajlara sahip olabilir. Belirli bir bölgede lif terminalleri geçerken de uyarılması gerekir, elektrikstimülasyon en iyi yöntemdir. Kimyasal stimülasyon, tüm bölgedeki vericiye özgü reseptörlerin agonistler tarafından aktive edilmesi için iyi bir seçimdir. Optogenetik kimyasal veya elektrikstimülasyon ile karşılaştırıldığında bir diğer büyük avantajı, endojen, nöronlar ışığa duyarlı değildir, hangi yan etkilerin oluşumunu önler19. Gerçekten de, yüksek ışık yoğunlukları ısıtma etkileri neden olabilir8,20, ama uygun kontrol grupları nedeniyle, optogenetik manipülasyon nedeniyle davranışsal etkileri ortadan kaldırılabilir.
Kemirgen davranışlarını araştırmak, özellikle psikiyatrik hastalıklar açısından, serbestçe hareket eden hayvanlarda optogenetik ile büyük ölçüde düzelmiştir, belirli hücre popülasyonlarına kadar tek reseptörlerin doğrudan modülasyonu sağlar gibi21 ve devreler22. Bu tür modülasyonların akut etkilerini ölçme imkanı, ayrıca tanımlanmış bir süre23 veya kronik stimülasyon24sonra uzun vadeli davranışsal etkileri , deneysel tasarımları geniş bir esneklik sağlar ve beyin devreleri içine çok ayrıntılı anlayışlar sağlar. Işık stimülasyonu optogenetik aracın enjeksiyon yerinde bulunan nöronları modüle etmek için kullanılabilir. Enjeksiyon ve implantasyon aynı beyin bölgesine hitap ettiğinde, hücre organları ve bu bölgedeki ilke nöronve internöronların aksonları projelendirme3,6,,8hedeflenebilir. Ancak, ışık lifi de enjekte edilenden farklı bir bölgeye yerleştirilmesi olabilir. Bu durumda, ışık stimülasyonu enjekte edilen bölgenin projeksiyon alanlarında akson terminallerinde verici salınımını modüle edebilir25,26,27.
Burada yapılan çalışmada, optogenetik anksiyete ile ilgili davranışları analiz etmek için deneyler ile birlikte kullanılır. Anksiyete ile ilgili psikiyatrik hastalıklar dünya nüfusunun üçte birinden fazlasını etkiler28,29,30 ve yüksek bir ekonomik yük neden31. Bu etkilenen uyarılma hissi muzdarip, gerginlik ve endişe kaçınma davranışı takip32,33. Bu kronik olarak meydana gelen olumsuz duygular, esas olarak gelecekteki olaylar a odaklanmıştır34, güçlü hastaların günlük yaşam ını müdahale. Benzodiazepinler veya selektif serotonin geri alım inhibitörleri gibi yaygın tedaviler (SSRI) sadece bazı hastalarda başarılı. İnsanların büyük bir kısmı tedaviye35yaşında yanıt vermez , bu tür hastalıkların altında yatan mekanizmanın henüz tam olarak anlaşılamadığını gösterir. Medial prefrontal korteks (mPFC) anksiyete gelişimi ve tezahürü önemli bir rol oynadığı bilinmektedir21,25,27,36,37,38. Özellikle, mPFC infralimbic korteks (IL) bölgenin aşırı aktivasyonu anksiyete ile ilgili bozuklukların bir parçası olabilir39,40. Burada açıklanan örnek deney, mPFC’nin IL bölgesindeki modülasyonların anksiyete davranışını nasıl etkilediğini anlamanızda yardımcı olabilir. Ayrıca, anksiyete ile ilgili psikiyatrik hastalıklar için yeni tedavi stratejilerinin geliştirilmesi de potansiyel olarak desteklenebilir.
2-6 aylık erkek Nex-Cre fareler mPFC41IL bölge içinde piramidal nöronlar özellikle ChR2 ifade etmek için kullanılır. Nex-Cre fareler c57Bl/6 arka plana sahiptir ve özellikle piramidal nöronlarda Cre-rekombinaz enzimini ifade eder. Stereotaktik cerrahi sırasında, çift floxed ChR2-DNA adeno ilişkili viral vektörler ile IL bölgeye enjekte edilir. Optik implant ilgi alanının(Şekil 1B)üzerine yerleştirilir ve implant diş çimentosu ile sabitlenir. Kontrol hayvanları hücreye özgü ifadeyi taklit etmek için aynı bölgede çift floxed tdTomato-DNA enjeksiyonu alırlar.
Hayvanlar ameliyat gününe kadar grup içinde dirve daha sonra diğer farelerin yaralanmalarını önlemek için tek kişilik tir. Fareler tek ev fareler için TypI-L kafeslerde bireysel havalandırmalı kafes (IVC) raflarda yer almaktadır. Açık-koyu çevrim 12:12 saat ritmi, 10 başlayan ışık fazı izler. Tüm davranışsal deneyler, kemirgenlerin aktif evresini andıran karanlık evrede gerçekleştirilir. Su ve standart gıda peletleri reklam libitum mevcuttur. Piramidal nöronlarda ChR2’nin yeterli bir ekspresyonunu sağlayan iki haftalık iyileşmeden sonra, fareler davranışsal deneyler için kullanılır.
Açık Alan (OF), 50 cm x 50 cm kare lik bir labirent ve 40 cm yüksekliğinde kum püskürtmeli bir labirenttir. Zemin iç 4 merkezi temsil 16 kareler ayrılmıştır. Ölçülen davranış: 1) merkezde harcanan zaman, 2) merkez girişsayısı ve 3) toplam mesafe taşındı. Bu deney sırasında, toplam 20 dakika süren 4 deneme vardır. 1 ve 3 numaralı çalışmalarda ışık stimülasyonu yapılmaz ve 2 ve 4 numaralı çalışmalarda 5 ms ışık darbesi ve 1 mW ışık yoğunluğu 473 nm olan 20 Hz stimülasyon gerçekleştirilir(Şekil 2A). Daha sonraki çalışmalarda, test alanına alışma dikkate alınmıştır, ancak sahte enjekte kontrol hayvanlarının kullanımı nasıl alışkanlık ifade edilir gösterir.
Barnes Labirent öğrenme ve bellek için bir deneydir. Çapı 92 cm olan ve çevresi etrafında 20 eşit uzaklıkta delik bulunan dairesel bir platformdur. Deliklerden 19’u kapatılır ve bir deliğin altında bir kaçış kutusu sunulur. 4 gün üst üste, fareler kaçış kutusunun yerini öğrenmek için 4 eğitim denemeleri var. 5.th günde, kaçış kutusu kaldırılır ve fareler doğru deliği bulmak için ne kadar zamana ihtiyaçları olduğu test edilir. Ölçülen davranış: 1) Kaçış kutusu/doğru delik bulunana kadar olan süre, 2) Hedef ziyaret ve hata sayısı ve 3) Mesafe kaçış kutusuna kadar taşınır. Farklı gruplardaki ışık stimülasyonu ya 1-4 eğitim günlerinde gerçekleşen satın alma veya konsolidasyon sırasında ya da 5. gün olan test gününde geri alma sırasında yapılır(Şekil 2D).
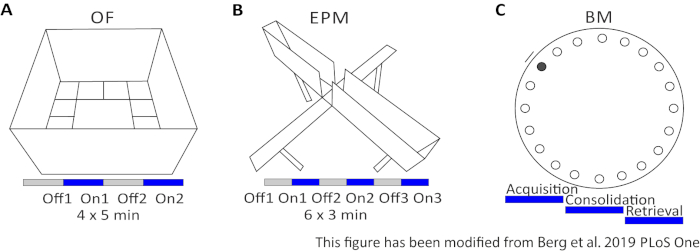
Şekil 2: Optogenetik protokollerle davranışsal deneyler. A) Açık Alan deneyinin ilgili ışık stimülasyon protokolü ile şematik çizimi. C) İlgili ışık stimülasyon protokolü ile Yükseltilmiş Artı Labirent deneyinşematik çizimi. D) Ilgili ışık stimülasyon protokolü ile Barnes Maze deney şematik çizim. EPM: Yükseltilmiş-Plus Labirent; OF: Açık Alan; BM: Barnes Labirent Testi. Bu rakam Berg 201948’dendeğiştirilmiştir. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
Optogenetik stimülasyon için ışık yoğunluğu ve sıklığının araştırılan optogenetik araca ve nöronal tipe uyarlanmalıdır. Dokuya zarar vermemek için mümkün olan en düşük ışık yoğunluğu kullanılmalıdır, çünkü çeşitli çalışmalar güçlü ışık yoğunluğu nedeniyle olası ısıtma etkileri olduğunu göstermiştir8,20. ChR2 için, 5 ms ışık darbesi ile 20 Hz stimülasyon yaygın olarak kullanılır2. ChR2 ışığa oldukça duyarlı olduğundan, 1 mW ışık yoğunluğu yeterlidir. Işık stimülasyon protokolü, davranış değişikliklerini doğrudan ölçmek için ışık kapalı ve denemeler arasında değişir. Davranışsal deneyler için dış oda koşulları hayvanların tüm grup için istikrarlı kalmalıdır. Dikkate alınması gereken önemli koşullar gürültü (cihazların kendilerini gürültü yapabilir akılda tutmak), koku (her zaman etanol ile davranış kurulumları temiz), ışık yoğunluğu, ve deneyci. Deneyci her zaman aynı kişi olmalıdır. Ayrıca, deneylerin gün saati bir gruptaki tüm hayvanlar için aynı olmalıdır, tesiste karanlık fazBaşladıktan birkaç saat sonra tercih edilir.
Bu deneyin amacı, uyarıcı piramidal nöronların güçlü aktivasyonu ile IL bölgesindeki uyarma/inhibisyon (E/I) oranını artırmaktır. Bu özel korteks bölgesinde gelişmiş bir E / I oranı farelerde anksiyete düzeylerini artırmak için bilinmektedir40,42,43,44.
Protocol
Representative Results
Discussion
Nöronal sinyalizasyon işlemek için ışık kullanarak yaklaşık on yıldır tercih edilen bir yöntem olmuştur. 2005 yılından bu yana, yeni optogenetik araçların geliştirilmesi ile ilgili yayınlanan makalelerin sayısı4,6,8,14,49,50,51 ve bu tür araçların beyin devreleri araştırmak için kullanılan çalışmalar21,23,40,43,52, yüksek artmıştır. Bir yandan, enjekte edilebilir optogenetik aletlerin muazzam çeşitliliği, implantasyon varyantları, transgenik fare çizgileri ve davranışsal deneyler, deneyler için olasılık manifoldu ve sınırsızdır. Öte yandan, deneysel koşulların seçiminde hata yapma olasılığı çok yüksektir ve deneyler o kadar spesifiktir ki, genellikle diğer çalışmalarla karşılaştırılabilirlik zordur.
Kritik adımlar
Bu protokolün önemli bir kritik adımı doğru planlamadır. Optogenetik aracın seçimi bilimsel soruyla eşleşmelidir. Sadece bir nöron veya sinaps genel aktivitesini işlemek için gerekli mi? Sonra ticari ChR221,25,,27 ve Arch37 gibi araçlar sağlanan iyi bir seçimdir. Ama bunun dışında, eğer özel bir nörotransmitter sistemi ya da tek bir reseptör manipüle edilmelidir, bireysel bir reseptör chimera genellikle daha iyi birseçim3,6. GPCR ile çeşitli reseptör chimeras, sözde Opto-XRs denir, ve bunları üretmek için kurallar zaten mevcuttur4,50. Optogenetik araçların seçimi dışında, davranışsal deney ile birlikte fare hattı da önemlidir. Farklı arka plan suşları, örneğin C57Bl/6 ve BALB / cByJ gibi, bazı açılardan farklı davranışsal fenotipler görüntülemek53,54. C57Bl/6 farelerdüşük bazal anksiyeteye sahiptir ve anksiyojenik manipülasyon için kullanılabilirken, BALB/cByJ daha yüksek anksiyete düzeyleri gösterir ve bu nedenle anksiyolitik ilaçlara karşı daha duyarlıdır. Ayrıca, bu arka plan suşlarının transgenik varyantları da kendi fenotip48değişebilir. Optogenetik bir alet ve transgenik fare hattı ile birlikte spesifik organizatörlerin uygun bir kombinasyonu ile, hemen hemen her istenilen hücre popülasyonu hedeflenebilir.
Ameliyat sırasında kritik bir adım doğru yeri hedeflemektir. Fare beyin atlası yardımıyla, ön-posterior eksen için uygun koordinatlar, ve medial-lateral eksen, ve yapının derinliği45kurulabilir . Gerçekte, her kafatası biraz farklı bir form ve boyuta sahiptir. Bu nedenle, Stereotaktik koordinatları ayarlamak için F-faktör46 stereotaktik cerrahi sırasında doğru burun ve kulak fiksasyonu olduğu gibi oldukça önemlidir. Farenin başı eğikse, enjeksiyon kanulası istenilen ilgi bölgesini hedeflemede başarısız olur.
Ayrıca, enjeksiyon kanula çapı da önemlidir. Çok küçükse, dokuya virüs salınamaz, çok genişse, kanula virüs çözeltisi sızdıracaktır. İmplante edilen optik fiber hedef bölgenin hemen üzerinde sonlanırsa, yukarıdaki korteks bölgelerindeki virüs ifadesi önemli değildir. Ancak implant akson terminallerini uyarmak için diğer bölgelerin üzerine yerleştirilirse, üst korteks bölgelerinin aksonlarında ışıkla aktive edilecek ve elde edilen verileri tahrif edecektir. Örnek olarak: IL bölgesi ve prelimbic (PrL) bölge bazal amigdala hem proje55,56 ama anksiyete modülasyonu tamamen farklı işlevleri ve rolleri var26,57. İmplant IL bölgesinden akson terminallerini aktive etmek için amigdalanın üzerine yerleştirilirse ve enjeksiyon virüsü çözeltisi de yanlış enjeksiyon kanulası nedeniyle PrL’ye yerleştirilirse, PrL’den akson terminallerinin aktive edilme riski de çok yüksektir.
İmplantfiksasyon için kafatası hazırlanması sırasında, astar ve bağ seyrek kullanımı güvenilir ve dayanıklı bir fiksasyon için çok önemlidir. 2 bileşenli yapışma sistemi ince uygulanmazsa, diş çimentosu birkaç gün veya hafta sonra kafatasından kopabilir. Buna ek olarak, kafatası da tamamen implant sabitleme önce kurutulmalıdır, aksi takdirde çimento kafatası düzgün eklemek olmaz gibi.
Bu protokolün davranışsal kısmında da kritik adımlar vardır. İlk olarak, labirentin inşası çok önemlidir. Her davranışsal kurulumda, çeşitli varyantları literatürde boyut ve form ile ilgili olarak, hem de yordamın kendisi için58,59,60var . Verileri karşılaştırılabilir ve tekrarlanabilir kılan bir varyant seçmek önemlidir. Ayrıca, kullanılan fare hatları için özel gereksinimler dikkate alınmalıdır43,48. EPM’nin temsili verilerinde birkaç Nex-Cre faresinin labirentten düştüğü veya birkaç kez kaydığı görülebilir(Şekil 2b). Bu fareler için, açık kollar etrafında küçük bir duvar ile bir labirent daha iyi bir alternatif olurdu.
İkincisi, tüm dış oda koşulları sabit tutmak için önemlidir61, aksi takdirde farelerin farklı gruplar hiç karşılaştırılabilir olmaz. Bu bakımdan, deney düzeninin boş olduğu ve deneycinin her zaman mevcut olduğu bir zaman olarak deneme zamanını seçmek çok önemlidir. Ayrıca, elde edilen verilere müdahale edilmemesi için binadaki inşaat çalışmaları, herhangi bir sistemlerin test edilmesi (yangın alarmı) veya fare tesisinin temizleme günü gibi olaylar göz önünde bulundurulmalıdır.
Son olarak, kullanım ve barınma koşulları davranışsal deneyler için çok önemlidir. İmplantasyon yapıldığında, diğer farelerin yaralanma riski nedeniyle farelerin tek kişilik olması gerekir. Gruplar arasında iyi bir karşılaştırma ve bir grup içinde düşük hata sağlamak için, her fareaynı kafes boyutu ve zenginleştirme olması gerekir. Anksiyete ile ilgili deneyler için, tek konut singe ev erkek fareler olarak bazı avantajları vardır daha düşük bir temel anksiyete düzeyi göstermek, onların anksiyete düzeyinde daha az varyasyon, ve daha az depresif benzeri belirtiler15,16. Grup erkek fareler güçlü fareler arasındaki hiyerarşi nedeniyle anksiyete düzeyi farklı olabilir. Gövdenin yanı sıra, tüm fare ve grupların sürekli ve eşit şekilde kullanılması da önemlidir. İmplant üzerindeki ışık lifini bağlamak için fareyi kapmak çok streslidir. Bu nedenle, bu yordam her fare için aynı olması gerekir, aynı teknik ve aynı deneyci anlamına gelir. Ayrıca, stresli bağlantı prosedürü aşağı fare sakinleştirmek içindir bekleme kafesi, alışma süresi, aynı zamanda süre, çöp ve labirente pozisyon eşit koşullara sahip olması gerekir. Fare tesisi içinde işleme de daha sonraki davranışsal performans için önemlidir. Deneysel ve kontrol hayvanları farklı günlerde veya farklı insanlar tarafından temizlenmemelidir, bu da fareler için stresli olduğu için. Ayrıca, temizlik günü davranış farklılıklarını önlemek için deneysel gün olmamalıdır.
Sorun giderme
Protokol sırasında oluşabilecek çeşitli sorunlar vardır. Örneğin, stereotaktik cerrahi sırasında kafatasında bir bütün delme kan damarlarızarar verebilir. Genellikle, güçlü kanama oluşur, özellikle bregma ve lambda yukarıda. Bu durumda, onlar emicilik nedeniyle damar dışında daha fazla kanama uzatmak eğilimindedir gibi pamuk çubukları ile kanama durdurmaya çalışmayın, bunun yerine, doğrudan NaCl ile durulamak.
Ayrıca virüs çözeltisinin basınç enjeksiyonu çalışmıyor olabilir. Bu durumda, parafilm olabilir, çapak deliğinden veya beyin dokusundan bir yara, kanula nın ucunu tıkıyor. Bu durumda, x veya y-eksenini değiştirmeden kanula’yı yavaşça beynden çıkarın ve kanula ucunun ön kısmının 1-2 mm’sini çıkarmak için bir cızırtı kullanın. Tekrar kanula düşürmeden önce, virüs canula ucu çıkar olmadığını görmek için basınç küçük miktarda uygulayarak işlevsellik için test edin. Kabızlık önlemek için, sabit bir hız ile kanula düşürmek ve enjeksiyon tarafının en derin derinliğine ulaşılana kadar hareketi durdurmayın. Kanula ucuçok fazla kaldırılır ve çapı çok büyük ise, kanula doku zarar ve aynı anda virüs uygulama riski artacaktır. Böylece, ucun yalnızca tıkanmış kısmının dikkatlice çıkarıldığından emin olun.
Davranışsal deney sırasında, video izleme yazılımındaki (örneğin, Ethovision XT) deneyin kurulumu sorunlara neden olabilir. Örneğin, ışık çıkışı düzgün çalışmıyorsa, bunun nedeni çeşitli nedenlerden olabilir. Pulser, Ethovision XT açılmadan önce açılmalı, programlanmalıdır ve başlatılmalıdır. Donanımın “Deneysel kurulum” (adım 3.2.2.4) doğru şekilde seçilmesi gerekir. Yanlış IO-Box veya “Kostüm Donanımı” dışında bir şey seçilirse, Pulser cihazı Ethovision tarafından kontrol edilemez. Işık çıkışının testi başarılı olursa, ancak “Deneme denetimi ayarları”ndaki programlanmış ışık protokolü satın alma sırasında çalışmıyorsa, alt kural veya alt kural başvurusu yanlış bulunabilir veya koşullar ve eylemler belirsiz olabilir. Örneğin: başvuru doğru alt kurala mı ait? Başvuru doğru programlandı mı (örn. alt kural ne sıklıkta yürütülür)?
Ayrıca, bu “algılama ayarları” sırasında hayvan yeterince izlenir, ancak satın alma sırasında konu bulunamadı örnekleri vardır olabilir. Bu durumda, deney odasındaki aydınlatmanın değiştirilip değiştirilmediğini veya labirentin içinde istenmeyen gölgeler üretilip üretilmediğini kontrol edin. Labirentin tüm alt kısmı aynı renge sahip olmalı, çünkü ayar yalnızca belirli bir kombinasyon için çalışacaktır. Her ne sebeple olursa olsun farklı alt renkler veya gölgeler kaçınılamaz ise, labirentin en karanlık kısmında algılama ayarı tanımlayın.
İlk hayvanların edinimi nden sonra herhangi bir ayarı değiştirmek için, bu değişiklikleri zaten kullanılan ayarlarda uygulamayın. Ayarlamak için kopyalayın. Bu, zaten kaydedilmiş deneme veri çözümlemesi için artık geçerli olmadığı anlamına gelir. Böyle bir durumda, orijinal ayarları ile bu deneysel grup için tüm hayvanları kaydedin ve daha sonra kaydedilen videolar canlı izleme yerine analiz yeni bir deney oluşturun. Bu “videodan” denemesinde, hayvanlar ve hatta veriler arasındaki karşılaştırılabilirliği kaybetmeden analiz için çeşitli ayarlar kullanılabilir.
Sınırlamalar ve gelecekteki uygulamalar
Serbestçe hareket eden hayvanlarda optogenetik ile davranış manipüle Bu yöntem de sınırlamalar içerir. Ameliyat sırasında iki implantın yakınlığı kısıtlanır. Çift implantasyon için, iki implant arasındaki mesafe en az implanttutmak için cihazın genişliği olmalıdır. Cihaz, ilk implantlar zaten sabit iken, çapak deliğine ikinci implant ı düşürmeli. Bunun için bir çözüm açılı bir implantasyon olabilir, cam elyaf uçları çok yakın olabilir kafatası üzerinde seramik ferules daha büyük mesafe varken23,55,56,57,62,63. Açılı bir implantasyonun dezavantajı ışığın yayılmasıdır. Lif ucu düz yukarıdan yerine eğimli olduğunda, uyarılmış alan farklıdır. Yakın mesafede iki hedef bölge olması durumunda, ışık stimülasyonunun değişen konumu göz önünde bulundurulmalıdır.
Davranışsal deney sırasında, labirentin inşası hayvana bağlı optik kabloyu etkileyebilir. Açık-koyu kutu gibi bazı davranış testleri kapalı alan64,65ve diğer labirentler fare nin girmesi gereken bölmeleri içerir. Bu tür denemeler bu kurulumla gerçekleştirilemez. Alternatif olarak, kablosuz sistem bir seçenek22,,26,66olabilir. Ama neyse ki bazı labirentler, Barnes Maze gibi, böyle bir şekilde düzenlenebilir, fareler ilgili bölmeleri girmek edebiliyoruz67.
Kapalı bölgeleri olanların yanı sıra, çok geniş labirentler de sorunlara neden olabilir. Labirentin alanı ne kadar genişse, kablonun hayvanın labirentteki her pozisyona gitmesine izin vermek için o kadar uzun olması gerekir. Hayvanın kabloya basamaz, yakap ısıramaz. Bunun için bir çözüm gereksiz kablo yuvarlanır bir yapı olabilir. Bir dezavantajı kabloyu boşaltmak için sürükleme fareler için zor olmasıdır. Bu çözüm fareler için uygun daha iyi olur. Başka bir olası seçenek önceden ışık stimülasyon yapmak olabilir, deneme sırasında yerine, tabii ki bu sadece ışık stimülasyonu nedeniyle uzun vadeli bir etki oluşur seve si uygulanabilir23.
Mevcut/alternatif yöntemlerle karşılaştırma
Alternatif yöntemler davranış sırasında kimyasal veya elektriksel stimülasyon olacaktır8,18. Kimyasal agonistler veya antagonistler ivel reseptörler aracılığıyla nöronları etkinleştirmek veya susturmak edebiliyoruz ve aynı zamanda tek nörotransmitter sistemleri,38,68manipüle edebilirsiniz. Bir yandan, reseptör özgüllüğü kimyasallar için oldukça yüksektir, çünkü spesifik agonist veya antagonist sadece bazı reseptörleri etkinleştirmek39. Öte yandan, aynı nörotransmitter grubunun reseptör alt tipleri için özgüllük genellikle yetersizdir. Çoğu kimyasal farklı olasılıklar69ile en az iki alt tipe bağlanır. Ayrıca, kimyasallar aynı reseptör tiplerine sahip oldukları sürece nöronal hücre tiplerini ayırt edemezler. Bunun ötesinde, zamansal ve mekansal çözünürlük optogenetik göre kimyasal manipülasyonlar için kötüdür. Agonistler veya antagonistler genellikle sözlü olarak uygulanır35 veya sistemik enjeksiyonlar yoluyla57,70. Kimyasal infüzyon doğrudan beyin dokusunda yapılırsa, etkileri oral uygulamalar ile daha hızlı görünür, ama yine de ışık stimülasyonu ile daha yavaş bir zaman ölçeğinde. Uygulanan kimyasallar beyinde yaygın ve nöronal türleri veya beyin bölgeleri için özel değildir gibi, belirli beyin devrelerinin manipülasyon mümkün değildir.
Elektriksel stimülasyon, kimyasal stimülasyondan daha yüksek bir zamansal çözünürlüğe sahiptir9,14. Nöronal doku içinde yayılması kimyasal stimülasyon ile daha az dır ve mekansal çözünürlük kimyasal stimülasyon ile daha iyidir. Ancak, elektrikstimülasyon özellikle farklı nöronal hücre tipleri veya reseptör tipleri ele olasılığı yoksun, elektrot yakın her nöron elektriksel uyarılma yanıt verecektir gibi.
Serbestçe hareket eden farelerde davranışa alternatif yöntemler, örneğin tek nöronların veya aksonların optogenetik ile modüle edilebildiği ve ortaya çıkarılan etkilerin kayıt elektrotları6,71ile ölçülebildiği beyin dilimlerindeki elektrofizyolojik kayıtlardır. In vitro deneyler optogenetik stimülasyonların moleküler ve hücresel temelini araştırma olanağı sunar, ancak diğer beyin bölgelerinden gelen içsel bağlantı ve girdinin eksik olduğu sınırlamasına sahiptir. Başka bir seçenek multifotongörüntüleme,1 ,72ile birlikte optogenetik kullanmaktır. Bu durumda, farelerin başsabit ve anestezi veya basit görevleri çözmek için uyanık olabilir.
Başarılı bir optogenetik deney gerçekleştirmek için, araç ve uygulamalar geniş bir yelpazede günümüzde mevcuttur. Optogenetik araçların seçimi ve davranışsal kurulum belirli araştırma sorularını yanıtlamak için çok önemlidir. Eğer aletlerin ve deneylerin doğru kombinasyonu seçilirse, optogenetik yüksek zamansal ve uzamsal çözünürlüğe sahip nöronal devrelerin daha önce görülmemiş, derinlemesine araştırılmasına olanak sağlar. Bu anlamak ve psikiyatrik hastalıklar ve biliş için yeni tedavi stratejileri geliştirmeye yardımcı olacaktır.
Disclosures
The authors have nothing to disclose.
Acknowledgements
Prof Klaus-Armin Narve ve Dr Sandra Goebbels (Max-Plank-Deneysel Tıp Enstitüsü, Goettingen, Almanya) nazik Nex-Cre fareler sağlamak için büyük teşekkür ederiz. Ayrıca, video ekibimiz Yunus Dikici ve Ruben Wiesner’e bu makale için JoVE videosunun kaydedilmesi ve işlenmesi için teşekkür ederiz. Buna ek olarak, kristin Claussen onu seslendirme ve Kimberly Anne Go için el yazması redreading için büyük teşekkürler.
Sunulan sonuçlar Bochum’daki Ruhr-Üniversitesi’nde elde edildi ve video Bremen Üniversitesi’nde kaydedildi.
Bu çalışma Deutsche Forschungsgemeinschaft (DFG, Alman Araştırma Vakfı) – Projektnummer 122679504 – SFB 874 ve DFG MA 4692/3-2 tarafından finanse edilmiştir.
Materials
| Ketamin | Sigma-Aldrich | K2753-64 | Anestasia |
| 20 % Glucose | AlleMan Pharma | Injection s.c. for fast recovery | |
| Behavioral mazes | Costum made | Measure anxiety | |
| Bepanthen | Bayer | Ophthalmic oinment | |
| Betaisodona | Monodipharma | Sterilant containing iodine | |
| Betaisodona | Monodipharma | Iodine oinment | |
| Binocular | Olympus | SZ52, 110AL0.62x WD160 | Surgery |
| Ceramic ferrules | Thorlabs | CFLC230-10 | Implant |
| Ceramic Fiber Scribe | Thorlabs | CSW12.5 | Cutting of the glass fiber |
| Channelrhodopsin2-YFP virus | Penn Vector Core | Addgene 20298 | Optogenetic tool |
| Compressed air | Kontakt Chemie | Druckluft 67 | Drying of the skull |
| Coordinate system | Stoelting | Stereotactic coordinates for the surgery | |
| Correl Draw | Graphical software version 13 | ||
| Cryoslicer | MICROM | HM500OM | Production of brain slices for staining |
| Ethovision XT 14 | Noldus | Software for behavioral tracking | |
| Exel | Statistical Software | ||
| Ferrule Polishing Puck | Thorlabs | D50-F | Polishing implants round side |
| Fiber Patch Cord dual | Prizmatix | Optogenetics-Fiber 500, 1,20 m, Ferrule core 1,25 mm | Cables, which are connected with the two implants of a bilateral implantation |
| Fiber Patch Cord single | Prizmatix | Optogenetics-Fiber 500, 1,20 m, Ferrule core 1,25 mm | Cable, which is connected with the implant via a sleeve |
| Fiber Stripping Tool | Thorlabs | T06S13 | Stripping glass fiber for implant |
| Filter paper | VWR European | 516-0300 | Cut into pieces for the Novelty-Suppressed Feeding test |
| Food pellets | Mühle Levers | Höveler Nagerfutter | Nutrition for the mice |
| Glass pipettes | Harvard Apparatus | GC150-10 | Injection pipettes |
| Gradia direct-Flo | Henry Schein | 103322 | Fluid dental cementum |
| Heating lamp | efbe-Schott/Phillips | R95E | Prevent the mice from cooling after the surgery |
| Heating plate | Stoelting | Integrated into coordinate system | |
| Injection canula | Braun | 100 Sterican, 0,4 x 20 mm, Gr. 20 | All injections and to bore hole into the skull |
| Litter | T 1350 | Grounding for the Novelty-Supressed Feeding test | |
| Mouse cages | Zoonlab | 405 cm^2 | Single housing for experiments |
| Optibond FL | Kerr | 26684E | Preparation of the skull for implantation |
| Optical glass fiber | Thorlabs | FT200EMT | Light fiber for implant |
| Optogenetics-LED.STSI | Prizmatix | Optogenetic toolbox for light stimulation during behavioral experiments | |
| Paraformaldehyde | Sigma-Aldrich | 16005-1KG-R | Perfusion of mice to remove the brains |
| Polishing sheet 0.02 µm grit | Thorlabs | LFCF | Polishing implants round side |
| Polishing sheet 1 µm grit | Thorlabs | LF1D | Polishing implants round side |
| Polishing sheet 30 µm grit | Thorlabs | LF30D | Polishing implants round side |
| Polishing sheet 6 µm grit | Thorlabs | LF6D | Polishing implants round side |
| Pulser Software | Prizmatix | Software for light device control | |
| Rimadyl-Carprofen | Zoetis | Analgesia | |
| Sigma Plot | Software for statistics | ||
| Sleeve | Thorlabs | FT200EMT | Connection of implant and light cable |
| SodiumCloride (NaCl) | Braun | 3570410 | Rinsing of the skull |
| Superglue | Pattex Henkel | To Fix the glass fiber in the ferrule | |
| td-Tomato virus | Penn Vector Core | Addgene 51503 | Optogenetic tool |
| UV light | KoQGHJ | wireless, 1200 mW/cm^2 | Polymeration lamp for dental cementum |
| Xylavet-Xylazin | cp pharma | Anesthesia |
References
- Chow, B. Y., et al. High-performance genetically targetable optical neural silencing by light-driven proton pumps. Nature Letters. 463, 98-102 (2010).
- Zhao, S., et al. Cell type-specific channelrhodopsin-2 transgenic mice for optogenetic dissection of neural circuitry function. Nature Methods. 8, 745-752 (2011).
- Spoida, K., Masseck, O. A., Deneris, E. S., Herlitze, S. Gq/5-HT2c receptor signals activate a local GABAergic inhibitory feedback circuit to modulate serotonergic firing and anxiety in mice. Proceedings of the National Academy of Science of the United States of America. 111, 6479-6484 (2014).
- Kleinlogel, S. Optogenetic user’s guide to Opto-GPCRs modified GPCRs. Frontiers in Bioscience. 21, 794-805 (2016).
- Mahn, M., Prigge, M., Ron, S., Levy, R., Yizhar, O. Biophysical constraints of optogenetic inhibition at presynaptic terminals. Nature Neuroscience. 19, 554-556 (2016).
- Masseck, O. A., et al. Vertebrate Cone Opsins Enable Sustained and Highly Sensitive Rapid Control of Gi/o Signaling in Anxiety Circuitry. Neuron. 81, 1263-1273 (2014).
- Oh, E., Maejima, T., Liu, C., Deneris, E., Herlitze, S. Substitution of 5-HT 1A Receptor signaling by a light-activated G protein-coupled receptor. Journal of Biological Chemistry. 285, 30825-30836 (2010).
- Yizhar, O., Fenno, L. E., Davidson, T. J., Mogri, M., Deisseroth, K. Optogenetics in Neural Systems. Neuron Primer. 71, 9-34 (2011).
- Masseck, O. A., Manahan-Vaughan, D. A Guide to Optogenetic Applications, With special Focus on Behavioral and In Vivo Electrophysiological Experiments. HandboOk of In Vivo Neural Plasticity Techniques – A Systems Neuroscheince Approach to the Neural Basis of Memory and Cognition. , 557 (2019).
- Goebbels, S., et al. Genetic Targeting of Principal Neurons in Neocortex and Hippocampus of NEX-Cre Mice. Genesis. , 611-621 (2006).
- Yang, Y. S., Hughes, T. E. Cre Stoplight: A red/green fluorescent reporter of Cre recombinase expression in living cells. Biotechniques. 31, 1036-1041 (2001).
- Schnütgen, F., et al. A directional strategy for monitoring Cre-mediated recombination at the cellular level in the mouse. Nature Biotechnology. 21, 562-565 (2003).
- Taniguchi, H., et al. A Resource of Cre Driver Lines for Genetic Targeting of GABAergic Neurons in Cerebral Cortex. Neuron. 71, 995-1013 (2011).
- Deisseroth, K. Optogenetics. Nature Methods. 8, 268-273 (2011).
- Palanza, P., Gioiosa, L., Parmigiani, S. Social stress in mice: Gender differences and effects of estrous cycle and social dominance. Physiology and Behavior. 73, 411-420 (2001).
- Karolewicz, B., Paul, I. A. Group housing of mice increases immobility and antidepressant sensitivity in the forced swim and tail suspension tests. European Journal of Pharmacology. 415, 197-201 (2001).
- Masseck, O. A., Rubelowski, J. M., Spoida, K., Herlitze, S. Light- and drug-activated G-protein-coupled receptors to control intracellular signalling. Experimental Physiology. 96, 51-56 (2011).
- Aravanis, A. M., et al. An optical neural interface: in vivo control of rodent motor cortex with integrated fiberoptic and optogenetic technology. Journal of Neural Engineering. 4, (2007).
- Zhang, F., et al. Multimodal fast optical interrogation of neural circuitry. Nature Article. 446, 633-639 (2007).
- Owen, S. F., Liu, M. H., Kreitzer, A. C. Thermal constraints on in vivo optogenetic manipulations. Nature Neuroscience. 22, 1061-1065 (2019).
- Hare, B. D., et al. Optogenetic stimulation of medial prefrontal cortex Drd1 neurons produces rapid and long-lasting antidepressant effects. Nature Communication. 10, 1-12 (2019).
- Allsop, S. A., Vander Weele, C. M., Wichmann, R., Tye, K. M. Optogenetic insights on the relationship between anxiety-related behaviors and social deficits. Frontiers in Behavioral Neuroscience. 8, 1-14 (2014).
- Fuchikami, M., et al. Optogenetic stimulation of infralimbic PFC reproduces ketamine’s rapid and sustained antidepressant actions. Proceedings of the National Academy of Science of the United States of America. 112, 8106-8111 (2015).
- Correia, P. A., et al. Transient inhibition and long-term facilitation of locomotion by phasic optogenetic activation of serotonin neurons. Elife. 6, 1-26 (2017).
- Felix-Ortiz, A. C., Burgos-Robles, A., Bhagat, N. D., Leppla, C. A., Tye, K. M. Bidirectional modulation of anxiety-related and social behaviors by amygdala projections to the medial prefrontal cortex. Neuroscience. 321, 197-209 (2016).
- Marek, R., Xu, L., Sullivan, R. K. P., Sah, P. Excitatory connections between the prelimbic and infralimbic medial prefrontal cortex show a role for the prelimbic cortex in fear extinction. Nature Brief Communication. , (2018).
- Parfitt, G. M., et al. Bidirectional Control of Anxiety-Related Behaviors in Mice: Role of Inputs Arising from the Ventral Hippocampus to the Lateral Septum and Medial Prefrontal Cortex. Neuropsychopharmacology. 42, 1715-1728 (2017).
- Bandelow, B., Michaelis, S. Epidemiology of anxiety disorders in the 21st century. Dialogues in Clinical Neuroscience. 17, 327-335 (2015).
- Kessler, R. C., et al. Lifetime Prevalence and Age-of-Onset Distributions of DSM-IV Disorders in the National Comorbidity Survey Replication. Archives of General Psychiatry. 62, 593-602 (2005).
- Kessler, R. C., Petukhova, M., Sampson, N. A., Zaslavsky, A. M., Wittchen, H. U. Twelve-month and lifetime prevalence and lifetime morbid risk of anxiety and mood disorders in the United States. International Journal of Methods Psychiatric Research. 21, 169-184 (2014).
- Andlin-Sobocki, P., Wittchen, H. U. Cost of anxiety disorders in Europe. European Journal of Neurology. 12, 39-44 (2005).
- Forster, G. L., Novick, A. M., Scholl, J. L., Wall, M. J. The Role of the Amygdala in Anxiety Disorders. Intech. , 61-102 (2012).
- Liberzon, I. Neural circuits in anxiety and stress disorders a focused review. Therapeutics and Clinical Risk Management. 11, 115-126 (2015).
- Sylvers, P., Lilienfeld, S. O., LaPrairie, J. L. Differences between trait fear and trait anxiety: Implications for psychopathology. Clinical Psychology Review. 31, 122-137 (2011).
- Daws, L. C., Koek, W., Mitchell, N. C. Revisiting Serotonin Reuptake Inhibitors and the Therapeutic Potential of ‘Uptake-2’ in Psychiatric Disorders. ACS Chemical Neuroscience. 4, 16-21 (2013).
- Felix-Ortiz, A. C., et al. BLA to vHPC inputs modulate anxiety-related behaviors. Neuron Report. 79, 658-664 (2013).
- Padilla-Coreano, N., et al. Direct Ventral Hippocampal-Prefrontal Input Is Required for Anxiety-Related Neural Activity and Behavior. Neuron Article. 89, 857-866 (2016).
- Lisboa, S. F., Stecchini, M. F., Corrêa, F. M. A., Guimarães, F. S., Resstel, L. B. M. Different role of the ventral medial prefrontal cortex on modulation of innate and associative learned fear. Neuroscience. 171, 760-768 (2010).
- Bi, L. L., et al. Enhanced excitability in the infralimbic cortex produces anxiety-like behaviors. Neuropharmacology. 72, 148-156 (2013).
- Yizhar, O., et al. Neocortical excitation/inhibition balance in information processing and social dysfunction. Nature Article. 477, 171-178 (2011).
- Goebbels, S., et al. Genetic Targeting of Principal Neurons in Neocortex and Hippocampus of NEX-Cre Mice. Genesis. 44, 611-621 (2006).
- Rubenstein, J. L. R., Merzenich, M. M. Model of autism: increased ratio of excitation/ inhibition in key neural systems. Genes, Brain and Behavior. 2, 255-267 (2003).
- Berg, L., Eckardt, J., A, M. O. Enhanced activity of pyramidal neurons in the infralimbic cortex drives anxiety behavior. PLoS One. 14, 1-19 (2019).
- Meunier, C. N. J., Amar, M., Lanfumey, L., Hamon, M., Fossier, P. 5-HT1A receptors direct the orientation of plasticity in layer 5 pyramidal neurons of the mouse prefrontal cortex. Neuropharmacology. 71, 37-45 (2013).
- Paxinos, G., Franklin, K. B. J., Paxinos, G., Franklin, K. B. J., Paxinos, G., Franklin, K. B. J. . Mouse Brain in Stereotaxic Coordinates. 2, (2004).
- Gore, B. B., Soden, M. E., Zweifel, L. S. Manipulating gene expression in projection-specific neuronal populations using combinatorial viral approaches. Current Protocols in Neuroscience. 435, 1-6 (2014).
- Stujenske, J. M., Spellman, T., Gordon, J. A. Modeling the Spatiotemporal Dynamics of Light and Heat Propagation for InVivo Optogenetics. Cell Report. 12, 525-534 (2015).
- Berg, L. Imbalance of excitation and inhibition within the prefrontal cortex supports anxiety behavior. Ruhr-University Bochum. , (2019).
- Boyden, E. S. A history of optogenetics: The development of tools for controlling brain circuits with light. F1000 Biology Reports. 3, 1-12 (2011).
- Airan, R. D., Thompson, K. R., Fenno, L. E., Bernstein, H., Deisseroth, K. Temporally precise in vivo control of intracellular signalling. Nature. 458, 1025-1029 (2009).
- Sparta, D. R., et al. Construction of implantable optical fibers for long-term optogenetic manipulation of neural circuits. Nature Protocol. 7, 12-23 (2012).
- Covington, H. E., et al. Antidepressant Effect of Optogenetic Stimulation of the Medial Prefrontal Cortex. Journal of Neuroscience. 30, 16082-16090 (2010).
- Lepicard, E. M., Joubert, C., Hagneau, I., Perez-Diaz, F., Chapouthier, G. Differences in anxiety-related behavior and response to diazepam in BALB/cByJ and C57BL/6J strains of mice. Pharmacology, Biochemistry and Behavior. 67, 739-748 (2000).
- Schmidt, M. V., Müller, M. B. Animal models of anxiety. Elsevier. 3, 369-374 (2006).
- Cho, J. H., Deisseroth, K., Bolshakov, V. Y. Synaptic Encoding of Fear Extinction in mPFC-amygdala Circuits. Neuron Article. 80, 1491-1507 (2013).
- Adhikari, A., et al. Basomedial amygdala mediates top-down control of anxiety and fear. Nature. 527, 179-185 (2015).
- Suzuki, S., et al. The infralimbic and prelimbic medial prefrontal cortices have differential functions in the expression of anxiety-like behaviors in mice. Behavioural Brain Research. 304, 120-124 (2016).
- Carola, V., D’Olimpio, F., Brunamonti, E., Mangia, F., Renzi, P. Evaluation of the elevated plus-maze and open-field tests for the assessment of anxiety-related behaviour in inbred mice. Behavioural Brain Research. 134, 49-57 (2002).
- Prut, L., Belzung, C. The open field as a paradigm to measure the effects of drugs on anxiety-like behaviors: A review. European Journal of Pharmacology. 463, 3-33 (2003).
- Tye, K. M., et al. Amygdala circuitry mediating reversible and bidirectional control of anxiety. Nature Letter. 471, 358-362 (2011).
- Bouwknecht, J. A., et al. Differential effects of exposure to low-light or high-light open-field on anxiety-related behaviors: Relationship to c-Fos expression in serotonergic and non-serotonergic neurons in the dorsal raphe nucleus. Brain Research Bulletin. 72, 32-43 (2007).
- Overstreet, D. H., Knapp, D. J., Angel, R. A., Navarro, M., Breese, G. R. Reduction in repeated ethanol-withdrawal-induced anxiety-like behavior by site-selective injections of 5-HT1A and 5-HT2C ligands. Psychopharmacology. 187, 1-12 (2006).
- Takahashi, A., et al. Glutamate Input in the Dorsal Raphe Nucleus As a Determinant of Escalated Aggression in Male Mice. Journal of Neuroscience. 35, 6452-6463 (2015).
- Klemenhagen, K. C., Gordon, J. A., David, D. J., Hen, R., Gross, C. T. Increased Fear Response to Contextual Cues in Mice Lacking the 5-HT1A Receptor. Neuropsychopharmacology. 31, 101-111 (2006).
- Ramos, A. Animal models of anxiety: do I need multiple tests. Trends in Pharmacological Science. 29, 493-498 (2008).
- Isosaka, T., et al. Htr2a-Expressing Cells in the Central Amygdala Control the Hierarchy between Innate and Learned Fear. Cell. 163, 1153-1164 (2015).
- Regev, L., Goshen, I. Employing Optogenetics in Memory Research. Optogenetics: A Roadmap. , 219-256 (2017).
- Shah, A. A., Sjovold, T., Treit, D. Inactivation of the medial prefrontal cortex with the GABA A receptor agonist muscimol increases open-arm activity in the elevated plus-maze and attenuates shock-probe burying in rats. Brain Research. 1028, 112-115 (2004).
- Knight, A. R., et al. Pharmacological characterisation of the agonist radioligand binding site of 5-HT2A, 5-HT2B and 5-HT2C receptors. Naunyn-Schmiedebergs Archiv of Pharmacology. 370, 114-123 (2004).
- Graeff, F. G., Viana, M. B., Mora, P. O. Dual Role of 5-HT in Defense and Anxiety. Neuroscience and Biobehavioral Reviews. 21, 791-799 (1997).
- Cheriyan, J., Sheets, P. L. Altered Excitability and Local Connectivity of mPFC-PAG Neurons in a Mouse Model of Neuropathic Pain. Journal of Neuroscience. 38, 4829-4839 (2018).
- Boyden, E. S., Zhang, F., Bamberg, E., Nagel, G., Deisseroth, K. Millisecond-timescale, genetically targeted optical control of neural activity. Nature Neuroscience. 8, 1263-1268 (2005).

