הדמיה חיה בעלת תפוקה גבוהה של מיקרוקולוניות למדידת הטרוגניות בצמיחה ובביטוי גנים
Summary
פנוטיפים של צמיחת שמרים נמדדים במדויק באמצעות הדמיה מקבילה מאוד של תאים משותקים הגדלים למיקרוקולוניות. במקביל, ניתן לעקוב אחר עמידות ללחץ, ביטוי חלבון ולוקליזציה של חלבונים, וליצור ערכות נתונים משולבות כדי לחקור כיצד הבדלים סביבתיים וגנטיים, כמו גם הטרוגניות של ביטוי גנים בקרב תאים איסוגניים, מווסתים את הצמיחה.
Abstract
מדידות מדויקות של הטרוגניות בין ומתח בתוך זן בשיעורי צמיחה מיקרוביאלית חיוניות להבנת תשומות גנטיות וסביבתיות לסובלנות מתח, פתוגניות ורכיבי מפתח אחרים של כושר. כתב יד זה מתאר בדיקה המבוססת על מיקרוסקופ העוקבת אחרכ-10 5מיקרוקולוניותסכרומיאציות של Saccharomyces בכל ניסוי. לאחר הדמיה אוטומטית של שמרים משותקים בצלחת מרובת גלים, שיעורי הצמיחה של מיקרו-מושבה מנותחים בקלות באמצעות תוכנה מותאמת אישית לניתוח תמונות. עבור כל מיקרו-מושבה, ניתן גם לעקוב אחר ביטוי ולוקליזציה של חלבונים פלואורסצנטיים והישרדות של מתח חריף. בדיקה זו מאפשרת הערכה מדויקת של שיעורי הצמיחה הממוצעים של הזנים, כמו גם מדידה מקיפה של הטרוגניות בצמיחה, ביטוי גנים וסובלנות מתח בתוך אוכלוסיות שיבוטים.
Introduction
פנוטיפים לצמיחה תורמים באופן קריטי לכושר שמרים. הברירה הטבעית יכולה להבחין ביעילות בין שושלת עם שיעורי צמיחה שונים על ידי ההופכי של גודל האוכלוסייה האפקטיבי, אשר יכול לחרוג 108 אנשים1. יתר על כן, שונות בשיעורי הצמיחה בקרב אנשים בתוך אוכלוסייה היא פרמטר רלוונטי מבחינה אבולוציונית, שכן הוא יכול לשמש כבסיס לאסטרטגיות הישרדות כגון גידור הימור2,3,4,5,6. לכן, מבחנים המאפשרים מדידות מדויקות מאוד של פנוטיפים צמיחה והתפלגותם הם מרכזיים לחקר מיקרואורגניזמים. מבחני הצמיחה של המיקרו-מושבה המתוארים כאן יכולים ליצור מדידות קצב צמיחה פרטניות עבור ~ 105 מיקרוקולוניות לכל ניסוי. בדיקה זו מספקת אפוא פרוטוקול רב עוצמה לחקר הגנטיקה והגנומיקה האבולוציונית של השמרים. זה משאיל את עצמו טוב במיוחד כדי לבדוק כיצד שונות בתוך אוכלוסיות של תאים בודדים זהים גנטית נוצר, מתוחזק, ותורם כושר האוכלוסייה7,8,9,10.
השיטה המתוארת כאן (איור 1) משתמשת מעת לעת בתמונות brightfield בעלות הגדלה נמוכה של תאים הגדלים במדיה נוזלית על צלחת תחתית זכוכית של 96 או 384 באר כדי לעקוב אחר צמיחה למיקרוקולוניות. התאים נצמדים ללקטין קונקאנאבלין A, אשר מצופה את החלק התחתון של צלחת המיקרוסקופ, ויוצרים מושבות דו מימדיות. מכיוון שהמיקרוקולוניות גדלות במונולייר, אזור המיקרו-מושבה מתואם מאוד עם תא מספר7. לכן, הערכות מדויקות של קצב הצמיחה של מיקרו-מושבה וזמן השהיה יכולות להיווצר באמצעות תוכנה מותאמת אישית לניתוח תמונות העוקבת אחר קצב השינוי של האזור של כל מיקרו-מושבה. יתר על כן, ההתקנה הניסיונית יכולה לפקח על השפע ואפילו על לוקליזציות תת-תאיות של חלבונים בעלי תווית פלואורסצנטית המתבטאים במיקרוקולוניות אלה. עיבוד במורד הזרם של נתונים ממערך צמיחה מיקרו-מושבה זה יכול להיות מושגת על ידי ניתוח מותאם אישית או על ידי תוכנה קיימת לניתוח תמונה, כגון עיבוד תמונות בקלות (PIE)11, אלגוריתם לזיהוי אזור מושבה חזק וניתוח צמיחה בתפוקה גבוהה מהגדלה נמוכה, תמונות brightfield, אשר זמין באמצעות GitHub12.
מכיוון שהערכות קצב הצמיחה הנגזרות ממסירת הצמיחה של מיקרו-מושבה נוצרות ממספר רב של מדידות חד-מושבתיות, הן מדויקות ביותר, עם שגיאות סטנדרטיות במספר סדרי גודל קטנים יותר מההערכות עצמן לניסוי בגודל סביר. לכן, כוחה של ההסתעפות לזהות הבדלי קצב צמיחה בין גנוטיפים שונים, טיפולים או תנאים סביבתיים הוא גבוה. הפורמט multiwell-צלחת מאפשר שילובים רבים ושונים סביבה וגנוטיפ להיות מושווה בניסוי אחד. אם זנים מבטאים באופן מכונן סמנים פלואורסצנטיים שונים, הם עשויים להיות מעורבים באותה באר ומאופיינים על ידי ניתוח תמונה עוקב, אשר יכול להגדיל את הכוח עוד יותר על ידי מתן נורמליזציה נתונים היטב.
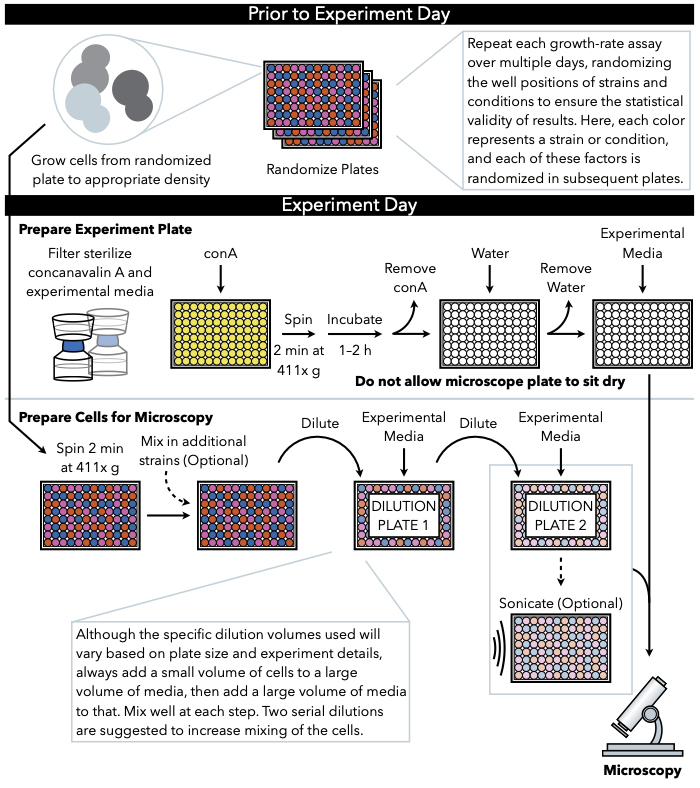
איור 1: ייצוג סכמטי של הפרוטוקול. פרוטוקול זה עוקב אחר שני שלבים עיקריים, שהם הכנת צלחת הניסוי והכנת התאים לתמונה. אקראיות של צלחות וצמיחה של תאים צריך להתבצע לפני ומוביל ליום הניסוי. ערבוב חוזר ונשנה של תאים בכל שלב במהלך הדילול הוא הכרחי בשלבים עד לציפוי, ולכן מומלץ להכין את צלחת הניסוי תחילה, כך שהוא מוכן לציפוי מיד עם השלמת דילול התא. לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.
Protocol
Representative Results
Discussion
הפרוטוקול המתואר כאן הוא מבחנים רב-תכליתיים המאפשרים מעקב אחר צמיחת תאים וביטוי גנים בו זמנית ברמה של מיקרוקולוניות בודדות. שילוב שתי שיטות אלה מניב תובנות ביולוגיות ייחודיות. לדוגמה, עבודה קודמת השתמשה ב- assay זה כדי להראות מתאם שלילי בין ביטוי של הגן TSL1 לבין קצב הצמיחה של מיקרו-מושבה …
Disclosures
The authors have nothing to disclose.
Acknowledgements
אנו מודים לנעמי זיו, סשה לוי ושואנג לי על תרומתם לפיתוח פרוטוקול זה, לדוד גרשם על הציוד המשותף, ומריסה קנול על העזרה בהפקת וידאו. עבודה זו נתמכה על ידי המכונים הלאומיים לבריאות מענק R35GM118170.
Materials
| General Materials | |||
| 500 mL Bottletop Filter .22 µm PES Sterilizing, Low Protein Binding, w/45mm Neck | Fisher | CLS431154 | used to filter the media |
| BD Falcon*Tissue Culture Plates, microtest u-bottom | Fisher | 08-772-54 | 96-well culture tubes used to freeze cells, pre-grow cells, and dilutions |
| BD Syringes without Needle, 50 mL | Fisher | 13-689-8 | Used to filter the Concanavalin A |
| Costar Sterile Disposable Reagent Reservoirs | Fisher | 07-200-127 | reagent reservoirs used to pipette solutions with multichannel pipette |
| Costar Thermowell Aluminum Sealing Tape | Fisher | 07-200-684 | 96-well plate seal for pre-growth and freezing |
| lint and static free Kimwipes | Fisher | 06-666A | lint and static free wipes to keep microscope plate bottom free of debris and scratches |
| Nalgene Syringe Filters | ThermoFisher Scientific | 199-2020 | 0.2 μm pore size, 25 mm diameter; used to filter concanavalin A solution |
| Media Components | |||
| Minimal chemically defined media (MD; 2% glucose) | alternative microscopy media used for yeast pre-growth and growth during microscopy | ||
| Synthetic Complete Media (SC; 2% glucose) | microscopy media used for yeast pre-growth and growth during microscopy | ||
| Yeast extract-peptone-dextrose (YEPD; 2% glucose) medium | cell growth prior to freezing down randomized plates | ||
| Microscopy Materials | |||
| Breathe-Easy sealing membrane | Millipore Sigma | Z380059-1PAK | breathable membranes used to seal plate during microscopy experiment. At this stage breathable membranes are reccomended because they prevent condensation in the wells and allow for better microscopy images |
| Brooks 96-well flat clear glass bottom microscope plate | Dot Scientific | MGB096-1-2-LG-L | microscope plate |
| Concanavalin A from canavalia ensiformis (Jack Bean), lyophilized powder | Millipore Sigma | 45-C2010-1G | Make 5x concanavalin A solution and freeze 5ml of 5x concanavalin A in 50 mL conical tubes at -80 °C |
| Strains Used | |||
| MAH.5, MAH.96, MAH.52, MAH.66, MAH.11, MAH.58, MAH.135, MAH.15, MAH.44, MAH.132 | Haploid mutation accumulation strains in a laboratory background, described in Hall and Joseph 2010 | ||
| EP026.2A-2C | Progeny of the ancestral Hall and Joseph 2010 mutation accumulation strain, transformed with YFR054cΔ::Scw11P::GFP | ||
| Equipment | |||
| Misonix Sonicator S-4000 with 96-pin attachment | Sonicator https://www.labx.com/item/misonix-inc-s-4000-sonicator/4771281 | ||
| Nikon Eclipse Ti-E with Perfect Focus System | Inverted microscope with automated stage and autofocus system |
References
- Geiler-Samerotte, K. A., Hashimoto, T., Dion, M. F., Budnik, B. A., Airoldi, E. M., Drummond, D. A. Quantifying condition-dependent intracellular protein levels enables high-precision fitness estimates. PloS one. 8 (9), 75320 (2013).
- Kussell, E., Leibler, S. Phenotypic diversity, population growth, and information in fluctuating environments. Science. 309 (5743), 2075-2078 (2005).
- Thattai, M., van Oudenaarden, A. Stochastic gene expression in fluctuating environments. Genetics. 167 (1), 523-530 (2004).
- King, O. D., Masel, J. The evolution of bet-hedging adaptations to rare scenarios. Theoretical population biology. 72 (4), 560-575 (2007).
- Acar, M., Mettetal, J. T., van Oudenaarden, A. Stochastic switching as a survival strategy in fluctuating environments. Nature genetics. 40 (4), 471-475 (2008).
- Avery, S. V. Microbial cell individuality and the underlying sources of heterogeneity. Nature reviews. Microbiology. 4 (8), 577-587 (2006).
- Levy, S. F., Ziv, N., Siegal, M. L. Bet hedging in yeast by heterogeneous, age-correlated expression of a stress protectant. PLoS biology. 10 (5), 1001325 (2012).
- van Dijk, D., et al. Slow-growing cells within isogenic populations have increased RNA polymerase error rates and DNA damage. Nature communications. 6, 7972 (2015).
- Ziv, N., Shuster, B. M., Siegal, M. L., Gresham, D. Resolving the Complex Genetic Basis of Phenotypic Variation and Variability of Cellular Growth. Genetics. 206 (3), 1645-1657 (2017).
- Li, S., Giardina, D. M., Siegal, M. L. Control of nongenetic heterogeneity in growth rate and stress tolerance of Saccharomyces cerevisiae by cyclic AMP-regulated transcription factors. PLoS genetics. 14 (11), 1007744 (2018).
- Plavskin, Y., Li, S., Ziv, N., Levy, S. F., Siegal, M. L. Robust colony recognition for high-throughput growth analysis from suboptimal low-magnification brightfield micrographs. bioRxiv. , (2018).
- Ziv, N., Siegal, M. L., Gresham, D. Genetic and nongenetic determinants of cell growth variation assessed by high-throughput microscopy. Molecular biology and evolution. 30 (12), 2568-2578 (2013).
- Hall, D. W., Joseph, S. B. A high frequency of beneficial mutations across multiple fitness components in Saccharomyces cerevisiae. Genetics. 185 (4), 1397-1409 (2010).
- Saleemuddin, M., Husain, Q. Concanavalin A: a useful ligand for glycoenzyme immobilization–a review. Enzyme and microbial technology. 13 (4), 290-295 (1991).
- Geiler-Samerotte, K. A., Bauer, C. R., Li, S., Ziv, N., Gresham, D., Siegal, M. L. The details in the distributions: why and how to study phenotypic variability. Current opinion in biotechnology. 24 (4), 752-759 (2013).
- Nakagawa, S., Schielzeth, H. Repeatability for Gaussian and non-Gaussian data: a practical guide for biologists. Biological reviews of the Cambridge Philosophical Society. 85 (4), 935-956 (2010).
- Bolker, J. A. Exemplary and surrogate models: two modes of representation in biology. Perspectives in biology and medicine. 52 (4), 485-499 (2009).

